枫杨树皮抗菌物质的分离鉴定研究
2015-01-11王佳佳郭占京廖彭莹李汉浠潘为高
罗 彭,王佳佳,李 兵,郭占京,廖彭莹,陈 俊,李汉浠,潘为高
广西中医药大学,南宁 530001
枫杨(Pterocarya stenoptera C.DC.)为胡桃科枫杨属植物[1],原产我国,地域分布广泛、枝条扦插即活,生长繁殖迅速,属于极易可再生资源。枫杨在抗肿瘤、抗病毒、杀灭钉螺等方面有一定的药用价值;但其更为重要的价值,是在民间作为传统外用中药用于治疗各类真菌性皮肤病和细菌性脓、疮[2],此用药习惯在古籍、古方及当代中药书籍中均有大量记载,用法是将其树皮、树叶捣碎用于治疗疥癣、脚癣、头癣[3]和其它病菌性疾病[4]。枫杨抗菌用药历史悠久,疗效肯定,用药安全性也得到了时间的验证。
枫杨的抗菌物质基础研究,目前才刚刚起步。张兴悦[5]等证实枫杨乙醇或丙酮提取物有抑菌作用,但并未开展活性单体层面的研究。笔者前期研究从枫杨树皮分离纯化得到了一个抗菌单体5-羟基-2-乙氧基-1,4-萘醌[13],但研究并不系统。本研究前期发现枫杨中还有许多尚待分离的潜在抗菌成分。本研究通过生物活性跟踪法与现代分离纯化技术结合,系统地开展枫杨的抗菌活性物质的追踪研究,尽可能全面探明其抗菌作用的物质基础,寻找新的抗菌素,同时为研制抗菌活性部位药及控制药材质量奠定基础。
1 材料与仪器
1.1 药材
药材采集于广西桂林兴安县五里峡坝区,经广西中医药大学韦松基教授鉴定为胡桃科枫杨属植物枫杨(Pterocarya stenoptera C.DC.)的树皮。药材阴干、粉碎,于4 ℃密闭保存。
1.2 试剂
石油醚(30~60 ℃、60~90 ℃两种沸程规格)、氯仿(AR)、二氯甲烷(AR)、乙酸乙酯(AR)、无水乙醇(AR)、丙酮(AR)均由西陇化工股份有限公司生产;柱层析硅胶(100~200、200~300 目)和薄层层析硅胶H(60 型)购于青岛海洋化工集团公司;10 cm×20 cm 硅胶G 板为武安市诚朋科技开发有限公司产品;Sephadex LH-20 葡聚糖为瑞士安玛西亚产品。
1.3 菌种
卡拉双球菌(Dipococcus cata)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、沙 门 氏 菌(Salmonella sp.)、白 色 念 球 菌(canidia Albicans)、棉花球菌(Cotton cocci)、鞭毛菌(Mastigomycotina)、放线菌(Actinomycete)、枯草芽孢杆菌(Bacillus subtilis)、姜瘟菌(Pseudomonas solanacearum)、小麦赤霉(Fusarium graminerum)、玉米大斑菌(Exserohilum-trucicum)、墨入菌(Phoma wasabiae)等菌种由四川大学生命科学学院微生物研究室提供。
1.4 仪器与设备
HD-650 超净台(吴江市伟峰净化设备有限公司);DZF-2001 真空干燥箱(上海浦东跃欣科学仪器厂);RE-52AA 旋转蒸发仪(上海亚荣生化仪器厂);100~1000 μL 量程及10~100 μL 量程移液枪(Eppendorf);Mettler-AE100 电子分析天平(瑞士Mettler公司);Bruker Avance-600 型和Bruker AM-400 型核磁共振波谱仪(瑞士布鲁克公司);Agilent 6890/5973N 型GC-MS 联用仪(美国安捷伦公司)。
2 实验方法
2.1 抗菌活性的测定方法
2.1.1 肉汤琼脂培养基的配制
蛋白胨10 g,氯化钠5 g,牛肉浸膏3 g,琼脂20 g,水1000 mL,加热溶化后滤过,用pH 计调pH 值至7.4~7.6,0.15 Mpa 灭菌20 min,待用(细菌、真菌在此培养基上均能良好生长)。
2.1.2 药物配制
用于实验的各化合物(药物)均进行干燥,彻底除去溶剂。药物用灭菌注射用水配制,用少量无菌DMSO 助溶,均配成统一浓度10 g/L(1.0%)。
2.1.3 琼脂平板打孔法测定抗菌活性(一菌多药,定性测定)
在无菌平皿内加入熔化的肉汤琼脂培养基,凝固后作为底层(厚约0.5 cm);再取50 ℃熔化的肉汤琼脂培养基,铺在底层之上,凝固后作为上层(厚约0.5 cm)。用推平板接种法,将供试验菌液均匀地涂布于琼脂平板的表面,用无菌打孔器打孔,孔径0.5 cm,只打穿上层琼脂,孔距2 cm,均匀分布。用移液器分别吸取各药液约90 μL 加于各琼脂孔内。于37 ℃培养18~24 h,观察孔周围有无抑菌圈,通过抑菌圈的大小比较各药物的抗菌效力。
2.2 抗菌活性成分的分离纯化
枫杨树皮粗粉3.0 kg,用约30 倍量90%乙醇渗漉提取,滤液负压浓缩回收溶剂,敞口水浴挥发得乙醇干膏约300.0 g。药材残渣,再用20 倍量水渗漉提取,滤液浓缩干燥后得水提取干膏约233.0 g。
进行抗菌测定,发现水提取物对各菌无明显抑制作用,90%乙醇提取物对卡拉双球菌、白色念球菌、棉花球菌、鞭毛菌、放线菌、大肠杆菌、姜瘟菌、金黄色葡萄球菌、玉米弯孢菌、玉米大斑菌、墨入菌均具有不同程度的抑制作用,其中对卡拉双球菌、小麦亦霉的抑制作用最强。故而后续抗菌活性成分的分离纯化起始部位采用90%乙醇提取物,选用抗菌效果最为显著的卡拉双球菌(细菌)、小麦赤霉(真菌)作为筛选活性成分的实验用菌。
300 g 乙醇提取物用适量热水悬浮,用60~90℃沸程石油醚、氯仿、乙酸乙酯、正丁醇依次萃取,得石油醚部位51 g、氯仿部位42 g、乙酸乙酯部位44 g、正丁醇部位77 g、水层部位86 g,经抗菌实验发现,氯仿部位有很强的抗菌作用,石油醚部位、乙酸乙酯部位抗菌作用较弱,正丁醇部位和水层部位无抗菌作用。
40 g 氯仿部位用甲醇热溶,适量硅胶分散制样并干燥。1000 g 硅胶(100~200 目,柱内径10 cm)湿法装柱,上样,用氯仿:甲醇梯度洗脱(80∶1→40∶1→20∶1→10∶1→5∶1→甲醇),得6 个梯度流份。经体外抗菌指标检测,40∶1、10∶1、5∶1 流份段有高活性,其余流份段无活性。
将上述40∶1 流份段(量较大)上硅胶中柱(200~300 目,柱内径5 cm,高20 cm),用石油醚∶乙酸乙酯梯度洗脱(20∶1→10∶1→甲醇),得到3 个梯度流份,经体外抗菌指标检测,其中10∶1、甲醇流份段为高活性段,20∶1 流份段为低活性段。将10∶1 流份段上硅胶小柱(薄层硅胶H,柱内径2 cm,高30 cm,N2加压),经石油醚∶乙酸乙酯梯度洗脱(10∶1→甲醇),得红色针状结晶1(24 mg)、2(20 mg)和甲醇段,经体外抗菌指标检测,结晶1、2 均有明显的抑菌效果,而甲醇段无活性。
将上述40∶1 中得到的高活性甲醇流份段直接上硅胶小柱,经石油醚∶乙酸乙酯梯度洗脱(4∶1→2∶1→乙酸乙酯),在2∶1 梯度洗脱时分离得到黄色针状结晶3(10 mg),经抗菌指标检测,结晶3 有明显的抑菌效果,其余流份段无活性。
将乙酸乙酯部位(28 g)上硅胶大柱,用二氯甲烷∶甲醇梯度洗脱,在5∶1 梯度得到浅黄色针状结晶4,经体外抗菌指标检测,有明显的抑菌效果。
对抗菌活性结晶1、2、3、4 分别用Sephadex LH-20 葡聚糖凝胶色谱柱进行除杂,二氯甲烷∶甲醇(1∶1)洗脱,得到各高纯度单体,经TLC 薄层确定纯度,用于结构研究。
2.3 抗菌活性物质的结构鉴定
EI-MS 在Agilent 6890/5973N 型GC-MS 联用仪上进行,电离方式EI+,电子能量70 eV,扫描范围50~1000 Da。
1D NMR(1H、13C、DEPT)和2D NMR(HSQC、1H-1H COSY、HMBC)在Bruker Avance-600 型和Bruker AM-400 型核磁共振波谱仪上进行。1H 频率为600(或400 MHz),13C 频率为125(或100)MHz,溶剂为CDCl3或CD3OD,TMS 为内标,常温20 ℃测定。
3 实验结果
化合物1 红色针状结晶,易溶于乙酸乙酯、丙酮、氯仿、甲醇,不溶于水。三种不同的展开剂系统进行硅胶TCL 检测,氨显,均为粉红色单斑[石油醚∶乙酸乙酯(8∶1),Rf=0.40;石油醚∶丙酮(6∶1),Rf=0.0.48;氯仿∶甲醇(60∶1),Rf=0.83],纯度符合波谱测定要求。EI-MS m/z∶174[M]+(基峰),146,118,92,63.综合分析化合物1 的1H NMR、13C NMR、DEPT、HSQC、1H-1H COSY 和HMBC 数据(表1),并参照文献[6],确定该化合物为5-羟基-1,4-萘醌(C10H6O3,M=174,胡桃醌,图1)。
化合物2 红色针状结晶,易溶于乙酸乙酯、丙酮、氯仿、甲醇,不溶于水。三种不同的展开剂系统进行硅胶TCL 检测,氨显,均为粉红色单斑[石油醚∶乙酸乙酯(2∶1),Rf=0.65;石油醚∶丙酮(4∶1),Rf=0.43;氯仿∶甲醇(80∶1),Rf=0.62],纯度符合波谱测定要求。EI-MS m/z∶204[M]+(基峰),174,147,105,63.综合分析化合物2 的1H NMR、13C NMR、DEPT、HSQC、1H-1H COSY 和HMBC 数据(表1),并参照文献[7],确定该化合物为5-羟基-2-甲氧基-1,4-萘醌(C11H8O4,M=204,图1)。
化合物3 黄色针状结晶,易溶于乙酸乙酯、丙酮、氯仿,不溶于甲醇、水。三种不同的展开剂系统进行硅胶TCL 检测,紫外下均显暗紫色单斑[石油醚∶乙酸乙酯(1∶1),Rf=0.42;石油醚∶丙酮(2∶1),Rf=0.43;氯仿∶甲醇(30∶1),Rf=0.75],纯度符合波谱测定要求。EI-MS m/z∶168[M]+,153,127,97,69(基峰),50。综合分析化合物3 的1H NMR、13C NMR、DEPT、HSQC、1H-1H COSY 和HMBC 数据(表1),并参照文献[8],确定该化合物为2,6-二甲氧基-1,4-对苯醌(C8H8O4,M=168,图1)。
化合物4 浅黄色针状结晶,溶于甲醇,不溶于氯仿。三种不同的展开剂系统进行硅胶TCL 检测,硫酸-乙醇显色及碘显色,均为棕黄色单斑[环己烷∶乙酸乙酯(6∶1),Rf=0.74;石油醚∶乙酸乙酯∶冰醋酸(40∶10∶1),Rf=0.70;氯仿∶甲醇∶冰醋酸(9∶4∶1),Rf=0.54],纯度符合波谱测定要求。EI-MS m/z:170[M]+(基峰),153,152,125,77;1H NMR(400 MHz,CD3OD)δ:7.06(2H,s,H-2,6);13C NMR和DEPT(100 MHz,CD3OD)δ:170.5(C-7,C),146.4(C-3,5,C),139.6(C-4,C),121.9(C-1,C),110.3(C-2,6,CH)。核磁数据与文献报道[9]的没食子酸的数据一致,因此化合物4 鉴定为3,4,5,-三羟基苯甲酸(C7H6O5,M=170,图1)。
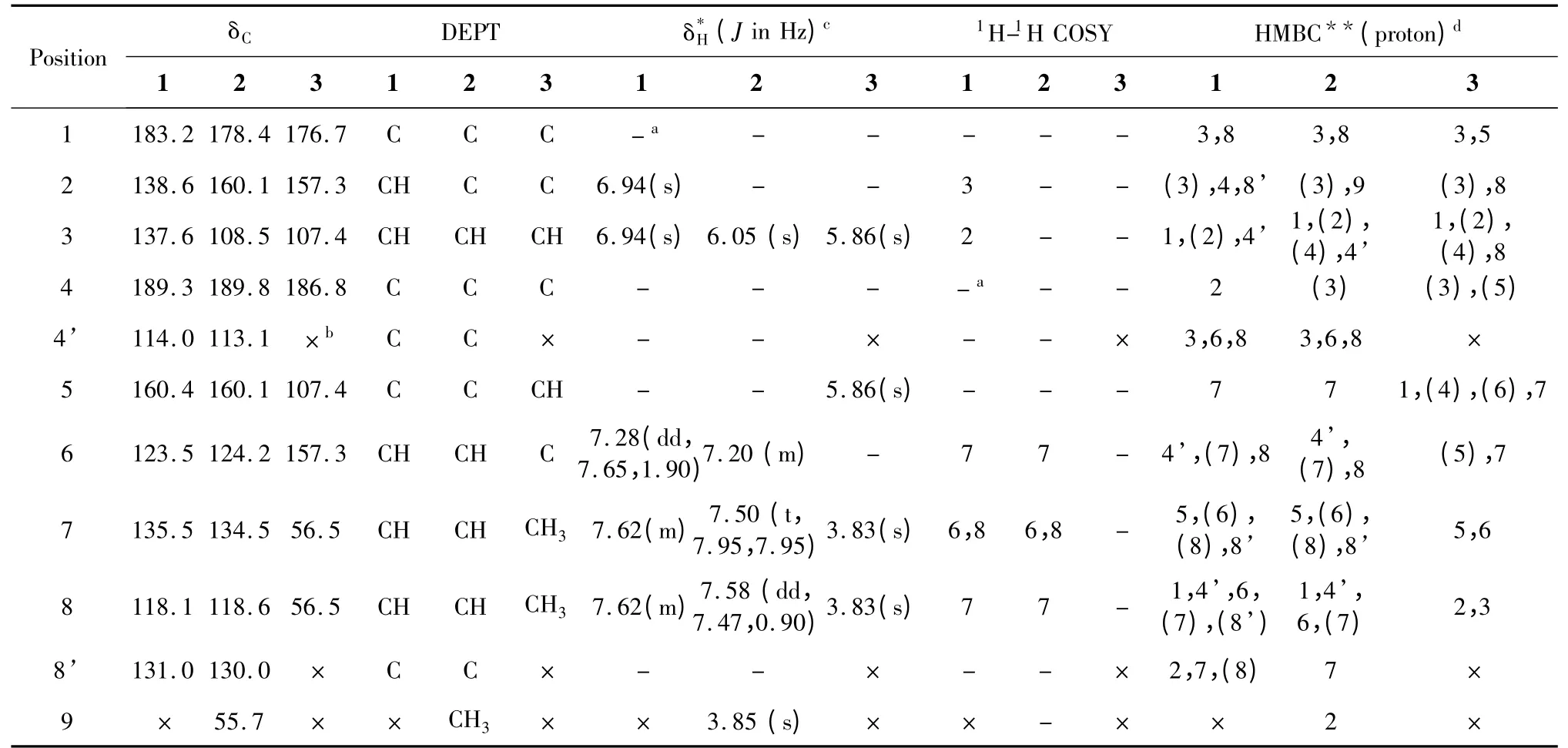
表1 化合物1、2、3 的一维和二维核磁谱数据(600/150 MHz to TMS,CDCl3)Table 1 1D-and 2D NMR spectral data of compounds 1,2 and 3(in CDCl3at 600/150 MHz to TMS)
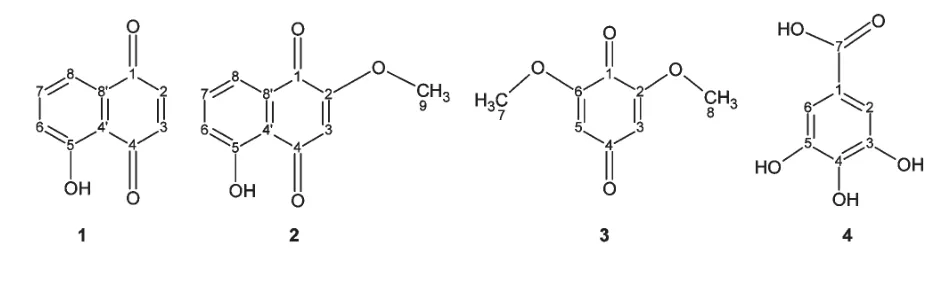
图1 化合物1、2、3 和4 的结构式Fig.1 Structure of compound 1,2,3 and 4
4 讨论
本研究通过生物活性跟踪法结合现代分离纯化技术,发现枫杨乙醇提取物及其氯仿萃取部位有明显抑菌作用,而石油醚或乙酸乙酯部位抑菌作用较弱,正丁醇或水部位无抗菌作用;首次从氯仿部位和乙酸乙酯部位筛选出4 个高活性抗菌单体,分别为5-羟基-1,4-萘醌(1)、5-羟基-2-甲氧基-1,4-萘 醌(2)、2,6-二甲氧基-1,4-对苯醌(3)、没食子酸(4)。本研究采用化学结合生物活性追踪法得到的抗菌活性单体,与一般的化学方法分离得到的化学成分的方式有所区别,同时所有活性成分均为首次从枫杨中获得。
5-羟基-1,4-萘醌(1)又名胡桃醌,抗菌谱广,抗菌效价高,主要在对数期,通过破坏菌体的细胞壁或细胞膜结构抑制细菌生长[10]。2,6-二甲氧基-1,4-对苯醌(3)抗菌谱广,在很低浓度下即可杀灭多种致病性细菌、真菌[11]。没食子酸(4)对6 种常见食源性致病菌和腐败菌的最小抑菌浓度为0.125~4.000 mg/mL,主要抑制菌体在对数生长期的分裂[12]。除了本研究所筛选到的4 个高活性抗菌单体,笔者先前已从枫杨树皮筛选鉴定出另一个高活性抗菌单体5-羟基-2-乙氧基-1,4-萘醌[13],经抗菌测定,发现该物质抗菌谱较广,对多种细菌、真菌有显著拮抗作用,抗菌活性强度近似于左氧氟沙星[14]。该物质与5-羟基-2-甲氧基-1,4-萘醌(2)在结构上只是取代基(乙氧基、甲氧基)的差异。
可见枫杨抗菌成分类别或化学结构母核丰富,其抗菌物质基础由一系列(目前发现5 个)的抗菌活性物质组成,它们的碳骨架分别属于苯醌(1 个)、萘醌(3 个)、苯甲酰(1 个)三类化学母核。
枫杨树皮外用抗菌用药历史悠久,疗效肯定;枫杨植物地域分布广,极易再生,资源优势明显。本研究及前期研究发现枫杨集3 类抗菌结构母核、5 个抗菌成分于一身,是一味难得的抗菌中药;多类别的抗菌单体,可能从多机理途径、多靶位点发挥抗菌疗效,为开发出不易产生耐药性的外用抗菌部位药提供理论基础。本研究揭示的多抗菌母核组成的枫杨抗菌物质基础,也为枫杨药材的质量标准制定奠定了基础。
1 Nanjing University of Chinese Medicine(南京中医药大学).Chinese Materia Medica Dictionary,2nd Ed(中药大辞典第二版).Shanghai:Shanghai Science and Technology Publishers(上海科学技术出版社),2006.1821-1822.
2 Xie ZW(谢宗万).The Compilation of Chinese Herbal Medicine,2nd Ed,Volume 1(全国中草药汇编,第二版,上册).Beijing:People's Medical Publishing House(人民卫生出版社),1996.511-512.
3 Jia JR(贾俊荣),Tian QA(田秋爱).Treating ringworm of the foot by Pterocarya stenoptera leafs.Zhejiang J Integr Tradit Chin Western Med(浙江中西医结合杂志),2004,14(2):85.
4 Xu ZR(徐志荣),Zhang B(张斌),Wang QF(王秋发),et al.Treating eczema of the ear by lotion from Pterocarya stenoptera.J New Chin Med(新中医),2007,39:105.
5 Zhang XY(张兴悦).Screening antifungal plants and study on antifungal activity of Pterocarya stenoptera.Dalian:Liaoning Normal University(辽宁师范大学),MSc.2007.
6 Xu SH(许绍惠),Tang WP(唐碗屏),Han ZH(韩忠环).Studies on the toxicity constituents of juglans mandshurica maxim.J Shenyang Agric Univ(沈阳农业大学学报),1986,17(2):34-39.
7 Lin JY(林君阳),Ma LJ(马良进),Chen AL(陈安良),et al.Chemical components and antifungal activities of extracts from the husk of Carya cathayensis.J Zhejiang Forest Coll(浙江林学院学报),2009,26:100-104.
8 Guo XD(郭新东),An LC(安林冲),Xu D(徐迪),et al.The chemical constituents of Heliicteres angustifolia Linn.(I).Acta Sci Nat Univ Sunyatseni(中山大学学报,自科版),2003,42(2):52-55.
9 Wang XS(王雪松),Che QM(车庆明),Li YM(李艳梅),et al.A study on chemical constituents in seeds of Crataegus pinnatifida Bge.var.major N.E.Br.China J Chin Mater Med(中国中药杂志),1999,24:739-740.
10 Wu ZX(吴朝霞),Jin N(金楠),Zhang M(张敏),et al.Study on the effect of juglone on inhibiting bacterial growth.Sci Tech Food Ind(食品工业科技),2012,33:131-134.
11 Nishina A,Uchibori T.Antimicrobial activity of 2,6-dimethoxy-p-benzoquinone,isolated from thick-stemmed bamboo,and its analogs.Agric Biol Chem,1991,55:2395-2398.
12 Zhang YL(张雅丽).The extraction preparation of gallic acid from Galla Chinensis Tannin and its antimicrobial activities and related mechanisms.Shanxi:Shanxi Normal Univertity(陕西师范大学),MSc.2013.
13 Pan WG(潘为高),Li HX(李汉浠),Luo P(罗彭),et al.Study on antibacterial activity constituent from Pterocarya stenoptera.Chin J Exp Tradit Med Form(中国实验方剂学),2010,16(8):82-84.
14 Li HX(李汉浠),Ren SS(任赛赛),Li Y(李勇),et al.Antimicrobial spectrum,MIC and MBC of naphthoquinonefrom Pterocarya stenoptera to common strains.Lishizhen Med Mater Med Res(时珍国医国药),2012,23:1422-1424.
