浊点萃取法结合超声波提取连翘叶中叶绿素
2015-01-11栗亚云陈廷贵张立伟
栗亚云,陈廷贵,张立伟
化学生物学与分子工程教育部重点实验室 山西大学分子科学研究所,太原 030006
叶绿素用途非常广泛,可用于医药、保健品、化妆品、食品色素以及化工等领域[1-4]。在药用方面,叶绿素是强抗氧化剂,可防止各种氧自由基所致的氧化损害,从而减少DNA 损伤[5,6];此外,叶绿素还能有效抑制黄曲霉毒素的致癌效应,具有显著的抗癌作用[7,8];同时叶绿素以及叶绿素铜钠盐等还具有抗贫血、抗溃疡、抗菌、抗病毒、保肝排毒等诸多药理作用[9]。在化妆品方面,近年来人工合成色素导致皮肤病急剧增加,由合成色素而引起的皮肤功能障碍占43.9%,长期使用会使皮肤对光线敏感,从而导致色素沉着,还伴有皮肤潮红、丘疹等炎症现象[10]。在食品色素方面,国内由于苏丹红事件,合成色素受到严格的限制,美国批准的合成色素从700 种锐减到了7 种[11],人们越来越多的开始重视天然色素的研究应用。除上述应用之外,叶绿素还可应用于军事伪装和光动力学治疗癌症等方面[12,13]。
常用的叶绿素的提取方法,主要有以下几种:丙酮研磨法、溶剂加热提取法、浸渍压榨法、超声波提取法、微波辅助提取法、超临界流动萃取法和生物工程法等。溶剂提取法最常使用,该方法工艺简单,但试剂用量大。浸渍压榨法浸渍时间长,产品得率低,溶剂消耗量也很大。超临界流体萃取法萃取温度低、速度快,但超临界萃取设备投资费用过高,影响其应用推广。生物工程法步骤多,工作量较大[14]。上述各方法提取所使用的溶剂一般包括乙醇、丙酮、苯、氯仿、乙醚、石油醚等有机溶剂,这些溶剂易燃、易爆、有挥发性,有的还有毒性,安全性差[2,15,16]。
浊点萃取技术(Cloud Point Extraction,CPE),以水代替有机溶剂作为萃取剂,通过加入少量表面活性剂产生浊点现象而实现高效提取[17,18]。连翘叶为木犀科连翘属植物连翘[Forsythia suspensa(Thunb.)Vahl]的叶子,连翘作为一种常用中药,具有抗炎、抗病毒、解热、抗肝损伤、抑制cAMP 磷酸二酯酶等作用,我国连翘年产量约在7500 吨左右[19,20],资源丰富,人们在对连翘果实利用的同时往往忽略了叶子的利用,造成资源的极大浪费,因此开发连翘叶具有重要意义。
本研究首次使用Triton X-114 水溶液作为提取溶剂,结合超声波技术,以连翘叶为例提取叶绿素,取得了成功。该方法打破了长期以来只能使用有机溶剂提取叶绿素的限制,为叶绿素的开发利用提供了一种经济、安全、高效、简便、省时、环保新方法。
1 材料与方法
1.1 材料与试剂
连翘叶,采于山西大学校园内,经山西大学张立伟教授鉴定为木犀科连翘属植物连翘的叶子。采样后,将新鲜连翘叶洗净、沥水,摊开放置于阴凉处,阴干,粉碎。
Triton X-114 购买于Solarbio 科技有限公司,95%乙醇、无水乙醇等均为国产分析纯试剂。
1.2 仪器与设备
微型高速万能试样粉碎机(黄烨市齐家荣科学仪器厂)、OHAUS CP114 电子天平(美国奥豪斯仪器有限公司)、KQ-250 DB 数控超声波清洗器(巩义市英峪予华仪器厂)、SHZ-C 型循环水式多用真空泵(巩义市英峪予华仪器厂)、Varian Cary 50 紫外-可见分光光度计(美国Varian 公司)、10 mm 石英荧光比色皿(江苏晶禾光学仪器有限公司)。
1.3 实验方法
1.3.1 叶绿素浊点萃取
准确称取连翘叶粉末10 g,置于250 mL 圆底烧瓶中,加入100 mL 5%的Triton X-114 水溶液,盖塞,振荡混匀,250 W 超声处理15 min,抽滤,得滤液,将其倒入分液漏斗,静置分层,去除下层水相,取上层表面活性剂富集相。加入30 mL 95%乙醇以降低体系粘度,用0.45 μm 滤膜过滤除去Triton X-114,将滤液浓缩,得叶绿素浸膏。
取少量叶绿素浸膏溶于95%乙醇,用紫外可见分光光度计对400~800 nm 波段进行扫描,然后根据Amon 公式对叶绿素含量进行计算[2]。
1.3.2 单因素考察
1.3.2.1 Triton X-114 浓度的确定
准确称取0.5 g 连翘叶粉末6 份,分别置于10 mL 锥形瓶中,依次加入5 mL 浓度为1%、2%、3%、4%、5%、8%的Triton X-114 水溶液,盖塞,振荡混匀,250 W 超声处理15 min,抽滤,将滤液转移至250 mL 容量瓶中,用95%乙醇定容,分别测定其在665 nm 处的吸光度值。重复3 次实验。
1.3.2.2 超声时间的确定
按上述方法,设定料液比为1∶10,Triton X-114水溶液浓度为4%,分别测定超声时间为8、10、13、15、18、20 min 时,665 nm 处的吸光度值。重复3 次实验。
1.3.2.3 料液比的确定
按上述方法,设定Triton X-114 水溶液浓度为4%,超声时间为13 min,分别测定料液比为1∶6、1∶8、1∶10、1∶12、1∶15 时,665 nm 处的吸光度值。重复3 次实验。
1.3.3 正交试验设计
根据各单因素实验所得的Triton X-114 浓度、超声时间、料液比3 个因素的最佳条件,进行三因素三水平L9(33)正交试验,设计结果见表1。
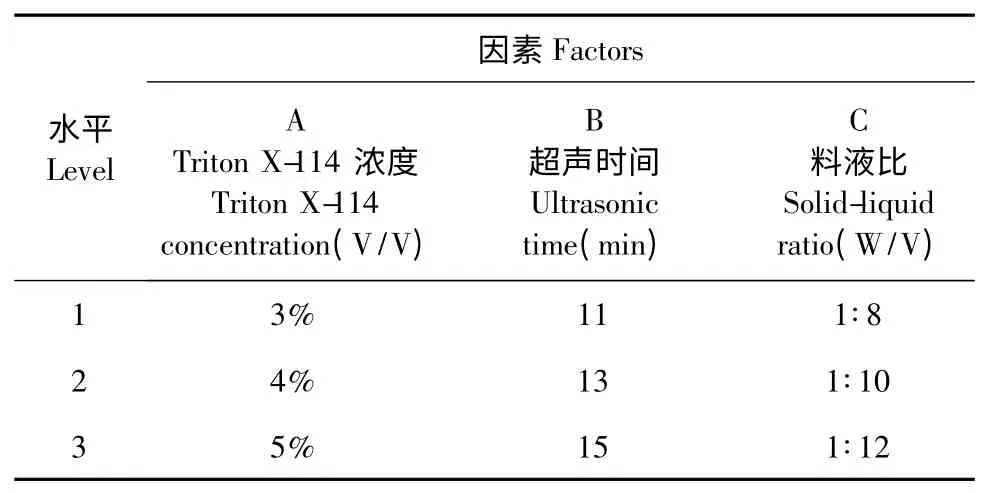
表1 正交试验水平因素Table 1 Factors and levels of orthogonal experiments
1.3.4 与传统溶剂提取法和超声波提取法比较
准确称取0.5 g 连翘叶粉末3 份,置于锥形瓶中,分别按照本实验提取方法、刘邻渭等[4]的传统溶剂提取法和超声波提取法(以乙醇替代本实验提取方法中的提取溶剂,其它条件不变)提取叶绿素,提取完毕后,分别将提取液转移至250 mL 容量瓶中,用95%乙醇定容,测定其在665 nm 处的吸光度值。重复3 次实验。
2 结果与讨论
2.1 叶绿素提取物光谱分析
用紫外-可见吸收分光光度计对实验所得叶绿素提取物进行扫描,得紫外可见吸收光谱如图1。由图可知提取液在665 nm 处有明显的吸收峰,610、430、410 nm 处均有吸收峰,与文献报道叶绿素a 出峰位置一致,因此可判定该提取方法成功地从连翘叶中提取到了叶绿素。本文选用665 nm 处的吸光度值作为进一步分析叶绿素提取效率高低的指标。
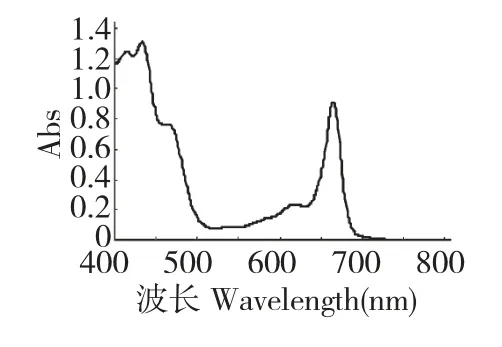
图1 连翘叶提取物紫外可见吸收光谱图Fig.1 UV-VIS spectrum of F.suspensa leave extract
2.2 单因素筛选结果
对该提取方法中的Triton X-114 浓度、超声时间、料液比进行各单因素考察,结果见图2。由图2(A)可得,随着Triton X-114 浓度的增加,吸光度值逐渐升高,但是浓度达到4%后,吸光度值随浓度的增加略有降低,所以得Triton X-114 的最佳浓度是4%。当Triton X-114 浓度大于4%时,提取率下降的原因是随着表面活性剂浓度增大,整个提取体系粘度增大,这不利于叶绿素的浸出扩散,故而提取率开始下降。
由图2(B)可得,随着超声时间的延长,吸光度值逐渐升高,但当时间达到13 min 后,吸光度值随时间的延长有明显下降趋势,故最佳超声时长为13 min。由于超声波本身的机械和生化效应会对叶绿素造成一定的破坏[21],因此当超声时间过长时,提取率表现为一定程度的下降。
由图2(C)可知,随着料液比的增长,吸光度值逐渐升高,但当其比例达到1∶10 以后,吸光度值随料液化的增加略有降低,因此最佳料液比为1∶10。这可能是因为用相同功率的超声波辅助提取时,超声波在较多溶剂的体系中,被溶剂介质吸收而衰减的能量较多,使提取出来的叶绿素量减少[22],当料液比达到一定比例时,该因素的影响开始占主导作用,从而导致叶绿素的提取率呈下降趋势。
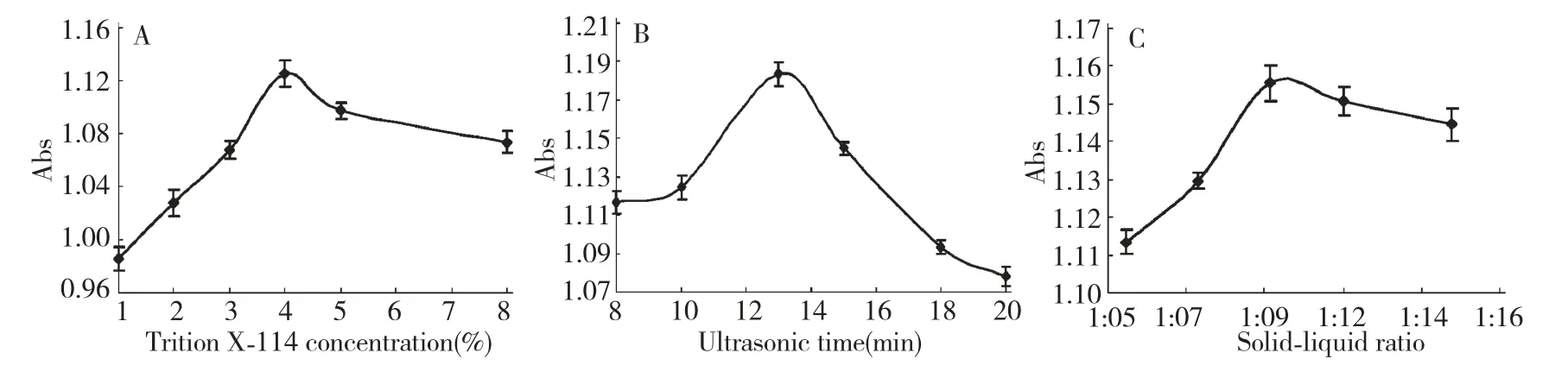
图2 Triton X-114 浓度(A)、超声时间(B)、料液比(C)对叶绿素提取效果的影响Fig.2 Effects of Triton X-114 concentration(A),ultrasonic time(B),Solid-liquid ratio(C)on the extraction yield of chlorophyll
2.3 正交试验结果
采用Minitab 软件设计L9(33)正交试验,对其结果进行方差分析,结果见表2、表3。

表2 正交试验结果分析Table 2 Orthogonal test results
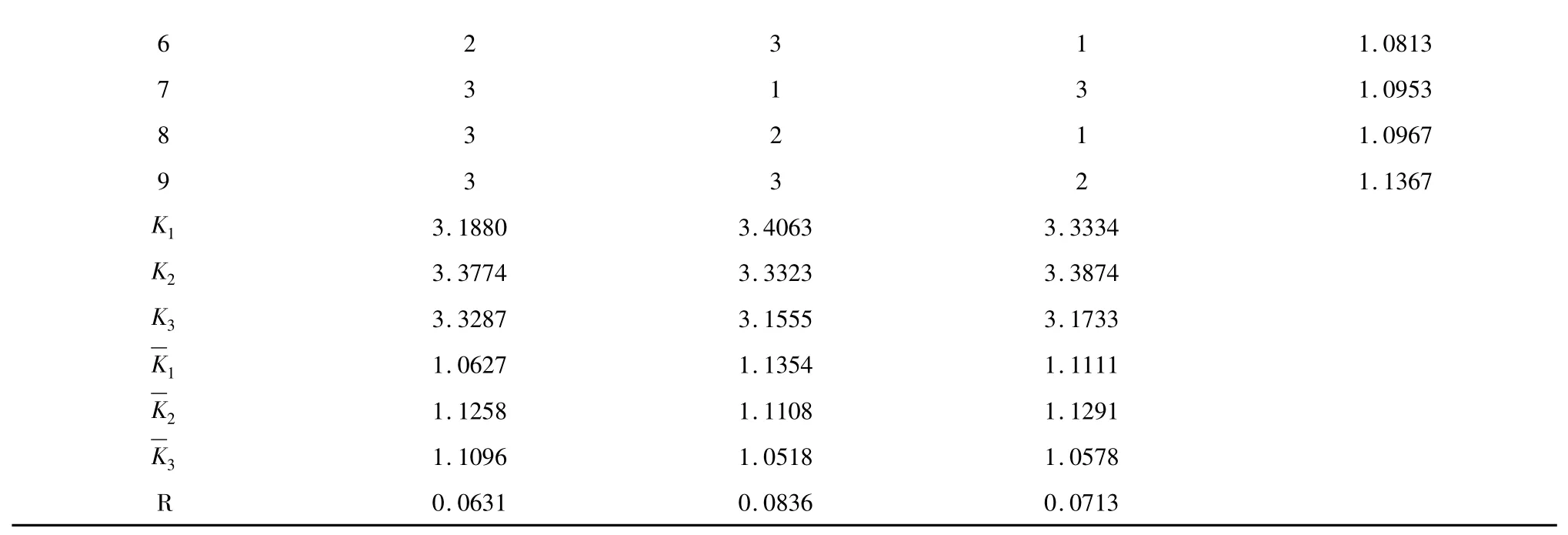
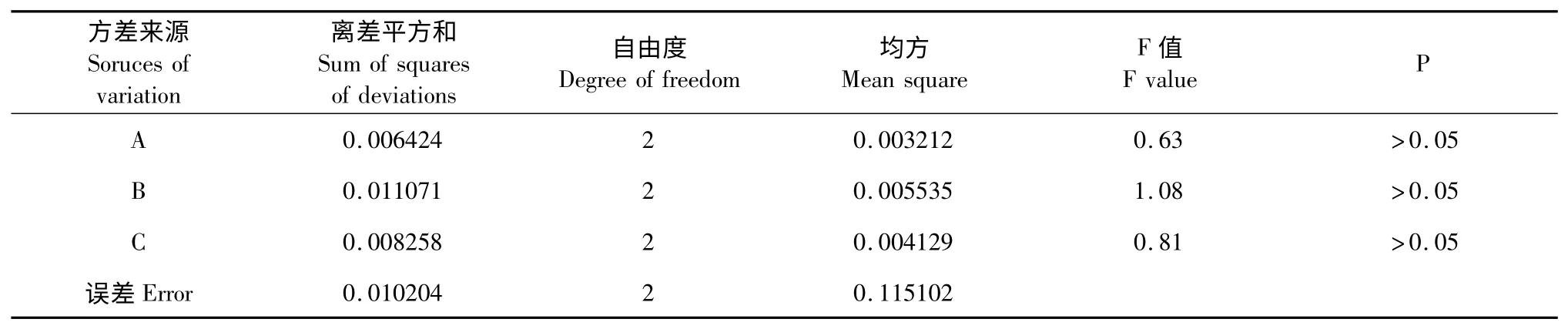
表3 方差分析Table 3 Analysis of variance
从表2 中可知,因素A(Triton X-114 浓度)的K值:K2>K3>K1;因素B(超声时间)的K 值:K1>K2>K3;因素C(料液比)的K 值:K2>K1>K3;说明最优水平为:A2B1C2。在所选因素水平范围内,因素B的极差R 最大,因此超声时间是主要影响因素;其次是因素C 和A,故各因素对叶绿素得率的影响程度依次为B>C>A。
从表3,F 值大小依次为B>C>A,与极差分析结果一致。各因素对实验结果均无显著性影响。因此,浊点萃取法结合超声波提取叶绿素的最佳条件为A2B1C2,即Triton X-114 浓度为4%,超声时间为11 min,料液比为1∶10。
以正交试验所得最佳提取条件重复提取3 次,检测得665 nm 处的平均吸光度值为1.1805,计算得叶绿素平均提取率为6.65 mg/g,详见表4。
2.4 与传统方法和超声波提取法比较讨论
按“1.3.4”项方法进行实验,重复3 次,结果如表4 所示。从表中可知,该提取方法与传统工艺相比,平均提取率提高了9.92%,同时该方法具有安全、无污染、经济、省时、无需加热、节约能源等优点;与超声波提取法相比,在相同条件下,平均提取率提高了11.58%。
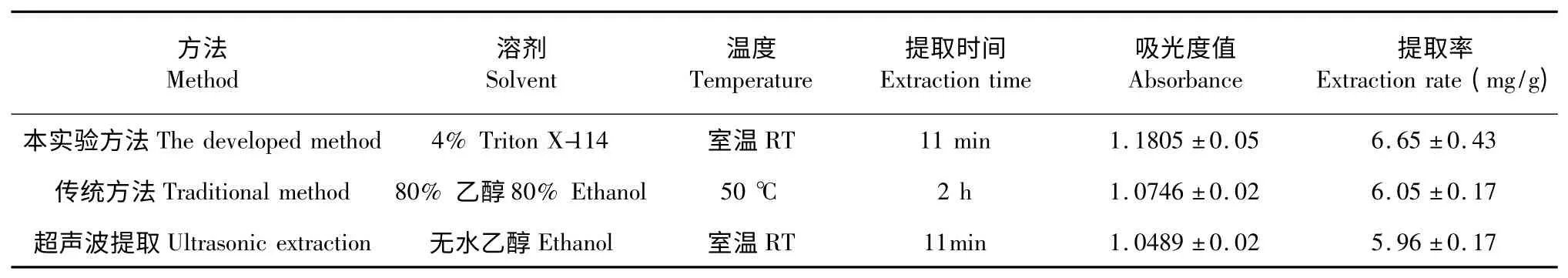
表4 不同提取方法提取叶绿素比较Table 4 Comparison of different chlorophyll extraction methods
3 结论与展望
本研究提供了一种新的提取叶绿素的方法。首先,本提取方法以Triton X-114 水溶液为提取剂,具有工艺设备简单、不使用挥发性有毒试剂、安全、环保、省时、无需加热、节约能源、提取率高等优点,这为企业安全、经济、高效生产叶绿素提供了保证。其次,连翘以果实入药,但连翘叶大都被弃之不用,造成了资源的极大浪费,本研究从连翘叶中提取叶绿素,为综合开发连翘资源打下了基础。第三,对于含叶绿素茎叶的中草药,要提取它们的有效成分,首要任务就是去除叶绿素,本研究为去除连翘叶及其它中草药中叶绿素提供了一种新手段。第四,该方法适用于从任何含叶绿素的植物的茎和叶中提取叶绿素,且使叶绿素的获取变得更加容易,这将会促进叶绿素在医药、保健品、化妆品、食品色素以及化工等领域的广泛应用。
1 Xie HB(谢惠波),Yang ZW(杨宗伟),Chen L(陈丽),et al.Natural pigment-a review on the extraction,development and utilization of chlorophyll.China Food(中国食品工业),2010,2:58-60.
2 Huang CD(黄持都),Hu XS(胡小松),Liao XJ(廖小军),et al.The advancement of chlorophyll.China Food Addit(中国食品添加剂),2007,3:114-118.
3 Huang SW(黄寿吾).Pharmacology and clinical application of chlorophyll.Food Drug A(食品与药品A),2006,8(4):5-8.
4 Liu LW(刘邻渭),Yuan L(袁琳),Sun LF(孙丽芳),et al.Comparison of extraction rates,stabilities and application properties of chlorophyll from 8 kinds of leaves.Sci Tech Food Ind(食品工业科技),2012,1:245-249.
5 Cervantes B,Yahia EM,Victoria C,et al.Antioxidant activity and content of chlorophylls and carotenoids in raw and heat-processed Jalapeno peppers at intermediate stages of ripening.Food Chem,2014,146:188-196.
6 Ursula M,Lanfer M,Rosa MC,et al.Antioxidant activity of chlorophylls and their derivatives.Food Res Int,2005,38:885-891.
7 Mario G,Ferruzzi,Joshua BD,Absorption,and cancer preventative activity of dietary chlorophyll derivatives.Nutr Res,2007,27:1-12.
8 Patricia AE,Wang JB,Zhu YR,et al.Chlorophyllin intervention reduces aflatoxin-DNA adducts in individuals at high risk for liver cancer.P Natl Acad Sci USA,2001,98:14601-14606.
9 Zheng GD(郑国栋),Ouyang W(欧阳文),Yan M(颜苗),et al.The pharmacological advancement of chlorophyll and its derivatives.Cent South Pharm(中南药学),2006,4:146-148.
10 Wu J(吴晶),Huang L(黄澜),Lv GY(吕圭源),et al.Review in the research of pharmacological activities of natural pigment.Lishizhen Med Mater Med Res(时珍国医国药),2005,16:915-916.
11 Shen GQ(沈国强),Yang CX(杨春霞),Zhang D(张栋),et al.Research and development of nature colorant(dyestuff).Dyest Color(染料与染色),2009,46:7-10.
12 Yang YJ(杨玉杰),Hu BR(胡碧茹),Wu WJ(吴文健),et al.Stabilization and camouflage application of chlorophyll.J Funct Mater(功能材料),2011,42:374-376.
13 Liu XP(柳新平),Wang XM(王新明),Zhou KW(周开文),et al.The advancement of chlorophyll in cancer prevention and treatment progress.Chin J Clin Oncol Rehab(中国肿瘤临床与康复),2007,14:269-271.
14 Hui QS(惠秋沙).Outline of research on natural pigments.J North Pharm(北方药学),2011,8(5):3-4.
15 Meng QY(孟庆廷).Research Development on Production and Stability of Chlorophyll.Hebei Chem Eng Ind(河北化工),2009,32(3):2-3.
16 Guan JY(关锦毅),Hao ZB(郝再彬),Zhang D(张达),et al.A review on the extraction,detection and Biological function of chlorophyll.J Northeast Agric Univ(东北农业大学学报),2009,40:130-134.
17 Zain NNM,Abu BNK,Mohamad S,et al.Optimization of a greener method for removal phenol species by cloud point extraction and spectrophotometry.Spectrochim Acta A,2014,118:1121-1128.
18 Liu TT,Cao P,Geng JP,et al.Determination of triazine herbicides in milk by cloud point extraction and high-performance liquid chromatography.Food Chem,2014,142:358-364.
19 Yan LL(闫丽丽),Jiang Y(姜颖).The summary of the main chemical components and pharmacological activity research of Forsythia medicinal.China New Technol Prod(中国新技术新产品),2011,11:11.
20 Li HP(李焕普).May have one thousand tous gap of Forsythia supply this year.J Chin Tradit Med(中国中医药报),第2549 期.
21 Ma HY(马海燕),Zhang M(张慜),Sun JC(孙金才).The application study of ultrasonic-ozone combined treatments in quick-frozen Broccoli.J Food Sci Biotech(食品与生物技术学报),2010,29:538-543.
22 Wang LJ(王立娟).Technology for extracting chlorophyll from leaves of Syringa oblata L.by ultrasonic-assisted method.T CSAE(农业工程学报),2001,25:171-174.
