毛尖茶叶多糖及其结合物的抗氧化活性研究
2015-01-11王孟君于海燕田旭东范海涛2
曲 伟,王孟君,于海燕,刘 钰,田旭东,范海涛2,,4*
1 北京联合大学,北京 100101;2 军事医学科学院,北京 100850;3 北京电子科技职业学院生物工程学院,北京 100029;4 北京大学医学部药学院,北京 100191
茶叶作为历史悠久的饮品,经研究具有降血糖、降血脂、抗氧化、清除自由基、提高免疫力和抗肿瘤等活性[1,2],罗祖友等[3,4]阐明了藤茶多糖抗氧化和清除自由基与抗肿瘤、提高免疫力的作用关系,为研究和理解植物多糖的药理活性提供了依据。诸多研究表明,茶叶中多种化学成分产生抗氧化和清除自由基活性,包括多酚类、氨基酸、儿茶素、多糖等[5,6],关于茶叶多糖的抗氧化和清除自由基活性研究均是以不同方法处理的茶叶多糖作为活性测试对象[7,8],多糖结合物对多糖活性贡献的研究至今未见报道。
多糖属于多羟基大分子物质,可与其他物质结合形成多糖复合物,结合物的活性会表现在多糖复合物的活性中,Chen HX 等[9]在绿茶抗氧化活性研究中称研究对象为多糖结合物(polysaccharide conjugate)。王元凤等[10]通过实验证实茶多糖结合金属离子形成络合物后清除自由基活性会发生变化,提示直接将除蛋白后并以多种常规方法精制的多糖作为研究对象考察多糖的抗氧化和清除自由基活性的结果并不能真实反映多糖本身及其结合物的活性,具有一定的局限性,多糖结合物对多糖活性的贡献不应被忽视。
本研究采用水提醇沉法提取毛尖茶叶多糖,经多步处理后得到精制多糖(MP),将MP 水解完全使糖苷键断裂结合物得到释放,水解产物经C18柱层析分离后得到多糖水解的单糖及水溶性物质部分和极性较小的多糖结合物部分,即水洗脱部分(MPHCW)和甲醇洗脱部分(MP-HCM),并以DPPH 自由基清除法和普鲁士蓝法测定其活性,计算各部分的相应活性贡献值。
1 仪器与材料
1.1 仪器
CARY 50 全波长紫外扫描仪,瓦里安公司;WZZ-2S 自动旋光仪,上海精密科学仪器有限公司;安捷伦7890A-5975C 气相色谱-质谱联用仪,DB-5色谱柱(30 m×0.25 mm×0.25 μm),质谱检测器,安捷伦科技有限公司;安捷伦1200 高效液相色谱仪,G1352A RID 检测器,安捷伦科技有限公司;Shodex®KS-805 凝胶色谱柱,9 mm×250 mm;旋转蒸发仪,德国Heidolph;电子天平,奥豪斯公司;高速离心机,上海安亭科学仪器厂;冷冻干燥机,天津因赛科技发展有限公司;紫外可见分光光度计,尤尼柯(上海)仪器有限公司;电热恒温鼓风干燥箱,上海精宏实验设备有限公司;电热恒温水浴锅,北京长安永剑科学仪器有限公司。
1.2 材料
DPPH(1,1-二苯基-2-三硝基苯肼),Sigma 公司;多糖分子量测定用标准品Dextran,Sigma 公司,美国聚合物标准品公司;毛尖茶叶,购于吴裕泰北京北苑店(产地河南信阳);十八烷基键合硅胶(C18),silicycle®C18;透析袋,MYM®,截留分子量2000 Da;苯酚,为重蒸苯酚,购自北京鼎国生物技术有限责任公司;VC,分析纯,北京长城化学试剂厂;葡萄糖、木糖、半乳糖、阿拉伯糖、甘露糖、氯化钠、三氯甲烷、正丁醇、无水乙醇等试剂均为分析纯。
2 方法与结果
2.1 MP 的提取与精制
称取50 g 毛尖茶叶,沸水提取30 min,冷却后3000 rpm 离心,取上清,50 ℃减压浓缩至小体积,冷却至室温后加入乙醇,至溶液中乙醇的体积分数为80%,置于4 ℃冰箱中过夜,次日弃上清,并将沉淀挥干乙醇后以水溶解后再次离心,上清液再次以80%乙醇沉淀,4 ℃冰箱中过夜后弃上清,如此反复处理多次,直至目测多糖溶液无色,将多糖溶液以Sevag 法除蛋白多次,直至其在280 nm 处无明显紫外吸收峰,除蛋白结束,浓缩水层得粗多糖溶液,冷冻干燥得毛尖茶叶粗多糖。
将毛尖茶叶粗多糖透析处理,并以无水乙醇、丙酮反复洗涤8 次后真空冷冻干燥,即得毛尖茶叶精制多糖(MP)。本实验室曾对该操作下的黑骨藤精制多糖进行了验证,可保证多糖溶液中基本不含其他游离型杂质[11]。
2.2 MP 的特性分析
2.2.1 旋光度测定
称取MP 10.0 mg,以水溶解,定容至25 mL,以水为空白,自动旋光仪测量旋光度,经计算,得=+62.5°。
2.2.2 分子量分布的测定
以HPLC 对系列多糖标准品和MP 进行测定,Shodex®KS-805 凝胶色谱柱,柱温30 ℃,纯水为流动相,流速0.5 mL/min,RID 检测。
分别称取适量的分子量为1×105、5×105、1×106、2×106、3×106Da 的Dextran 标准品,加入去离子水,将其配成浓度约0.5 mg/mL 的对照品溶液,0.22 μm 水系滤膜过滤,之后逐一进行HPLC 检测,以保留时间(RT)为横坐标x,分子量的log10值为纵坐标y,得标准曲线y=-0.1797x+9.0456(R=0.9456)。
称取一定量的MP,按上述方法进行检测,以MP 保留时间依上述标准曲线公式进行计算,得MP的分子量分布约为1.65×106~2.50×106Da。
2.2.3 单糖组成的测定
称取MP 10 mg,以3 mL 浓度为2.23 mol/L 的TFA 溶解后置于具塞试管中封管99 ℃水解5 h,按照文献[12]中多糖糖醇醋酸盐衍生物的方法对MP的单糖组成和摩尔比进行测定,气相条件为,色谱柱:DB-5(30 m×0.25 mm×0.25 μm);检测器:质谱检测器;进样口温度:250 ℃;检测器温度:280℃;氮气流速:0.6 mL/min;分流比:20∶1;进样量:1 μL;升温程序:200 ℃保持2 min,以3 ℃/min 的速率升至245 ℃,再以10 ℃/min 的速率升至270 ℃,保持2 min。测得MP 由阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,摩尔比为3.18∶0.78∶1.36∶4.29。
2.3 MP-HCW 和MP-HCM 的制备
称取MP 50 mg,以15 mL 浓度为2.23 mol/L 的TFA 溶解后置于具塞试管中封管99 ℃水解5 h。水解结束后水解液反复加水减压蒸至无酸味,以少量水溶解,C18柱层析进行分离,分别以水及甲醇洗脱5个柱体积,两部分分别减压蒸干,既得MP-HCW 和MP-HCM 部分。
2.4 MP、MP-HCM 和MP-HCW 的清除自由基活性测定
按照文献所述方法[13],对MP、MP-HCW 和MPHCM 进行清除自由基活性测定,以样品对DPPH 自由基的清除率作为评价指标。
2.4.1 溶液的配制
DPPH 溶液的配制:精密称取DPPH 8.01 mg,以60%乙醇溶解并定容至200 mL 棕色容量瓶中,得浓度为0.1 mmol/L 的DPPH 溶液,避光保存,备用。
2.4.2 测定方法及结果
取0.5 mg/mL MP 水溶液1.0 mL,置10 mL 比色管中,加入3.0 mL 的DPPH 溶液,水浴30 ℃避光反应30 min,以蒸馏水为空白,于517 nm 波长处测定吸光值。按下列公式计算DPPH 自由基清除率。
DPPH 自由基清除率(%)=[A0-(AS-AC)]/A0×100%
式中,A0—1.0 mL 蒸馏水+3.0 mLDPPH 溶液的吸光度值;AS—1.0 mL 样品溶液+3.0 mL DPPH溶液的吸光度值;AC—1.0 mL 样品溶液+3.0 mL无水乙醇的吸光度值。将实验重复6 次,求得MP、MP-HCM 和MP-HCW 的DPPH 自由基清除率分别为28.99%、13.1%、23.2%,其活性贡献关系如图1。MP-HCM 对MP 的DPPH 自由基清除率贡献为45.19%。
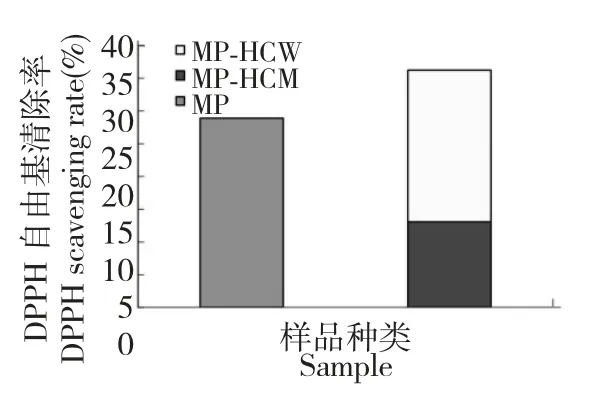
图1 MP、MP-HCM 和MP-HCW 的DPPH 自由基清除率贡献关系图Fig.1 Contribution of DPPH radical scavenging rates of MP,MP-HCM and MP-HCW
2.5 MP、MP-HCM 和MP-HCW 的总还原力活性测定
按照文献所述方法[14],对MP、MP-HCW 和MPHCM 进行总还原力活性测定,以还原力指数作为评价指标。
2.5.1 VC标准曲线的绘制
用蒸馏水配制浓度分别为0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.045 mg/mL 的VC溶液。以移液管吸取1 mL VC水溶液到具塞试管中,加入0.2 moL/L 的磷酸盐缓冲液(pH=6.6)2.5 mL 和1%的铁氰化钾溶液2.5 mL,混合溶液于50 ℃水浴保温20 min,反应结束后30 ℃水浴冷却5 min,加入2.5 mL10%(w/v)三氯乙酸溶液,3000 rpm 离心10 min,精密吸取上清液2.5 mL,加入2.5 mL 蒸馏水和0.5 mL 0.1%的三氯化铁溶液,混匀。同时以1 mL 蒸馏水代替VC溶液按照如上方法操作,作为空白对照,在700 nm 处测吸光度AVC。
将配制的梯度浓度的VC标准溶液均按照上述方法测定AVC,结果绘制VC的浓度-还原力标准曲线,得标准曲线方程为AVC=7.057CVC-0.015,R=0.997。
2.5.2 样品的测定
取0.5 mg/mL(CS)的MP 溶液,按照2.4.1 方法进行操作,重复六次,求得AS的平均值及RSD值。以VC标准曲线求得AS下VC的浓度CVC,以两浓度的比值作为还原力指数,以评价样品的还原力,公式如下:
还原力指数=CVC/CS
MP-HCM 和MP-HCW 以相当于0.5 mg/mL MP浓度的样品溶液,按照上述方法进行测定,分别以甲醇和水作为空白试剂,经测定,计算得MP、MP-HCM和MP-HCW 的还原力指数分别为0.044、0.015、0.029,其活性贡献关系如图2。MP-HCM 对MP 的总还原力贡献为34.09%。
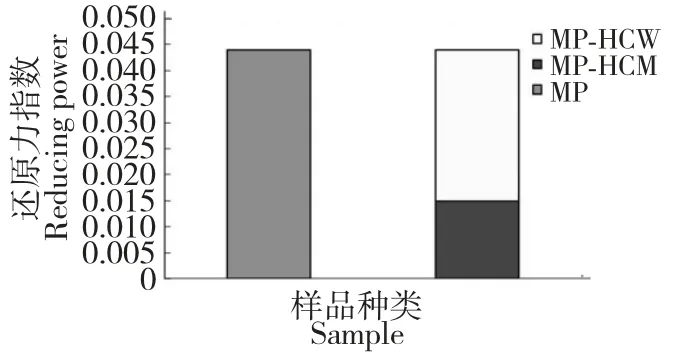
图2 MP、MP-HCM 和MP-HCW 的还原力活性贡献关系图Fig.2 Contribution of reducing power of MP,MP-HCM and MP-HCW
3 讨论
茶叶在我国资源丰富,饮用历史悠久,并被认为具有较好的保健功效。现代医学药学研究对茶叶成分及其活性有广泛研究,尤其对茶多糖的抗氧化、清除自由基等活性的研究多有报道,并有学者通过实验证实茶多糖及其他植物多糖的抗氧化活性与提高机体免疫力和抗肿瘤等活性的潜在关系,对正确认识茶多糖的药理作用、开发新型药物具有重要意义。
现代植物化学研究范畴认为,多糖是由多个单糖通过糖苷键连接形成的大分子物质,经提取、分离、纯化后在生化或体外药理等活性检验中表现出抗氧化、清除自由基、免疫、抗肿瘤等活性。作为多羟基大分子化合物,多糖可形成空间立体结构,并可制成微胶囊与活性药物分子结合成复合物,作为新的给药方式[15],可能与多糖的多羟基立体结构同药物分子结合成稳定复合物有关。特定多糖的空间结构可与小分子物质形成复合物,此时多糖表现出的活性包含了其结合物的活性。暨南大学郭凌[16]等将琼枝麒麟菜和异枝麒麟菜硫酸多糖部分进行了水解,探讨了多糖及其水解产物抑菌活性的差异,虽未确证抑菌活性变化的机理,依然提示多糖水解后活性的变化趋向。
本研究以毛尖茶叶多糖为研究对象,采用酸水解的方法使多糖中糖苷键断裂,多糖结合物被释放,收集水解后的单糖部分和多糖结合物部分,并对各个部分进行活性检测和比较,证实多糖结合物具有一定的抗氧化和清除自由基活性,并初步计算了其在多糖复合物活性中的贡献值,对科学认识多糖提供了新的思路和依据,对天然来源多糖的研究具有重要意义。
1 Lu M(卢敏).Advances in studies on pharmacological activities of tea polysaccharides.Drug Eval Res(药物评价研究),2009,1:67-69.
2 Quan JS(全吉淑),Yin XZ(尹学哲),Jin ZWD(金泽武道).Study of antioxidant activity of tea polysaccharides.J Chin Med Mater,2007,9:1116-1118.
3 Luo ZY(罗祖友),Yan FW(严奉伟),Xue ZH(薛照辉),et al.Study on antioxidant activity of polysaccharide from Ampelopsis grossedentata.Food Sci(食品科学),2004,11:291-295.
4 Luo ZY(罗祖友),Chen GH(陈根洪),Chen Y(陈业),etal.Study on antitumor and immunoregulation effect of polysaccharide from Ampelopsis grossedentata.Food Sci(食品科学),2007,08:457-461.
5 Lv HP(吕海鹏).Analyze of components and study on antioxidant activity of Pu-erh tea.Beijing:Chinese Academy of Agricultural Sciences(中国农业科学院),MSc.2005.
6 Mateos-Aparicio I,Mateos-Peinado C,Jiménez-Escrig A,et al.Multifunctional antioxidant activity of polysaccharide fractions from the soybean byproduct okara.Carbohydr Polymers,2010,2:245-250.
7 Su BX(苏冰霞),Zhang Y(张月),Ge HL(葛会林),et al.Influence on antioxidant activity of separation Mallotus Furetianus tea polysaccharides.Food Sci Technol(食品科技),2013,09:160-164.
8 Li XM,Li XL,Zhou AG.Evaluation of antioxidant activity of the polysaccharides extracted from Lycium barbarum fruits in vitro.Eu Polymer J,2007,2:488-497.
9 Chen HX,Zhang M,Xie BJ.Components and antioxidant activity of polysaccharide conjugate from green tea.Food Chem,2005,1-2:17-21.
10 Wang YF(王元凤),Jin ZY(金征宇),Wei XL(魏新林).Preparation and hydroxyl radical-scavenging effects of tea polysaccharides metal complex.Nat Prod Res Dev(天然产物研究与开发),2009,21:382-387.
11 Sun L(孙磊),Qiao SY(乔善义),Zhao YM(赵毅民).Studies on content determination of polysaccharides in Periploca forrestii.China J Chin Mater Med(中国中药杂志),2009,10:1241-1244.
12 Bai DS(白娣斯),Zhang J(张静).Study and comparison of two derivatization methods of polysaccharides by GC.Sci Technol Food Ind(食品工业科技),2011,02:322-324.
13 Wu YJ(吴玉娟),Wang YP(王懿萍),Jiang YW(姜延伟),et al.Study of determination and antioxidant activity on polysaccharide of the rhizome of Chinese gold thread.Lishizhen Med Mater Med Res(时针国医国药),2008,08:1906-1908.
14 Hou XJ(侯秀娟).Studies on the extraction,purification,antioxidant activities and biological activities of polysaccharides of Exocarpium Citri Grandisthis.Nanchang:Jiangxi Agricultural University(江西农业大学),MSc.2013.
15 Liu XD(刘袖洞),He Y(何洋),Liu Q(刘群),et al.Micro capsule and its application in biomedical field.Chin Sci Bull(科学通报),2000,23:2476-2485.
16 Guo L(郭凌),Bao HY(包惠燕),Ye SM(叶绍明),et al.Antibacterial activities of Eucheuma gelatinae,Eucheumas triatum and their hydrolysates.J Jinan Univ,Nat Sci(暨南大学学报,自科版),2002,23(3):79-83.
