黑斑-息肉综合征合并肠梗阻、肠套叠2例并文献复习
2015-01-11孟庆成卢一艳康春博曲军
孟庆成 卢一艳 康春博 曲军
1.航天中心医院普通外科,北京100049;2.航天中心医院病理科,北京100049
黑斑-息肉综合征合并肠梗阻、肠套叠2例并文献复习
孟庆成1卢一艳2康春博1曲军1
1.航天中心医院普通外科,北京100049;2.航天中心医院病理科,北京100049
为提高对黑斑-息肉综合征合并肠梗阻、肠套叠的认识,增强临床疑难疾病的诊断能力,对2例黑斑-息肉综合征合并肠梗阻、肠套叠患者的病史特点、临床症状、术后的病理资料进行分析,并复习文献加以讨论。2例患者均行手术治疗,术中证实为肠套叠,套叠的肠管分别为小肠和结肠。对于黑斑-息肉综合征合并肠梗阻、肠套叠的病例,一经诊断,宜及早手术治疗,术后给予定期随访。
黑斑-息肉综合征曰肠梗阻曰肠套叠
黑斑-息肉综合征(Peutz-Jeghers'syndrome,PJS),又称为色素沉着息肉综合征;是一种临床上罕见的常染色体显性遗传性疾病。以青少年多见,患者中30%~50%[1]甚至约60%的患者有明确的或者可疑家族史[2],越代现象和散发病例较多见,发病率约1/20万。近年来,国内文献报道逐渐增多,其特点是胃肠道的错构瘤样息肉以及皮肤、黏膜的黑色素沉着[3]。PJS在发病率上无性别及种族差异[3]。此病的主要特征是胃肠道的多发息肉,但皮肤及黏膜色素沉着常先于胃肠道息肉出现[4]。口唇、鼻、手足及生殖器的棕黄色或黑斑是其典型的皮肤表现。航天中心医院(以下简称“我院”)2012~2014年共收治黑斑-息肉综合征合并肠梗阻2例,现结合文献对其病史特点、临床症状、诊断、治疗及病理分析报道如下:
1 临床资料
病例1:女,16岁,因“间断性腹痛3个月伴有口唇黏膜色素沉着”于2012年3月入院。患者间断性脐周胀痛,大便1~2次/d,为成形便,便暗红色血2次,为便中带血。没有明确的家族史,患者为独生女,出生时左手指先天缺如,口唇及颊黏膜黑斑,之后出现右手掌和足趾、足掌点片状黑斑及淡褐色斑。患者祖父1年前肠镜检查发现直肠内1.0 cm×1.0 cm息肉2个,予以电切,病理活检示:管状腺瘤。患者其余二、三级亲属无此类似病史。查体:口唇、颊黏膜、手、足有多处黏膜色素沉着,以口唇为著,呈褐色或黑色斑,大小0.2~1.0 cm,脐周有轻度压痛,全腹未触及明显包块,肠鸣音正常。直肠指诊可触及直肠息肉,大小0.2~0.3 cm。脊柱侧弯。上消化道钡餐造影及胃、肠镜检查示:胃、十二指肠多发息肉,十二指肠乳头旁见一大小2.0 cm×1.5 cm的有蒂息肉,乳头开口正常;空肠多发息肉;结肠多发息肉;结肠肝曲的息肉较大为0.8 cm×0.6 cm。降结肠处息肉约3.5 cm×2.0 cm,已基本堵塞肠腔。活检示:降结肠黏膜慢性炎,个别腺体呈腺瘤性Ⅰ级增生(图1)。入院诊断:PJS。血常规、心电图及及胸片正常。行腹腔镜左半结肠切除术。术中见小肠及结肠肠腔内布满息肉,大小为0.2 cm×0.2 cm~1.0 cm× 1.0 cm;降结肠近脾曲处可见一较大肿物,最大直径约3.5 cm×3.0 cm,呈菜花样,肠管表面一周呈隆起,与周围组织有粘连,未见肿物穿透浆肌层。术后病理示:(降结肠)多发Peutz-Jeghers息肉(图2)。术后6个月来我院在肠镜下行结肠肝曲之息肉高频电切术。8个月复查胃镜示:胃及十二指肠多发息肉,给予内镜下胃息肉切除。活检示:胃(窦)幽门型黏膜慢性炎;胃(体)浅表黏膜慢性炎;胃(底)增生性息肉。术后10个月患者因“下消化道出血,急性不完全性肠梗阻”而入院。入院后2 d出现腹痛、腹胀等症状。查体:见左下腹部有包块隆起,压痛及反跳痛阳性,腹肌略紧张;腹部平片示:肠梗阻;腹部CT示:典型靶心征,考虑空肠套叠、肝囊肿。血常规:红细胞计数:2.73×1012/L,血红蛋白:79 g/L,血细胞比容:0.236、输注浓缩红细胞悬液2 U以纠正贫血,在全麻下行剖腹探查术、小肠切除术、小肠端-端吻合术。术中见部分小肠内有暗红色血液淤积,空肠部分可见长15~20 cm肠套叠。套叠部分肠管内可触及较多密集息肉,较大一枚息肉呈椭圆形,大小约为2.5 cm×1.5 cm,腹腔内未见明显渗出液。术后病理示:空肠多发Peutz-Jeghers息肉。术后随访2年未见肠梗阻、肠套叠、已切除息肉复发及可疑癌变,但仍偶有轻度腹胀,大便每日1次,为黄色成形软便,无脓血便。
病例2:女,29岁,因“间断性腹痛伴腹胀2个月,加重10 d”于2013年9月入院。病程中曾出现2次黑褐色大便,便中带血,体重较前减轻2 kg。既往5年前因为口唇黑斑在当地医院行激光治疗后,无再发,患者母亲在出生2岁时即发现口唇黑斑,但未行肠镜检查,亦未行治疗。患者其余二、三级亲属以及1弟1妹均无此类似病史。查体:口唇黏膜有少许色素沉着,呈浅褐色,上腹部可见肠型,呈条索状肿物,约10.0 cm× 6.0 cm,质地软,表面光滑,无压痛,活动度较差。腹部无明显压痛及反跳痛,肝脾肋下未触及,肠鸣音可闻及,2~3次/min。给予留置胃管、胃肠减压治疗,灌肠后排便4次,解出淡红色不成形便;血常规:白细胞计数:9.68×109/L,血红蛋白:108 g/L;肝功示:总胆红素:22.2μmol/L,间接胆红素:17.1μmol/L。腹腔彩超示:胆囊息肉、盆腔积液;左上腹不均质回声包块,考虑肠套叠可能。予以钡灌肠欲促使套叠之肠管复位,灌肠后排出淡红色血便伴陈旧性血块。腹部CT示:肠套叠,右侧结肠旁沟渗出及积液较多。肠镜示:结肠多发息肉,进镜到横结肠近肝曲,见有紫红色肠黏膜套叠进入肠腔,充气可移动但不能复位;诊断为肠套叠伴发不完全性肠梗阻,不除外结肠肿瘤。保守治疗3 d后患者症状未见减轻,行腹腔镜探查术,术中见腹腔内多发回肠套叠,中转开腹,见回肠多发息肉,共套叠4处,最大息肉约4.0 cm×2.5 cm,结肠近脾曲处有多发息肉;结肠未见套叠。将套叠的肠管复位,将多发息肉之长约15 cm的回肠切除并行端-端吻合,将其余小肠息肉对应处的肠壁纵形切开,切除相应息肉后将肠管横行缝合,共切除小肠息肉4枚。术中行肠镜检查,将结肠内息肉(>0.5 cm)在肠镜下高频电凝切除。将端-端吻合处之回肠提出腹壁,在右下腹行临时性回肠造瘘术。术后病理示:Peutz-Jeghers息肉(图3)。术后按时拆线及出院,术后3个月行小肠镜检查,切除2个大小约0.4 cm×0.3 cm、0.6 cm×0.5 cm息肉,未见其余异常病变。嘱患者每年行肠镜复查,拟术后2年行造瘘还纳术。现随访1年未见肠梗阻、肠套叠、已切除息肉复发,亦未见残余息肉明显增大。

图1 病例1降结肠活检病变(HE,100×)
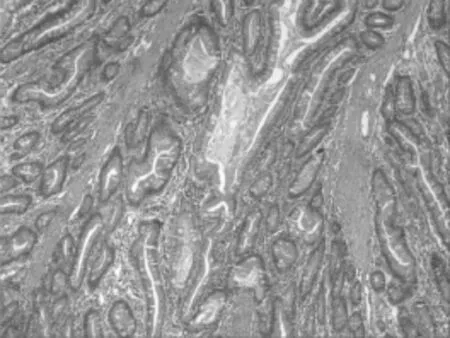
图2 病例1降结肠切除病变镜下改变(HE,100×)
2 讨论
PJS是错构瘤性病变,是胃肠道的一种特殊的息肉病,可累及食管至直肠的整个消化道。息肉分布的广泛性与黑斑发生部位较一致。PJS一般具备三个临床基本特征:第一,特定部位的皮肤、黏膜黑色素斑;第二,胃肠道多发息肉;第三,具有遗传性[5]。一般先有皮肤黏膜色素沉着,然后才发生息肉,息肉可存在于2个以上的不同部位,亦可累及全消化道,呈多发性,以小肠最多见,其次为结肠和胃;息肉数量可以从2枚至上百枚,0.2~5.0 cm大小,多数有蒂,质地柔软、表面光滑有分叶、易出血。色素沉着形态上与雀斑相似,被认为是PJS区别于其他错构瘤息肉病的主要鉴别点和体外标志。约50%患者在20岁前出现肠梗阻及肠套叠[6]。PJS虽不属于癌前病变,但为恶性肿瘤高发人群[7],具有较高的癌症易感性。Giardiello等[8]调查认为,PJS患者发生肿瘤的危险性是正常人群的18倍。息肉恶变率与息肉的大小有关,直径超过3 cm的息肉恶变率约15%[9]。
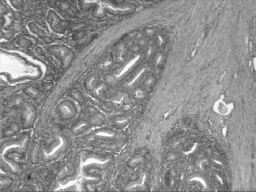
图3 病例2小肠病变镜下改变(HE,100×)
PJS的诊断主要依据患者的色素斑结合胃镜、肠镜等检查存在消化道息肉,并经组织学检查证实为错构瘤。并非所有的患者均有明确的家族史,故有学者将PJS分为不完全性PJS和完全性PJS[10],具有色素斑、胃肠道息肉及遗传性三者称为完全性PJS,而仅有一项者称为不完全性PJS。病例1患者祖父所患直肠息肉与PJS无关,即没有明确的家族史,诊断为不完全性PJS;病例2有家族史,PJS的3个临床基本特征齐全,诊断为完全性PJS。确认PJS与19号染色体短臂(19P13.3)区域的LKB1(SKT11)基因突变有关[11-12]。LKB1基因的发现,将有利于临床医生更好地对其进行治疗及随访。
PJS需要与家族性肠息肉病(familial intestinal polyposis,FIP)、肠息肉病合并多发性骨瘤和多发性软组织瘤(Gardner综合征)相鉴别。FIP特点是婴幼儿期并无息肉,常开始出现于青年时期,癌变的倾向性很大,预后差。直肠及结肠常布满腺瘤,极少累及小肠。而PJS则多在儿童或者青少年时期发病,临床特点是口唇、口腔颊部黏膜及四肢末端有色素沉着,呈黑斑或者棕黄色斑,并在胃肠道出现多发息肉。息肉可出现在全部消化道,但大部分位于小肠,属于错构瘤一类,可以继发腺瘤,最终进展为腺癌,但癌变率较低。Gardner综合征也和遗传因素有关,也是一种罕见的常染色体显性遗传疾病,临床特点是除结直、肠息肉外还并发以下情况:骨病或骨疣;上皮样囊肿;软组织纤维瘤;硬纤维瘤;术后的肠系膜纤维瘤。其病理是腺瘤性息肉。此病多在30~40岁出现,癌变倾向明显[13]。
由于检查手段的不断进步,胃镜、肠镜、全消化道造影、胶囊内镜等检查方法的不断普及,医生对PJS的认识不断加深。由于息肉多发生于消化道(包括食管、胃、小肠、结直肠等),手术并不能切除全部的息肉,此病的治疗主要是针对胃肠道息肉及其并发症,如肠梗阻、肠套叠、肠息肉或者肠道出血以及可疑癌变时。手术治疗目的主要是针对胃肠道息肉及其引起的并发症,以缓解症状为主,术前需要内镜检查,并取活检,明确息肉性质及切除较大的息肉。由于息肉较多,一般并不切除肠管,只是切除肠管的病变部分,但是患者如出现肠套叠、肠梗阻或者怀疑癌变,则需要手术切除部分肠管。病例1患者胃、空肠、结肠均有多发息肉,诊断为PJS,该患者降结肠处肿瘤较大,已基本堵塞肠腔,有不完全性肠梗阻症状,且病理活检回报示:部分腺体腺瘤性Ⅰ级增生。患者1肿瘤(降结肠腺瘤)较大,间断性脐周胀痛可能是此腺瘤引起的不完全性肠梗阻症状,为防止结肠穿孔及癌变,手术切除降结肠肿瘤以解决患者肠梗阻及可能出现的癌变。由于PJS息肉易复发或出现并发症,可能需要多次手术治疗,容易导致短肠综合征。所以,术中应尽量切除息肉解决其引起的并发症后尽可能多地保留肠管,切除肠管的范围宜小。而针对结肠其他位置的较小息肉留待以后肠镜电切完成,患者结肠肝曲的较大息肉在其第2次入院后行肠镜下电切。患者十二指肠乳头旁的有蒂息肉在第3次入院后行胃镜切除,防止息肉长大而堵塞十二指肠乳头。术后第4次入院出现了不完全性肠梗阻及便血的表现,考虑为空肠内多发巨大息肉反复刺激导致肠管痉挛及肠管异常蠕动所致空肠套叠、肠梗阻。该患者CT检查结果典型靶心征,支持了患者肠梗阻及肠套叠之诊断,因手术指征明确而采取手术治疗,效果良好。
术前没有明确诊断为PJS的患者(例2),术前要和消化道肿瘤、肠结核及肠易激综合征等鉴别。需查结核菌素试验、结核抗体化验及电子结肠镜等检查以资鉴别。肠易激综合征属于肠道功能紊乱性疾病,该患者(例2)可排除该诊断,诊断为结肠息肉所致肠套叠及肠梗阻,试行钡灌肠促使肠套叠复位等保守治疗后症状未见缓解,行肠镜示可见肠管内紫红色肠黏膜,腹部CT提示肠套叠较严重,套叠情况较复杂,手术指征明确,果断地行腹腔镜探查,先经脐单孔腹腔镜探查腹腔内情况,再依据术中具体情况决定进一步手术方式,因为患者小肠套叠严重,镜下操作困难,给予中转开腹。患者肠管水肿严重,为避免肠瘘发生,行回肠造瘘术,留待以后二期肠造瘘还纳术。手术结果证实了术前的判断;手术切除病变肠管,明确诊断为PJS。由此可以看出,患者术前的预判、讨论及围术期处理是非常关键的。
PJS息肉可以累及胃至直肠的任何部位,偶有累及食管者(例1),目前尚无有效的根治方法,治疗主要分为内镜治疗和手术治疗两种,以缓解症状为目的。根据患者息肉大小、部位、性质等采取不同的治疗方案,首选胃镜、肠镜下息肉高频电凝切除,本组2例患者均于术后行内镜下息肉切除术;内镜下息肉切除术创伤小,术后恢复快,并发症少,随着胃镜、结肠镜的普及,消化内镜可达到结直肠、胃、十二指肠降部,基本能实现对该段消化道的无症状息肉实行镜下切除。无论息肉大小,在内镜可及范围内首选内镜切除。根据情况选用高频电灼烧切除或者套圈器套扎切除,患者病灶较多的情况下,需进行分次切除术(例1)。对于小肠息肉可采用消化道钡餐造影检查、胶囊内镜或者双气囊电子小肠镜检查。由于PJS息肉很少癌变,故只有肠梗阻、肠套叠或者肠道大量出血及可疑癌变者才考虑行外科手术治疗[14]。如果发现息肉>1.5 cm,行内镜下高频电凝切除息肉以防止其恶变;息肉较大(直径>3.0 cm),不能内镜下切除,由于其癌变风险加大,且易出现肠梗阻、肠套叠等并发症,应及时手术治疗,恢复肠腔通畅,防止癌变的发生。手术力求简单,应选择腹腔镜手术,减少腹腔内粘连,为术后随访及息肉复发的治疗创造有利条件,恶变者则需行相应的根治术治疗,并给予引流区域的淋巴结清扫。
PJS尽管是一个良性疾病,但其恶性肿瘤的发病率仍远高于正常人群,PJS合并恶性肿瘤发生率约为14.8%[15]及17.9%[16],且PJS的息肉较易复发,故需要长期随访及复查,息肉切除术或摘除术后每2年至少行1次内镜检查。对于无症状PJS者或者可疑PJS(例2母亲),可观察随访。在家族性发病者的随访和筛查中不应忽视无黑斑者(即不完全性PJS)和无家族史的可疑PJS,皆应做到对患者及其家族成员终身随访,而且不应仅仅满足于胃镜、结肠镜、胶囊内镜或者胃肠钡餐的筛检,还应详细询问患者家族史、密切观察是否合并其他系统的恶性肿瘤,定期做全面系统的体检和全身肿瘤筛查,以期做到早发现、早治疗,及时清除新生的或者复发的较大息肉。对可疑的患者进行病理检查,病理提示为腺瘤性息肉者应尤为重视,以便及时发现息肉癌变,控制或减少癌变。对于防止肠梗阻、肠套叠等并发症,提高患者生存质量及预后有重要的意义。
[1]Aretz S,Stie nen D,Uhlhaas S.High proportion of large genomic STK11 dsletions in Peutz-Jeghers syndrome[J]. Hum Mutat,2005,26(6):513-519.
[2]杨斌,赵博,王振军.黑斑息肉病的临床特点和治疗策略[J].大肠肛门病外科杂志,2004,10(4):271-273.
[3]McGarrity TJ,Kulin HE,Zaino RJ.Peutz-Jeghers syndrome[J].Am J Gastroenterol,2000,95(3):596-604.
[4]Tomlinson IPM,Houlston RS.Peutz-Jeghers syndrome[J]. J Med Genet,1997,34(12):1007-1011.
[5]王吉甫.胃肠外科学[M].北京:人民卫生出版社,2002:660-665.
[6]Giardiello FM,Trimbath JD.Peutz-Jeghers syndrome and management recommendations[J].Clin Gastroenterol Hepatol,2006,4(4):408-415.
[7]Papageorgiou T,Stratakis CA.Ovarian tumors associated with multiple endocrine neoplasias and related syndromes(Carney complex,Peutz-Jeghers syndrome,von Hippel-Lindau disease,Cowden's disease)[J].Int J Gynecol Cancer,2002,12(4):337.
[8]Giardiello FM,Welsh SB,Hamilton SR,et al.Increased risk of cancer in the Peutz-Jeghers syndrome[J].N Engl J Med,1987,316(24):1511-1514.
[9]Boardman LA.Heritable colorectal cancer syndromes:recognition and preventive management[J].Gastroenterol Clin North Am,2002,31(4):1107-1131.
[10]Giardiello FM,BrensingerJD,Tersmette AC,etal.Very high risk of cancer in familial Peutz-Jeghers syndrome[J]. Gastroenterology,2000,119(6):1447-1453.
[11]Hemminki A,Markie D,Tomlinson L,et al.A serine/ threonine kinase gene defective in Peutz-Jeghers syndrome[J].Nature,1998,391(6663):184-187.
[12]Jenne DE,Reimann H,Nezu J,et al.Peutz-Jeghers syndrome is caused by mutations in a novel serine threonine kinase[J].Nature Genetics,1998:18(1):38-43.
[13]吴阶平,裘法祖.黄家骊外科学[M].5版.北京:人民卫生出版社,1992:1215-1216.
[14]赵鹏,柳建中,董新舒,等.黑斑息肉综合症的治疗附一家族病例分析[J].中国肿瘤临床,2006,33(4):221-222.
[15]袁岸龙,寇继光,夏冰.黑斑息肉综合征患者临床特点调查分析[J].中华消化杂志,2011,31(6):417-419.
[16]宋京翔,卿三华,黄祥成.黑斑息肉病及其合并恶变的临床分析[J].中华胃肠外科杂志,2003,6(1):27-28.
Peutz-Jeghers syndrome complicated with intestinal obstruction and in鄄tussusception in 2 cases and review of literature
MENG Qingcheng1LU Yiyan2KANG Chunbo1QU Jun1
1.Department of General Surgery,Aerospace Center Hospital,Beijing 100049,China;2.Department of Pathology, Aerospace Center Hospital,Beijing 100049,China
In order to increase the awareness of Peutz-Jeghers syndrome complicated with intestinal obstruction and intussusception and enhance the ability of clinical diagnosis of diseases.this article analyzes the medical history,clinical symptoms,surgery pathology data of 2 patients with Peutz-Jeghers syndrome combined with intestinal obstruction and intussusception and review of the literature.2 cases of patients all give surgical treatment,surgery prove to be prone to intussusception,invagination of bowel is small intestine and colon respectively.Once the cases of Peutz-Jeghers syndrome complicated with intestinal obstruction and intussusception give is diagnosed,early appropriate surgical treatment should be adopted and regular follow-up after surgery.
Peutz-Jeghers syndrome;Intestinal obstruction;Intestinal intussusception
R574.3
A
1673-7210(2015)07(b)-0145-05
2015-03-14本文编辑:程铭)
孟庆成(1971-),男,吉林人,博士研究生,副主任医师,航天中心医院外科教研室副主任,副教授;研究方向:胃肠、肛肠疾病。
康春博(1971-),男,辽宁人,硕士研究生,副主任医师,副教授;研究方向:胃肠外科。
