过氧化物酶体增殖体激活受体γ激动剂对炎症状态下人肾小球系膜细胞ABCA1表达的影响
2015-01-11刘华
刘华
首都医科大学宣武医院肾内科,北京100053
过氧化物酶体增殖体激活受体γ激动剂对炎症状态下人肾小球系膜细胞ABCA1表达的影响
刘华
首都医科大学宣武医院肾内科,北京100053
目的研究过氧化物酶体增殖体激活受体γ(PPAR-γ)激动剂15-脱氧前列腺素J2(15d-PGJ2)对炎症状态下人肾小球系膜细胞(HMC)ATP结合盒转运体A1(ABCA1)表达的影响,探讨影响受体表达和延缓肾小球疾病进展的可能干预措施。方法培养的HMC随机分为5组继续培养24 h:空白组:普通培养的细胞;对照组:5 ng/mL白细胞介素-1β(IL-1β);实验组:5 ng/mL IL-1β+2.5μmol/L 15d-PGJ2,5 ng/mL IL-1β+5μmol/L 15d-PGJ2,5 ng/mL IL-1β+10μmol/L 15d-PGJ2,应用实时定量PCR法测定不同剂量PPAR-γ激动剂15d-PGJ2对IL-1β作用下HMC ABCA1 mRNA的影响。培养的HMC随机分为4组继续培养24 h:空白组:普通培养的细胞;对照组:5 ng/mL IL-1β;实验组:5 ng/mL IL-1β+5μmol/L 15d-PGJ2,5 ng/mL IL-1β+10μmol/L 15d-PGJ2,应用Western印迹方法测定不同剂量15d-PGJ2对IL-1β诱导的ABCA1蛋白表达的影响。结果炎症因子IL-1β能够抑制HMC的ABCA1表达,15d-PGJ2呈剂量依赖性地增加IL-1β抑制的ABCA1 mRNA和蛋白表达。与对照组(5 ng/mL IL-1β)比较,2.5、5、10μmol/L 15d-PGJ2实验组ABCA1 mRNA表达分别升高1.34、2.15、2.88倍,5、10μmol/L 15d-PGJ2实验组ABCA1蛋白表达分别升高1.16、1.54倍。结论PPAR-γ激动剂15d-PGJ2剂量依赖性改善IL-1β对ABCA1 mRNA和蛋白表达的抑制,对炎症导致的系膜细胞脂质失衡具有保护作用。
过氧化物酶体增殖体激活受体γ激动剂;系膜细胞;白细胞介素1β;ATP结合盒转运体A1
越来越多的证据表明,肾小球硬化与动脉粥样硬化有相似的病理改变和病理生理机制,脂质负荷细胞的表达是肾小球硬化和动脉粥样硬化的特征性的改变。动脉粥样硬化的实质是血管壁的慢性炎症,因此炎症因子与脂质共同作用是导致肾小球硬化发生发展的主要致病因素,研究炎症如何在细胞水平影响胆固醇稳态是明确其介导肾脏损害的关键。细胞内脂质稳态涉及脂质的摄取和排出两方面的平衡,ATP结合盒转运体A1(ABCA1)是ATP结合盒转运体(ABC)超家族的成员之一,在胆固醇逆转运(RCT)和高密度脂蛋白胆固醇(HDL-C)生成的起始步骤中起重要作用,具有抗早期动脉粥样硬化的功能[1]。过氧化物酶体增殖体激活受体γ(PPAR-γ)是核激素受体超家族成员之一,在多种转录调控的细胞行为中都发挥重要作用,但是否影响炎症状态下系膜细胞内胆固醇稳态的相关研究较少。本实验旨在揭示PPAR-γ激动剂在炎症因子白细胞介素-1β(IL-1β)存在情况下对ABCA1表达的影响,探讨影响受体表达和延缓肾小球疾病进展可能的干预措施。
1 材料与方法
1.1 材料
转染T-SV40和H-ras癌基因的人肾小球系膜细胞株(HMCL)由英国Royal Free Hospital肾脏病中心RUAN Xiongzhong教授惠赠。RPMI-1640培养液及胎牛血清(FBS)(Gibco,U.S.A)。IL-1β(R&D,England),Ox-LDL(中国医学科学院基础所),ABCA1抗体(Novus,U.S.A)溶于0.5 mL磷酸盐缓冲液(PBS),分装-70℃保存。PCR反应体系、逆转录酶(MMLV)缓冲液(Promege,U.S.A),dNTP、Oligo(dT)、引物均由上海生工生物工程公司合成,ABCA1引物序列:上游5'-ATTCGCTCTGAGATGAGCACCA-3';下游5'-TTTCAAGCGGGCAT AGAACCA-3'。GAPDH引物序列:上游5'-GCACCGTCAAGGCTGAGAAC-3'下游5'-ATGGTGGTGAAGACGCCAGT-3'。15d-PGJ2:15-deoxy-Δ12,14-Prostaglandin J2(Calbiochem,U.S.A),化学分子式C20H28O3,溶于二甲基亚砜(DMSO),贮液浓度为10 mmol/L分装,-20℃冻存备用。工作液DMSO终浓度为0.1%(V/V)。
1.2 HMC细胞的培养和鉴定
用10%FCS的RPMI1640细胞培养液在37℃,5%CO2培养箱中孵育培养HMCL细胞,以0.01 mol/L PBS冲洗细胞,0.25%胰蛋白酶/0.025%乙二胺四乙酸(EDTA)消化,10%FCS的RPMI1640培养液悬浮细胞传代培养。间接免疫荧光法检测:胞浆Actin、CollagenⅣ、Fibronnectin及Vimentin染色阳性,Cytokeratin、Ⅷ因子染色阴性。
1.3 15d-PGJ2的细胞毒性试验细胞形态学观察
①细胞形态学观察。静止细胞后分别换用含终浓度为0、2.5、5、10、15、20μmol/L 15d-PGJ2的0.2% FCS RPMI1640培养基培养24 h,40倍相差显微镜下观察HMC细胞形态的改变。②锥虫蓝排斥试验。分组方法同上,培养24 h收集各组细胞,PBS轻洗,胰酶消化后离心,细胞沉淀用NS制成悬液,锥虫蓝染色,随机计数5个视野所有细胞。死亡细胞百分数以核蓝染的细胞数占总细胞数的百分比表示。③LDH释放试验。分组同上,培养24 h收集各组细胞。不含药物的6孔细胞设为低水平对照组,高水平对照组于实验前加入200μL 1%Triton破坏细胞。各孔取100μL上清加入100μL反应混合物,室温避光30 min,不含细胞的培养液校零,酶标仪490 nm波长检测。细胞毒性指数=(实验组OD值-低水平对照组OD值)/(高水平对照组OD值-低水平对照组OD值)×100%,即为细胞死亡百分数。
1.4 实时PCR检测ABCA1 mRNA表达
15d-PGJ2对IL-1β诱导的ABCA1 mRNA表达的影响:培养细胞静止后,40μg/mL Ox-LDL预先孵育24 h,随机分为5组,每组3皿,空白组:普通培养的细胞、对照组:5 ng/mL IL-1β及3个实验组:5 ng/mL IL-1β+2.5μmol/L 15d-PGJ2,5 ng/mL IL-1β+5μmol/L 15d-PGJ2,5 ng/mL IL-1β+10μmol/L 15d-PGJ2。37℃培养24 h收获细胞,提取总RNA,合成cDNA,25μL反应体系PCR扩增:DEPC水15μL,引物(P1+P2)1μL,RT产物2μL,SYBER GreenⅠ染料12.5μL,95℃10 s,95℃15 s,60℃30 s,共扩增40~50个循环。
1.5 Western印迹检测ABCA1蛋白表达
15d-PGJ2对IL-1β诱导的ABCA1蛋白表达的影响:培养细胞静止后,40μg/mL Ox-LDL预先孵育24 h,随机分为4组,每组3皿,空白组:普通培养的细胞,对照组:5 ng/mL IL-1β,实验组:5 ng/mL IL-1β+ 5μmol/L 15d-PGJ2,5 ng/mL IL-1β+10μmol/L 15d-PGJ2,37℃培养24 h收获细胞,提取总蛋白。上样蛋白质250μg,电泳、转膜5 h,封闭缓冲液过夜,1∶600一抗与膜孵育,室温缓慢振荡2 h,1∶6000二抗室温缓慢振荡1 h,洗膜,ECL显影。
1.6 统计学方法
采用SPSS 11.0统计学软件进行数据分析,计量资料数据用均数±标准差表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 15d-PGJ2的细胞毒性试验
本实验选用15d-PGJ2工作浓度为0~10μmol/L,在此范围内细胞死亡率<5%,对细胞无明显毒性作用。见表1。
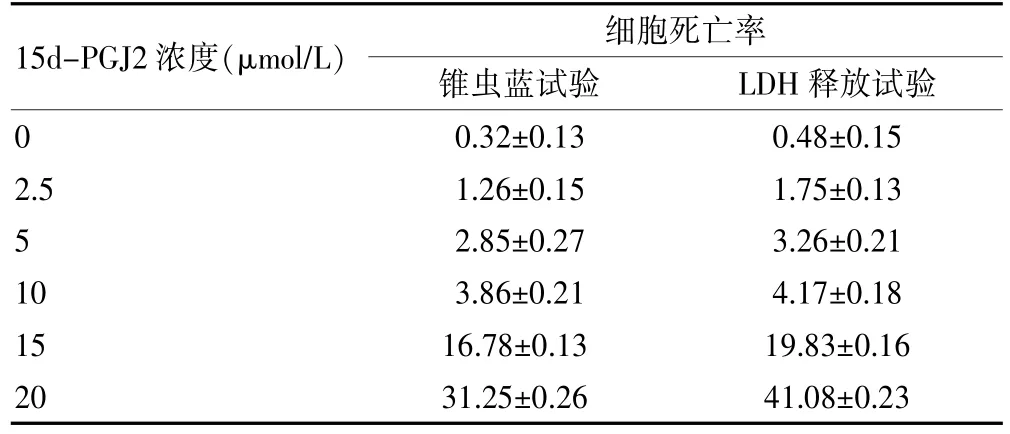
表1 不同15d-PGJ2浓度组的细胞毒性试验细胞死亡率(%,n=6)
2.1.1 细胞形态学观察相差显微镜观察结果显示,2.5~10μmol/L浓度组各组与对照组比较,细胞形态无明显改变。15μmol/L组细胞形态不规则,少量细胞漂浮、死亡,20μmol/L组可见大量细胞死亡。
2.1.2 锥虫蓝排斥试验细胞的死亡率随着药物作用浓度的增加而升高,2.5~10μmol/L浓度各组细胞死亡率分别为1.26%、2.85%、3.86%,15~20μmol/L浓度组细胞死亡率分别为16.78%、31.25%。见图1。
2.1.3 LDH释放试验药物的细胞毒性呈剂量依赖性,2.5~10μmol/L浓度各组细胞死亡率分别为1.75%、3.26%、4.17%,15~20μmol/L 15d-PGJ2导致的细胞死亡率分别达19.83%、41.08%。见图1。
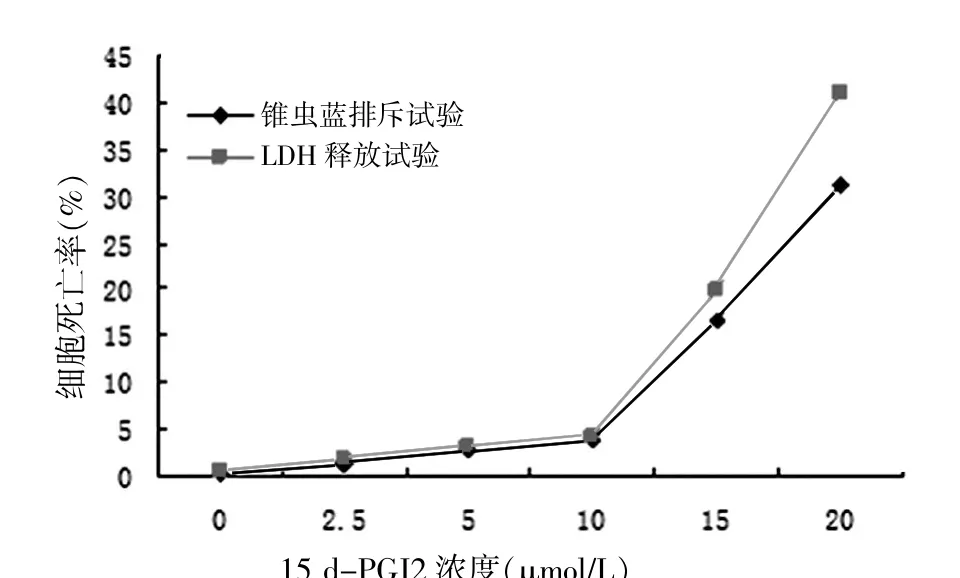
图1 15 d-PGJ2的细胞毒性试验
2.2 15d-PGJ2对IL-1β诱导的ABCA1表达的影响
2.2.1 15d-PGJ2对IL-1β诱导的ABCA1 mRNA表达的影响5 ng/mL IL-1β作用于细胞24 h与普通培养的空白组比较,能够降低ABCA1 mRNA表达为0.195倍(P<0.01),15d-PGJ2呈剂量依赖性的增加IL-1β抑制的ABCA1 mRNA表达。与单纯5 ng/mL IL-1β对照组比较,2.5μmol/L 15d-PGJ2浓度研究组细胞ABCA1 mRNA表达升高1.34倍(P<0.05),5、 10μmol/L浓度研究组细胞ABCA1 mRNA分别升高2.15、2.88倍(P<0.01)。见图2。
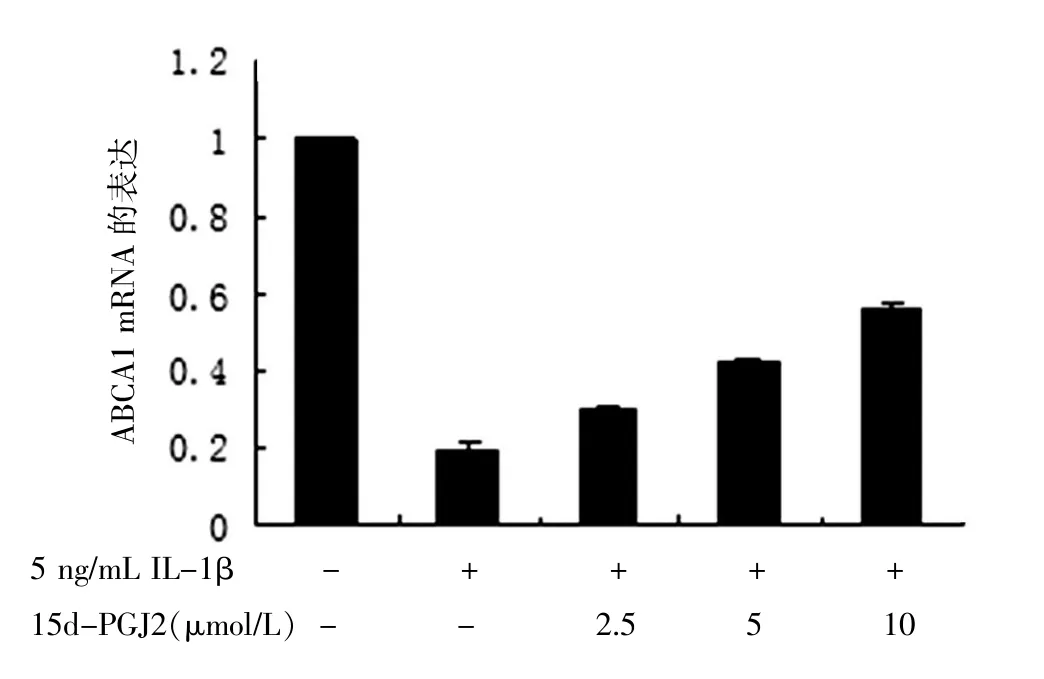
图2 12 d-PGJ2对IL-1β诱导的ABCA1mRNA表达的影响
2.2.2 15d-PGJ2对IL-1β诱导的ABCA1蛋白表达的影响5 ng/mL IL-1β作用于细胞24 h与普通培养的空白组比较,能够降低ABCA1蛋白表达为0.583倍(P<0.01),15d-PGJ2呈剂量依赖性地增加IL-1β抑制的ABCA1蛋白的表达。与单纯5 ng/mL IL-1β对照组比较,5μmol/L 15d-PGJ2浓度研究组细胞ABCA1蛋白表达升高为1.16倍(P<0.05),10μmol/L 15d-PGJ2浓度研究组细胞ABCA1蛋白表达升高为1.54倍(P<0.01)。见图3。
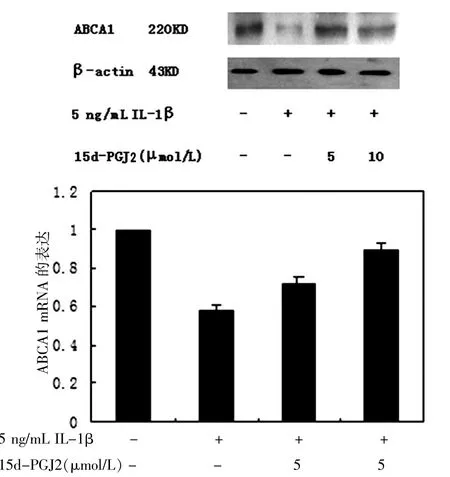
图3 15d-PGJCF LI-1β诱导的ABCA1蛋白表达的影响
3 讨论
高脂血症与肾脏疾病进展密切相关,它不仅是许多肾脏疾病常见的临床表现,脂代谢异常本身也参与了肾脏病的进展。越来越多的证据表明肾小球硬化与动脉粥样硬化有相似的病理改变和病理生理机制,血管动脉粥样硬化实质是一个慢性炎症的过程,而炎性反应又是造成肾脏组织损伤的主要机制,因此炎症因子与脂质参与动脉粥样硬化和肾小球硬化的形成,炎症加重脂质失调导致的肾损害是肾小球硬化和肾病进展的重要因素,研究炎症如何在细胞水平影响胆固醇稳态是明确脂质介导的动脉粥样硬化和肾脏损害的关键。
细胞内脂质稳态涉及脂质的摄取、合成、外流代谢多方面的平衡,很多因素影响动脉粥样硬化部位细胞对脂质的摄取和降解,受体表达变化是可能的调控机制。ABCA1在胆固醇逆转运和高密度脂蛋白胆固醇生成的起始步骤中起重要作用。研究发现,人类动脉粥样硬化区的ABCA1基因表达明显上调,且病例组巨噬细胞来源的泡沫细胞中ABCA1表达是对照组的2倍,表明ABCA1可使巨噬细胞清除过多的胆固醇,增加循环HDL-C水平,发挥抗动脉粥样硬化的作用[2]。肾小球硬化的特征是巨噬细胞和系膜细胞转化来的泡沫细胞的存在,炎症因子可以降低人肾小球系膜细胞ABCA1表达,抑制ABCA1途径介导的脂质排出[3],从而大大超过其清除能力而使之最终变成泡沫细胞。本研究发现IL-1β降低系膜细胞ABCA1蛋白和ABCA1 mRNA表达,因此炎症因子可以通过抑制ABCA1的表达降低脂质的排出,从而导致细胞内胆固醇的失衡使其变成泡沫细胞,加重肾小球硬化和肾病的进展。
由于ABCA1在胆固醇逆向转运中发挥重要作用,因此调控其基因的表达对于胆固醇的动态平衡尤为关键。ABCA1基因的转录调节受多种因素影响,其中以核激素受体超家族的转录调节最为重要。PPAR-γ是一类由配体激活的核转录因子,属于Ⅱ型核受体超家族成员,是糖代谢和脂肪生成的主要调节者,在改善血脂、减轻炎性反应、提高胰岛素敏感性等多种病理过程中发挥重要作用,PPAR-γ活性失调与多种疾病如肥胖、糖脂代谢、炎性反应、血管疾病有关[4]。PPAR-γ激动剂对肥胖人群具有抗动脉粥样硬化作用[5],在2型糖尿病和肥胖小鼠模型中,PPAR-γ部分激动剂替米沙坦,改善糖尿病血管病变[6]。研究表明,PPAR-γ超表达可以增强巨噬细胞胆固醇流出,从而减弱ApoE缺陷的大鼠的动脉粥样硬化[7]。
大量研究表明,PPAR-γ可通过调控ABCA1的表达,发挥抗动脉粥样硬化的保护作用。在动脉粥样硬化的发生发展中,PPAR-γ通过核受体超家族成员肝X受体d(LXRα)上调ABCA1的表达,介导胆固醇外流和脂质转运的基因的表达,促进胆固醇流出及血浆转运,降低细胞内胆固醇含量,对细胞内胆固醇的调节发挥着至关重要的作用,因此PPAR-γ-LXRα-ABC通路在巨噬细胞胆固醇流出机制中具有重要作用[8]。Ozasa等[9]通过给予2型糖尿病患者服用PPAR-γ激动剂吡格列酮,并在离体条件下血清培养人巨噬细胞加入PPAR-γ激动剂吡格列酮,在体内研究和离体实验发现ABCA1的表达增多,最后巨噬细胞通过ABCA1蛋白将胞内多余的胆固醇转移至胞外。而抑制PPAR-γ表达可以促进动脉粥样硬化。Hamblin等[10]研究发现,在PPAR-γ基因表达缺失的小鼠,血管内皮细胞VCAM-1的表达升高,动脉粥样硬化等相关血管病变发生率增加,提示PPAR-γ的缺失可能与动脉粥样硬化发生有着重要联系。
PPAR-γ-肝脏X受体(LXRα)-ABC通路不但在巨噬细胞胆固醇流出机制中具有重要作用,能够抑制动脉粥样硬化斑块的形成,还参与肾脏的脂质代谢。对低密度脂蛋白受体基因敲除糖尿病小鼠动脉的研究表明[11],过氧化物酶体增殖物激活受体α/γ双激动剂可以减轻小鼠脂质沉积和炎性反应,增加斑块内胶原和α-SMA含量,有利于粥样硬化斑块稳定性。研究表明肝脏X受体(LXR-α)激动剂能提高兔系膜细胞ABCA1表达,并促进其介导的胆固醇流出,说明LXR-α通过ABCA1途径参与调节肾脏脂质的平衡[12]。对慢性肾功能不全患者的研究发现,患者巨噬细胞内胆固醇含量增加与ABCA1表达下调有关[13]。
PPAR-γ主要通过抑制炎性反应来实现对动脉粥样硬化的抑制作用,动脉粥样硬化发生发展过程中产生大量的炎症因子,人及动物粥样斑块炎性部位有PPAR-γ高度表达,活化的PPAR-γ通过限制巨噬细胞谱系促炎性反应,在炎性反应中发挥关键调节器的作用,而PPAR-γ在内皮细胞的缺失可促进动脉粥样硬化的发生发展。PPAR-γ受体激动剂罗格列酮能减少巨噬细胞在血管壁的聚集,并抑制炎性反应和动脉粥样硬化斑块的形成。以上研究表明,激活的PPAR-γ在调节内皮功能、维持内皮结构完整、抑制动脉粥样硬化发生发展的过程中发挥重要作用,有望成为治疗动脉粥样硬化的新靶点。
PPAR-γ的配体主要分为天然配体前列腺素J2(PGJ2)及其代谢产物,其中15d-PGJ2是PPAR-γ最有效的天然配体,PPAR-γ激动剂可改善肥胖导致的肾损伤[14],PPAR-γ表达增加还可以减轻氧化损伤介导的肾脏衰老[15-18]。本研究发现PPAR-γ的激动剂天然配体15d-PGJ2,能够剂量依赖性改善IL-1β抑制的ABCA1 mRNA和蛋白表达,抑制炎症导致的脂质失调,在减缓炎症加重的脂质肾损害中发挥关键的作用,推测可能延缓肾小球硬化和肾脏病进展。原发和继发性肾小球肾炎中的炎性反应是肾脏组织损伤的主要机制之一,此研究结果探讨PPARγ激动剂对炎症在细胞水平所致脂质失衡的保护作用,可望为防治肾脏病进展寻找可能的干预措施,为PPARγ激动剂应用于肾脏疾病提供了一定的理论依据。
[1]Jiang Z,Zhou R,Xu C,et al.Genetic valiation of the ATP-binding cassette transporter A1 and susceptibility to coronary heart disease[J].Mol Genet Metab,2011,103(1):81-88.
[2]Pelham CJ,Keen HL,Lentz SR,et al.Dominant negative PPARv promotes atheroselerosis,vascular dysfunction,and hypertension through distinct effects in endothelium and vascular muscle[J].Am J Physiol Regul Integr Comp Physiol,2013,304:R690-R701.
[3]陈昱杨,陈曜,赵蕾,等.炎症干扰PPARγ-LXRα-ABCA1途径介导的肾小球系膜细胞胆固醇外流[J].中国病理生理杂志,2010,26(12):2400-2404.
[4]Wang N,Yin R,Liu Y,et al.Role of peroxisome proliferatoractivated receptor-gamma in atherosclerosis:an update[J]. Circ J,2011,75(2):528-535.
[5]Lim S,Despres JP,Koh KK.Prevention of atherosclerosis in overweight/obese patients in need of novel multi-targeted approaches[J].Circ J,2011,75(5):1019-1027.
[6]Toyama K,Nakamura T,Kataoka K,et al.Telmisartan protects against diabetic vascular complications in a mouse model of obesity and type 2 diabetes,partially through peroxisome proliferator activated receptor-gamma-dependent activity[J].Biochem Biophys Res Commun,2011,410(10):508-513.
[7]Hu Q,Zhang XJ,Liu CX,etal.Ppargamma1-induced caveolin-1 enhances cholesterolefflux and attenuates atherosclerosisin apolipoprotein E-deficientmice[J].JVasc Res,2010,47:69-79.
[8]张雪,吴崇明,郭鹏.改善胆固醇流出作用靶分子及相关药物研究进展[J].国际药学研究杂志,2014,1(41):94-98.
[9]Ozasa H,Ayaori M,Iizuka M,et al.Pioglitazone enhances cholesterol efflux from macrophagesby increasing ABCA1/ ABCG1 expressions via PPAR gamma/LX Ralpha pathway:findings from in vitro and ex vivo studies[J].Atherosclerosis,2011,219:141-150.
[10]Hamblin M,Chang L,Zhang H,etal.Vascularsmooth muscle cell peroxisome proliferator-activated receptor-gamma mediates pioglitazone-reduced vascular lesion formation[J].Arterioscler Thromb Vasc Biol,2011,31:352-359.
[11]张步春,李宪凯,车文良,等.过氧化物酶体增殖物激活受体α/γ双激动剂对低密度脂蛋白受体基因敲除糖尿病小鼠动脉粥样硬化斑块稳定性的影响[J].中华心血管病杂志,2013,2(41):143-149.
[12]Jing Wu,Yahua Zhang,Nanping Wang,et al.Liver X receptor-alpha mediates cholesterol efflux in glomerular mesangialcells[J].Am J Physiol Renal Physiol,2004,287(5):F886-F895.
[13]周家军,甘华,刘彩欣,等,慢性肾功能不全通过下调ABCA1表达影响巨噬细胞内胆固醇含量[J].第三军医大学学报,2013,6:543-546.
[14]李颖,夏天,王荔,等.过氧化物酶体增殖物激活受体γ激动剂对肥胖小鼠血清脂联素、尿蛋白排泄及肾脏病理的作用[J].中华肾脏病杂志,2014,30(2):128-133.
[15]叶婷,宁勇.过氧化物酶增殖物激活受体-γ和核因子E2相关因子-2在肾脏衰老中的作用[J].中国医药导报,2014,11(30):4-7.
[16]宁勇,何泳,马祖福,等.替米沙坦对5/6肾切除肾衰竭大鼠的肾脏保护作用及其机制研究[J].中国医药,2012,7(4):385-388.
[17]李勇,孙帅奇,李普阳,等.过氧化物酶体增殖物激活受体γ激动剂治疗促肾上腺皮质激素型垂体腺瘤的实验研究[J].中华脑科疾病与康复杂志:电子版,2013,3(1):15-19.
Impact of peroxisome proliferator activated receptor-γagonist on the expression of ATP-binding cassette transporter A1 in human mesangial cell treated by interleukin-1β
LIU Hua
Department of Nephrology,Xuanwu Hospital,Capital Medical University,Beijing 100053,China
ObjectiveTo observe the protective effect of peroxisome proliferator activated receptor-γ(PPAR-γ)agonist for human mesangial cell(HMC)by the rgulation of ATP-binding cassette transporter A1(ABCA1)when stimulated by interleukin-1β(IL-1β)from progression of kidney diseases.MethodsHMC cultured for 24 hours were randomly divided into 5 groups:blank group:normal cultured cells;control group:cultured cells stimulated by dose of 5 ng/mL IL-1β;study group:cultured cells stimulated separately by 5 ng/mL IL-1β+2.5μmol/L 15d-PGJ2,5 ng/mL IL-1β+5 μmol/L 15d-PGJ2,5 ng/mL IL-β+10μmol/L 15d-PGJ2,the mRNA levels of ABCA1 were examined using Real-time PCR.Similarly,HMC cultured for 24 hours were randomly divided into 4 groups:blank group:normal cultured cells; control group:cultured cells stimulated by dose of 5 ng/mL IL-1β;study group:cultured cells stimulated separately by dose of 5 ng/mL IL-1β+5μmol/L 15d-PGJ2,5 ng/mL IL-β+10μmol/L 15d-PGJ2,the protein levels of ABCA1 were detected by Western blot.ResultsThe expression of ABCA1 mRNA and protein of HMC can be reduced by IL-1β while the inhibition expression could be increased by co-cultured with 15d-PGJ2 in a dose-dependent manner.When co-cultured with 2.5,5,10μmol/L dose of 15d-PGJ2,the expression of ABCA1 mRNA of HMC could be increased 1.34,2.15,2.88 times compared with the control group,while the expression of ABCA1 protein could be increased 1.16,1.54 times respectively when co-cultured with 5,10μmol/L dose of 15d-PGJ2,compared with the control group.ConclusionThe decreasing expression of ABCA1 stimulated by IL-1βcan be offset by 15d-PGJ2 in a dose-dependent manner which mean that PPAR-γagonist has a protective effect of HMC for dyslipidemia enhanced by inflammatory cytokines.
Peroxisome proliferator activated receptor-γagonist;Human mesangial cell;Interleukin-1β;ATP-binding cassette transporter A1
R692
A
1673-7210(2015)07(b)-0007-05
2015-03-30本文编辑:任念)
北京市科委资助项目(SCW2009-07)。
