喉鳞癌中三磷酸腺苷酶家族蛋白2、抗磷酸化致癌基因和张力蛋白同源的磷酸酶基因的表达及意义
2015-01-11朱赟王小红
朱赟 王小红
1.浙江省鄞州第二医院耳鼻咽喉科,浙江宁波315100;2.浙江省肿瘤医院化疗中心,浙江杭州310022
喉鳞癌中三磷酸腺苷酶家族蛋白2、抗磷酸化致癌基因和张力蛋白同源的磷酸酶基因的表达及意义
朱赟1王小红2
1.浙江省鄞州第二医院耳鼻咽喉科,浙江宁波315100;2.浙江省肿瘤医院化疗中心,浙江杭州310022
目的检测喉鳞癌中三磷酸腺苷酶家族蛋白2(ATAD2)、抗磷酸化致癌基因(C-MYC)和张力蛋白同源的磷酸酶基因(PTEN)的表达,分析其临床价值。方法收集2012年3月~2014年2月经宁波市鄞州第二医院诊断并行喉鳞癌根治术的患者99例,选择术中留取的癌组织标本作为观察组,选择其中78例患者癌旁正常组织标本为对照组。采用免疫组化检测二组中ATAD2、C-MYC和PTEN的表达。结果观察组中ATAD2(63.64%比12.82%)和C-MYC(70.71%比16.67%)表达的阳性率明显高于对照组,PTEN的表达明显低于对照组(20.20%比82.50%),差异有高度统计学意义(P<0.01)。观察组中ATAD2、C-MYC和PTEN表达的阳性率与肿瘤体积、淋巴结转移、脉管浸润和Ki67的表达有关(P<0.05)。相关性分析显示观察组中ATAD2与C-MYC的表达呈正相关(r=0.43,P<0.05),ATAD2与PTEN的表达呈负相关(r=-0.46,P<0.05)。结论喉鳞癌组织中ATAD2、C-MYC高表达、PTEN低表达,对肿瘤的发生和进展有促进作用,ATAD2与C-MYC、PTEN可能具有一定的协同作用。
喉鳞癌;三磷酸腺苷酶家族蛋白2;抗磷酸化致癌基因;张力蛋白同源的磷酸酶基因
喉鳞癌临床常见,病变发展过程中基因和蛋白异常表达是其重要的促进因素。三磷酸腺苷酶家族蛋白2(ATAD2)是一种雌、雄激素受体,研究认为抗磷酸化致癌基因(C-MYC)可能与多种基因的活化物和调节通路有关[1-2]。近年来研究认为ATAD2高表达可以有效促进肿瘤的进展[3-4]。张力蛋白同源的磷酸酶基因(PTEN)可以调节肿瘤细胞中DNA合成及细胞的分化,对肿瘤进展有促进作用[5-6]。PTEN是临床标记预后常用的蛋白,能对细胞信号通路中的信号分子起作用,并通过诱导细胞周期阻滞和调节细胞凋亡发挥抑制肿瘤的作用[7-8]。本研究重点探讨喉鳞癌中ATAD2、C-MYC和PTEN的表达,并分析其临床意义,现报道如下:
1 材料与方法
1.1 实验材料
收集2012年3月~2014年2月,宁波市鄞州第二医院经诊断并行喉鳞癌根治术的患者99例,选择术中留取的癌组织标本作为观察组,选择其中78例患者的距肿瘤边缘大于3 cm,并经病理证实为正常鳞状上皮的喉黏膜组织为对照组。所有标本均经病理主治医师再次阅片确认,并排除术前行放、化疗的患者。观察组中男58例,女41例,年龄40~81岁,平均(62.6± 5.4)岁;对照组中男40例,女38例,年龄40~79岁,平均(60.5±5.2)岁。两组性别、年龄的一般资料比较,差异有统计学意义(P<0.05),具有可比性。
1.2 方法
免疫组化检测ATAD2、C-MYC和PTEN蛋白的表达,应用免疫组织化学技术二步法,DAB染色,严格实验步骤。ATAD2、C-MYC和PTEN蛋白检测结果的判定方法:ATAD2阳性部位是细胞核,C-MYC和PTEN阳性部位是细胞质和/或细胞膜;选择10个400倍的高倍视野对上皮细胞进行观察,计算阳性细胞数与总细胞数的比值,取平均值,≥25%为阳性,<25%为阴性。
采用统计软件SAS 6.12对数据进行分析,正态分布计量资料以均数±标准差表示,两组间比较采用t检验;计数资料以率表示,采用χ2检验。相关性分析采用线性相关性分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 两组中ATAD2、C-MYC和PTEN蛋白表达情况
ATAD2和C-MYC在观察组中的表达阳性率明显高于对照组,PTEN的表达阳性率明显低于对照组,差异有高度统计学意义(P<0.01)。见表1。
2.2 观察组中不同临床特征ATAD2、CMYC和PTEN表达情况
观察组中ATAD2、C-MYC和PTEN的表达与肿瘤最大径、淋巴结转移、脉管浸润和Ki67的表达有关。见表2。
2.3 观察组中ATAD2、C-MYC和PTEN表达的相关性分析
发热是多种疾病所共有的病理过程,除去病因外,对发热本身的治疗应针对病情,权衡利弊。对一些原因不明的发热,不能急于降低体温,以免掩盖病情、延误诊断和抑制机体的免疫功能。
线性进行相关性分析显示:ATAD2与C-MYC呈正相关(r=0.43,P=0.0420),ATAD2与PTEN呈负相关(r=-0.46,P=0.0371)。
3 讨论
喉鳞癌常见于中老年人,肿瘤常由异型增生的鳞状上皮发展而来,在此过程中,多种基因和蛋白的表达出现异常。ATAD2定位在染色体8q24,是ATP酶家族的重要成员[9-10]。目前研究显示ATAD2蛋白为含有220个氨基酸的蛋白,其结构中有典型的ATP结合位点,此位点也是ATAD2对下游蛋白合成与分解重要的调控点[11-12]。近来多项研究认为ATAD2高表达与肿瘤的进展有关[13-14]。C-MYC是癌基因,可以和DNA进行有效地结合,并调控转录因子。也有研究认为CMYC是细胞周期的调控开关之一,即决定从G0/G1期进入S期[15]。也有观点认为C-MYC异常表达对细胞的正常生长发育及癌变起重要作用[16]。PTEN作为机体首先发现的磷酸酯酶活性的蛋白,可以引起细胞内第二信使磷脂酰肌醇(3,4,5)-三磷酸(PIP3)出现去磷酸化,抑制细胞的增殖过程[17]。也有研究显示肿瘤在进展中PTEN低表达时可以引起内皮细胞迁移能力增强及肿瘤血管的新生,进而加速肿瘤进展[18]。
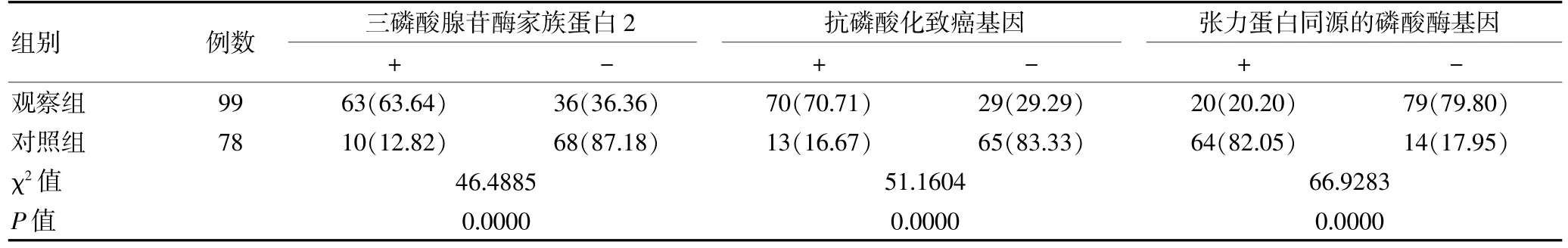
表1 两组三磷酸腺苷酶家族蛋白2、抗磷酸化致癌基因和张力蛋白同源的磷酸酶基因蛋白表达情况[n(%)]

表2 观察组中不同临床特征三磷酸腺苷酶家族蛋白2、抗磷酸化致癌基因和张力蛋白同源的磷酸酶基因表达情况[n(%)]
免疫组化技术成熟,其标记的蛋白表达准确、客观。实验结果显示ATAD2和C-MYC的表达在观察组中升高(P<0.05),PTEN的表达在观察组中下降(P<0.05),提示ATAD2、C-MYC高表达、PTEN低表达促进肿瘤的发生。实验结果显示观察组中ATAD2、C-MYC和PTEN表达的阳性率与肿瘤体积、淋巴结转移、脉管浸润和Ki67的表达有关(P<0.05),提示三者异常表达促进肿瘤的生长、淋巴结播散、脉管侵犯和细胞的增殖过程。由于以上因素均为临床判断肿瘤生物学行为、预后的重要指标,因此三者异常表达可能在一定程度上提示患者预后情况。本实验的相关性分析显示观察组中ATAD2和C-MYC的表达呈正相关(r=0.43,P<0.05),ATAD2和PTEN的表达呈负相关(r=-0.46,P<0.05),提示ATAD2可以调节CMYC和PTEN的表达,三者具有一定的协同作用。有研究显示ATAD2与C-MYC可能与中介蛋白和活化物相关,即ATAD2与C-MYC对下游蛋白的调节作用可能更趋于一致,引起肿瘤的恶性转化和进展[19-20]。也有观点认为ATAD2是雌激素受体的共活化物,可以由前列腺素等诱导而激活,激活的ATAD2作用于雌激素受体的下游靶基因,如C-MYC和E2F等,进而引起细胞的增殖,加速肿瘤的生长和浸润[21]。但是关于ATAD2、C-MYC和PTEN协同作用的具体调节机制有待更多基础实验证实。
综上所述,喉鳞癌组织中ATAD2、C-MYC高表达、PTEN低表达,对肿瘤的发生和进展有促进作用,ATAD2与C-MYC、PTEN可能具有一定的协同作用。
[1]Duan Z,Zou JX,Yang P,et al.Developmental and androgenic regulation of chromatin regulators EZH2 and ANCCA/ATAD2 in the prostate Via MLL histone methylase complex[J].Prostate,2013,73(5):455-466.
[2]Fouret R,Laffaire J,Hofman P,et al.A comparative and integrative approach identifies ATPase family,AAA domain containing 2 as a likely driver of cell proliferation in lung adenocarcinoma[J].Clin Cancer Res,2012,18(20):5606-5616.
[3]Salhia B,Kiefer J,Ross JT,et al.Integrated genomic and epigenomic analysis of breast cancer brain metastasis[J]. PLoS One,2014,9(1):e85448.
[4]Boussouar F,Jamshidikia M,Morozumi Y,et al.Malignant genome reprogramming by ATAD2[J].Biochim Biophys Acta,2013,1829(10):1010-1014.
[5]陆毅.C-MYC基因和P16基因在结肠癌中的表达及临床意义[J].中国老年学杂志,2010,30(11):1602-1603
[6]Langlois NE,Lamb J,Eremin O,et al.Apoptosis in colorectal carcinoma occurring in patients aged 45 years and under:relationship to prognosis,mitosis,and immunohistochemical demonstration of p53,C-MYC and bcl-2 protein products[J].J Pathol,1997,182(4):392-397.
[7]Ge H,Cao YY,Chen LQ,et al.PTEN polymorphisms and the risk of esophageal carcinoma and gastric cardiac carcinoma in a high incidence region of China[J].Dis Esophagus,2008,21(5):409-415.
[8]Pi W,Guo X,Su L,et al.BMP-2 up-regulates PTEN expression and induces apoptosis of pulmonary artery smooth muscle cells under hypoxia[J].PLoS One,2012,7(5):e35283.
[9]Raeder MB,Birkeland E,Trovik J,et al.Integrated genomic analysis of the 8q24 amplification in endometrial cancers identifies ATAD2 as essential to MYC-dependent cancers[J].PLoS One,2013,8(2):e54873.
[10]Leachman NT,Brellier F,Ferralli J,et al.ATAD2B is a phylogenetically conserved nuclear protein expressed during neuronal differentiation and tumorigenesis[J].Dev Growth Differ,2010,52(9):747-755.
[11]Kalashnikova EV,Revenko AS,Gemo AT,et al.ANCCA/ ATAD2 overexpression identifies breast cancer patients with poor prognosis,acting to drive proliferation and survival of triple-negative cells through control of BMyb and EZH2[J].Cancer Res,2010,70(22):9402-9412.
[12]Revenko AS,Kalashnikova EV,Gemo AT,etal.Chromatin loading ofE2F-MLL complex by cancer-associated coregulator ANCCA via reading a specific histone mark[J]. Mol Cell Biol,2010,30(22):5260-5272.
[13]Caron C,Lestrat C,Marsal S,et al.Functional characterization of ATAD2 as a new cancer/testis factor and a predictor of poor prognosis in breast and lung cancers[J]. Oncogene,2010,29(37):5171-5181.
[14]Hsia EY,Kalashnikova EV,Revenko AS,etal.Deregulated E2F and the AAA+coregulator ANCCA drive protooncogene ACTR/AIB1 overexpression in breast cancer[J]. Mol Cancer Res,2010,8(2):183-193.
[15]Li N,Wang J,Shen S,et al.Expression of p53,Ki-67 and C-MYC proteins is predictive of the surgical molecular margin in colorectalcarcinoma[J].PatholOncolRes,2011,17(3):479-487.
[16]Zalata KR,Nasif WA,Ming SC,et al.p53,Bcl-2 and CMYC expressions in colorectal carcinoma associated with schistosomiasis in Egypt[J].Cell Oncol,2005,27(4):245-253.
[17]赵先兰,程淑霞,孔祥东.P16INK4A和PTEN在高危型HPV相关宫颈癌组织中的表达及意义[J].癌症,2007,26(5):480-483.
[18]Tanic N,Milovanovic Z,Tanic N,et al.The impact of PTEN tumor suppressor gene on acquiring resistance to tamoxifen treatment in breast cancer patients[J].Cancer Biol Ther,2012,13(12):1165-1174.
[19]Ciro M,Prosperini E,Quarto M,et al.ATAD2 is a novel cofactor for MYC,overexpressed and amplified in aggressive tumors[J].Cancer Res,2009,69(21):8491-8498.
[20]Zhu W,Cai MY,Tong ZT,etal.Overexpression of EIF5A2 promotes colorectal carcinoma cell aggressiveness by upregulating MTA1 through C-MYC to induce epithelial-mesenchymaltransition[J].Gut,2012,61(4):562-575.
[21]果海娜,李良,黄锦叶,等.乳腺浸润性导管癌中ATAD2的表达及其临床意义[J].临床与实验病理学杂志,2014,30(1):15-17.
Expression and significance of ATAD2,C-MYC and PTEN in laryngeal squamous carcinoma
ZHU Yun1WANG Xiaohong2
1.Department of Otolaryngology,Yinzhou Second Hospital,Zhejiang Province,Ningbo 315100,China;2.Chemotherapy Center,Zhejiang Provincial Tumor Hospital,Zhejiang Province,Hangzhou 310022,China
ObjectiveTo detect the expressions of ATAD2,C-MYC and PTEN in laryngeal squamous carcinonma,analyze their clinical significance.MethodsFrom March 2012 to February 2014,in Yinzhou Second Hospital,99 patients diagnosed and underwent laryngeal squamous carcinoma radical prostatectomy were collected,intraoperative carcinoma tissue samples were selected as observation group,normal tissue adjacent to carcinoma samples of 78 cases from these laryngeal squamous carcinonma patients were selected as control group.Expressions of ATAD2,C-MYC and PTEN were detected by IHC methods in two groups.ResultsThe positive rate of ATAD2(63.64%vs12.82%)and C-MYC (70.71%vs16.67%)were in the observation group higher than those in control group,the positive rate of PTEN in the observation group were lower than that in control group(20.20%vs82.50%),the differences were statistically significant(P<0.01).The positive rate of ATAD2,C-MYC and PTEN were correlated with tumor size,lymph node metastasis,vascular invasion and Ki67 expression(P<0.05).In observation group,there was a positive relationship between ATAD2 and C-MYC(r=0.43,P<0.05),and a negative relationship between ATAD2 and PTEN in observation group (r=-0.46,P<0.05).ConclusionThe higher-expressions of ATAD2 and C-MYC,lower-expression of PTEN can promote occurrence and development in laryngeal squmous carcinoma.ATAD2 and C-MYC,ATAD2 and PTEN may have a syngergistic effect.
Laryngeal squmous carcinoma;ATAD2;C-MYC;PTEN;IHC
R739.65
A
1673-7210(2015)07(b)-0004-04
2015-01-05本文编辑:苏畅)
国家自然科学基金资助项目(31370910)。
朱赟(1981.10-),女,硕士;研究方向:耳科学。
