表皮细胞生长因子61 A/G基因多态性与胃癌易感性的Meta分析
2015-01-11王明珠谭诗云郭芳舒泳翔
王明珠 谭诗云 郭芳 舒泳翔
武汉大学人民医院消化内科,湖北武汉430060
表皮细胞生长因子61 A/G基因多态性与胃癌易感性的Meta分析
王明珠 谭诗云 郭芳 舒泳翔
武汉大学人民医院消化内科,湖北武汉430060
目的评价表皮细胞生长因子(EGF)61 A/G基因多态性与胃癌易感性的关联性。方法计算机检索PubMed、Medline、EMbase、CBM、CNKI、万方和维普等数据库。检索时间从建库至2015年1月1日,收集EGF61 A/G基因多态性与胃癌易感性的病例对照研究。采用RevMan 5.2和Stata 12.0软件计算合并效用量OR及其95%CI。结果共纳入6个研究,其中有1502例患者,2762例对照者。Meta分析结果发现,3个遗传模型中EGF61 A/G基因多态性与胃癌易感性的相关性差异均有统计学意义(显性模型:OR=1.31,95%CI:1.06~1.61;隐形模型:OR=1.27,95%CI:1.01~1.60;GG和AA:OR=1.39,95%CI:1.10~1.76),而在AG和AA遗传模型中,两者差异无统计学意义(OR=1.23,95%CI:0.98~1.54)。基于人种的亚组分析显示:EGF61 A/G基因多态性可增加亚洲人罹患胃癌的风险(显性模型:OR=1.47,95%CI:1.13~1.91;隐形模型:OR=1.37,95%CI:1.16~1.60;GG和AA:OR= 1.66,95%CI:1.27~2.17),但与白种人群胃癌风险无明显相关。结论基于目前的研究结果,可以认为EGF61 A/G基因多态性与胃癌易感性相关,且EGF61 A/G基因多态性可增加亚洲人罹患胃癌的风险。
表皮细胞生长因子;胃癌;基因多态性;Meta分析;病例-对照研究
胃癌是全球癌症死亡的第二大原因,每年死于胃癌的约有738 000人,其中几乎一半的胃癌病例发生在中国[1]。流行病学调查研究表明,某些环境因素(如高盐饮食、吸烟和幽门螺杆菌感染)在胃癌发生发展中起重要作用[2-3],然而,越来越多的证据表明,通过基因与环境的相互作用,宿主因素和遗传改变胃癌的发生中可能也发挥重要作用[4]。表皮细胞生长因子(EGF)是一种内分泌因子,有多种生物功能,它可通过与特异性受体表皮生长因子(EGFR)结合,发挥其调节细胞增殖、分化及血管生成的作用[5]。EFG位于人染色体4号染色体上,其中有24个外显子和23个内含子,而EGF61 A/G是位于5'非编码区的基因[6]。其功能多态性与胃癌风险相关性已被大量研究,但结论却不尽相同,本研究采用Meta分析旨在更全面地评估EGF61 A/G基因多态性与胃癌易感性的关系。
1 资料与方法
1.1 检索策略
计算机检索PubMed、Medline、EMbase、CBM、CNKI、万方和维普等数据库。中文检索以“表皮生长因子”或“EGF”、“胃癌”、“基因多态性”为检索词,英文检索以“epidermal growth factor or EGF”、“variation or polymorphism or SNP”、“gastric cancer”等为检索词,无语言限制,搜索由两位研究人员独立进行,检索时间从建库截至2015年1月1日,同时辅以手工检索。
1.2 纳入与排除标准
纳入标准:①必须病例对照研究。②必须提供胃癌的病例数和对照数。③必须提供病例组及对照组GG、AG、AA各基因型频数,以计算OR值及95%CI。排除标准:①研究重复发表或者无可用数据报道。②个案、综述、述评等文献。③控制组的基因分布不符合Hardy-Weinberg平衡(HWE)。
1.3 资料提取
由两名研究者独立对文献进行筛选并核对,当其意见不一致时,通过商讨或者通过第三方介入。提取的资料主要有第一作者的名字、发表年、国家、病例组和对照组GG、AG、AA各基因型频数及对照组H-W平衡检验值(当P<0.05认为不符合H-W平衡规律)。
1.4 统计学方法
统计分析采用Cochrane协作网提供的RevMan5.2版软件。合并效应量选用比值比(OR)及95%CI。对纳入研究做以下处理:①异质性的检验:用Q检验和I2检验,当P≥0.1、I2<50%时,可认为不存在统计学异质性,用固定效应模型进行Meta分析;当P<0.1,I2>50%时各研究结果不同质,选用随机效应模型。②H-W遗传平衡检验:其方法是利用在线软件(http://ihg.gsf.de/cgi-bin/hw/hwa1.pl)进行计算,P>0.05,说明群体是随机婚配,符合H-W平衡的,可以用于遗传学分析,否则剔除掉。③偏倚的评价:用Begg漏斗图及Egger线性回归分析来估计潜在的发表偏倚,当P>0.05,不存在发表偏倚。
2 结果
2.1 文献检索结果
初检获得文献9篇,其中中文文献1篇,英文文献8篇,通过阅读全文后剔除3篇(3篇均为非胃癌研究),故最后纳入6个研究[7-12],包括1502例患者,2762例对照者,6篇文章有5篇英文[7-11],1篇中文[12],其中1篇为葡萄牙人[7],2篇为日本人[8-9],3篇为中国人[10-12]。纳入研究的一般情况见表1。
2.2 Meta分析结果
对纳入的6个研究[7-12]合并进行Meta分析,结果如表2所示。四个模型中,仅隐性模型(I2=60%)存在异质性,采用随机效应模型数据合并,其余模型均不存在异质性(I2<50%),故采用固定效应模型进行数据合并。结果表明3个遗传模型中EGF61 A/G基因多态性与胃癌易感性的相关性差异均有统计学意义(显性模型:OR=1.31,95%CI:1.06~1.61;隐形模型:OR=1.27,95%CI:1.01~1.60;GG和AA:OR=1.39,95%CI:1.10~1.76),而在AG和AA遗传模型中,两者差异无统计学意义(OR=1.23,95%CI:0.98~1.54)。基于人种的亚组分析显示:EGF61A/G基因多态性可增加亚洲人罹患胃癌的风险(显性模型:OR=1.47,95%CI:1.13~1.91;隐形模型:OR=1.37,95%CI:1.16~1.60;GG和AA:OR=1.66,95%CI:1.27~2.17),但与白种人群胃癌风险无明显相关。见表2、图1。
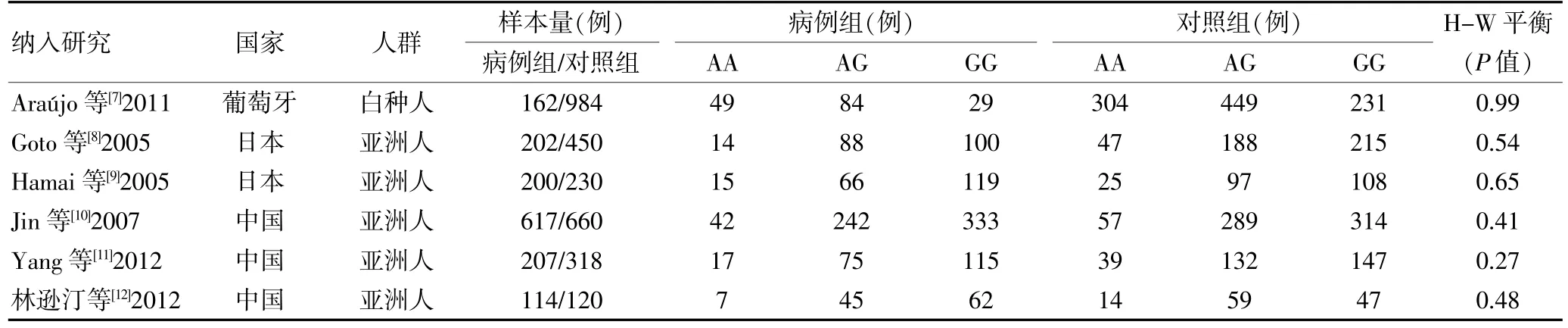
表1 纳入研究的基本特征
2.3 敏感性分析
依次剔除各项研究,每次仅1篇被剔除,发现剔除Araújo等[7]的研究后,研究间的异质性也随之消失,但是各个模型的合并效应量OR值无明显变化,证实了我们所得结果的可靠性。

表2 各遗传模型Meta分析主要结果汇总
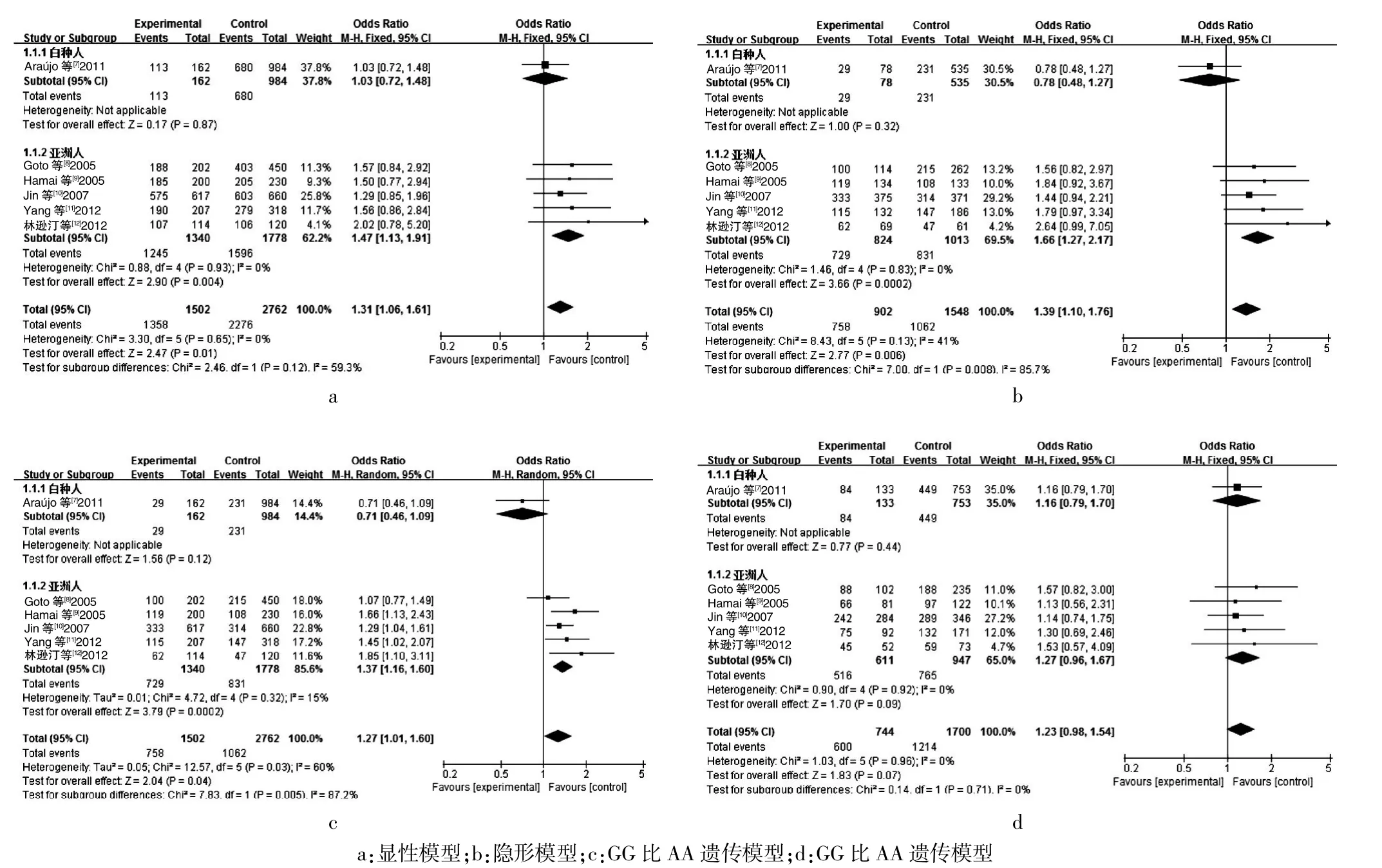
图1 总人群EGF61 A/G基因多态性与胃癌相关性的Meta分析
2.4 发表偏倚分析
Begg漏斗图及Egger线性回归分析被用来估计潜在的发表偏倚。如图2所示,未见发表偏倚,Begg秩相关法结果显示P=0.084,Egger回归法结果显示P=0.064。
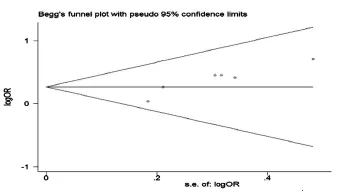
图2 EGF61 A/G基因多态性与胃癌相关性Meta分析发表偏倚风险结果(显性模型)
3 讨论
EGF不仅在细胞信号转导、细胞增殖和细胞生存中起着重要作用,而且在其他几个重要的癌症进展中发挥关键作用,包括血管生成、转移和抑制细胞凋亡[13-16]。EGF与EGFR结合后,可以诱导信号级联反应,造成基因转录水平的变化,最终导致肿瘤的发生[17]。据报道,EGF基因突变可以引起EGF和EGFR过表达,使细胞内的酪氨酸激酶被激活,从而引起肿瘤的转化和发展[18]。
近几年,EGF61 A/G基因多态性与胃癌易感性的研究被大量报道,然而结论不尽相同。本文共纳入6篇病例-对照研究,其中有3篇国外研究[7-9],3篇国内研究[10-12],其中Hamai等[9]、Jin等[10]和Yang等[11]认为携带等位基因A可以降低胃癌风险,Araújo等[7]认为携带等位基因A可以增加胃癌风险,Goto等[8]认为二者无明显关系,林逊汀等[12]认为携带等位基因G可以增加胃癌风险。通过合并效应量提示EGF61 A/G基因多态性与胃癌易感性的相关。基因型GG、GG+AG及等位基因G均可增加罹患胃癌风险,而基因型AG与胃癌无明显相关。基于人种的亚组分析显示EGF61 A/G基因多态性可增加亚洲人罹患胃癌的风险,但与白种人群胃癌风险无明显相关。
经异质性检验发现,在隐形遗传模型(GG和AG+GG)中存在异质性,我们通过敏感性分析及亚组分析寻找异质性,结果发现当剔除Araújo等[7]的研究后,研究间的异质性也随之消失,但是各个模型的合并效应量OR值无明显变化,这不仅提示该文献为引起异质性的原因,而且表明我们所得结果较为稳定。Begg漏斗图及Egger线性回归亦未发现存在发表偏倚,进一步证实了我们所得结论的可靠性。
本文尚存在以下不足:①首先样本量比较小,仅6篇,不可能全面评估EGF61 A/G基因多态性与胃癌风险的相关性;②由于控制源及样品检测的差异,可能存在一定的选择偏倚;③本研究结果是基于没有调整的OR值,故可能存在一定的混杂因素,诸如年龄、性别地理分布;④未考虑基因与环境的相互作用。
总之,基于目前研究结果认为,EGF61 A/G基因多态性与胃癌易感性相关,且EGF61 A/G基因多态性可增加亚洲人罹患胃癌的风险,它有可能成为胃癌基因治疗的新靶点。但我们仍需关注后续相关研究,以期科学评价EGF61 A/G基因多态性与胃癌易感性的关系。
[1]Ferlay J,Steliarova-Foucher E,Lortet-Tieulent J,et al. Cancerincidence and mortality patterns in Europe:estimates for40 countries in 2012[J].Eur JCancer,2013,49(6):1374-1403.
[2]Crew KD,NeugutAI.Epidemiology ofupper gastrointestinal malignancies[J].Semin Oncol,2004,31(4):450-464.
[3]Uemura N,Okamoto S,Yamamoto S,etal.Helicobacterpylori infection andthe development of gastric cancer[J].N Engl J Med,2001,345(11):784-789.
[4]Lichtenstein P,Holm NV,Verkasalo PK,etal.Environmental and heritable factors in the causation of cancer-analyses of cohorts of twins from Sweden,Denmark,and Finland[J]. N Engl J Med,2000,343(2):78-85.
[5]Kasza A.IL-1 and EGF regulate expression ofgenesimportant in inflammation and cancer[J].Cytokine,2013,62(1):22-33.
[6]Piao Y,Liu Z,Ding Z,et al.EGF+61A>G polymorphism and gastrointestinal cancer risk:a huge review and metaanalysis[J].Gene,2013,519(1):26-33.
[7]Araújo AP,Costa BM,Pinto-Correia AL,et al.Association between EGF+61A/G polymorphism and gastric cancer in Caucasians[J].World J Gastroenterol,2011,17(4):488-492.
[8]GotoY,Ando T,Goto H,et al.Association between EGF promoterpolymorphisms and cancerrisk:a meta-analysis[J]. CancerEpidemiolBiomarkersPrev,2005,14(10):2454-2456.
[9]HamaiY,Matsumura S,MatsusakiK,etal.Asingle nucleotide polymorphism in the 5'untranslated region ofthe EGF gene is associated with occurrence and malignant progression of gastric cancer[J].Pathobiology,2005,72(3):133-138.
[10]Jin G,Miao R,Deng Y,et al.Variant genotypes and haplotypes of the epidermal growth factor gene promoter are associated with a decreased risk of gastric cancer in a high-risk Chinese population[J].Cancer Sci,2007,98(6):864-868.
[11]Yang G,Rao L,Tian L,et al.An association between EGF and EGFR gene polymorphisms with gastric cancer in a Chinese Han population[J].Hepatogastroenterology,2012,59(120):2668-2671.
[12]林逊汀,吴国洋,傅锦波,等.EGF 61*G/A基因多态性与胃癌的关系[J].临床研究,2012,32(11):231-232.
[13]Mantel N,Haenszel W.Statisticalaspects ofthe analysis of data from retrospective studies ofdisease[J].J Natl Cancer Inst,1959,22(4):719-748.
[14]Benhamou S,Lee WJ,Alexandrie AK,etal.Meta-and pooled analyses of the effects of glutathione Stransferase M1 polymorphisms and smoking n lung cancer risk[J]. Carcinogenesis,2002,23(8):1343-1350.
[15]Egger M,Davey Smith G,Schneider M,etal.Bias in metaanalysis detected by a simple,graphical test[J].BMJ,1997,315(7109):629-634.
[16]Ciardiello F,Tortora G.A novel approach in the treatment ofcancer:targeting the epidermalgrowth factorreceptor[J]. Clin Cancer Res,2001,7(10):2958-2970.
[17]Henson ES,Gibson SB.Surviving cell death through epidermalgrowth factor(EGF)signaltransduction pathways:implications for cancer therapy[J].Cell Signal,2006,18(12):2089-2097.
[18]Wang LY,Liu YP,Chen LG,et al.Pyruvate kinase M2 plays a dual role on regulation of the EGF/EGFR signalingvia E-cadherin-dependent manner in gastric cancer cells[J].PLoS One,2013,8(6):e67542.
Meta analysis of epidermal growth factor 61 A/G polymorphism and susceptibility of gastric cancer
WANG Mingzhu TAN Shiyun GUO Fang SHU Yongxiang
Department of Gastroenterology,Renmin Hospital of Wuhan University,Hubei Province,Wuhan 430060,China
ObjectiveTo evaluate the relevance of epidermal growth factor(EGF)61 A/G polymorphism and susceptibility of gastric cancer.MethodsThe database of PubMed,Medline,EMbase,CBM,CNKI,Wanfang and VIP published from constructing database to January 1,2015 were searched,so as to collect case-control study about EGF61 A/ G polymorphism and susceptibility ofgastric cancer.Pooled odds ratios(OR)with 95%confidence intervals(95%CI)were calculated by the RevMan 5.2 and Stata 12.0 software.ResultsSix controlled clinical trials(1502 cases and 2762 controls)were enrolled.Meta-analysis showed that there were significant differences of relevance between EGF61 A/G polymorphism and susceptibility of gastric cancer in the three genetic models(dominant model:OR=1.31,95%CI: 1.06-1.61;recessive model:OR=1.27,95%CI:1.01-1.60;GGvsAA:OR=1.39,95%CI:1.10-1.76),however,there was no significant difference between AG model and AA model(OR=1.23,95%CI:0.98-1.54).The subgroup analysis by ethnicity showed that EGF61 A/G polymorphism could increase the risk of gastric cancer of Asian population(dominant model:OR=1.47,95%CI:1.13-1.91;recessive model:OR=1.37,95%CI:1.16-1.60;GGvsAA:OR=1.66, 95%CI:1.27-2.17).However,it had no relevance with the risk gastric cancer of the white population.ConclusionBased on the current research results,EGF61 A/G polymorphism is associated with the susceptibility of gastric cancer, and EGF61 A/G polymorphism can increase the risk of gastric cancer in Asian population.
Epidermal growth factor;Gastric cancer;Gene polymorphism;Meta analysis;Case-control study
R735.7
A
1673-7210(2015)07(b)-0085-04
2015-01-19本文编辑:张瑜杰)
湖北省自然科学基金项目(2013CFA076)。
王明珠(1989-),女,武汉大学第一临床学院2013级消化内科在读硕士研究生,主要从事消化道肿瘤的防治。
谭诗云(1952-),男,博士研究生导师;研究方向:消化道肿瘤的防治。
