正交试验优选鹿茸胃内仿生的提取工艺
2015-01-11徐刚胡朝奇白珺陈新
徐刚 胡朝奇 白珺 陈新
1.芜湖先声中人药业有限公司,安徽芜湖241080;2.长春中医药大学药学院,吉林长春130117
正交试验优选鹿茸胃内仿生的提取工艺
徐刚1胡朝奇1白珺2陈新2
1.芜湖先声中人药业有限公司,安徽芜湖241080;2.长春中医药大学药学院,吉林长春130117
目的建立鹿茸胃内仿生提取的最优工艺。方法以鹿茸细粉粒度、细粉与提取介质体积比、提取温度、转速、提取时间和提取次数作为试验因素,采用正交试验设计和单因素分析方法,以总氨基酸含量作为指标,进行鹿茸胃内仿生提取最优工艺研究。结果鹿茸胃内仿生提取最优工艺为:鹿茸细粉粒度100目,细粉与提取介质体积比1∶50,提取温度37℃,转速50 r/min,提取时间1 h,提取次数1次。结论鹿茸仿生提取工艺稳定、可靠,初步实现了鹿茸在人体胃液中代谢过程,对鹿茸药效物质的开发及应用具有重要的研究意义。
鹿茸曰胃内曰仿生提取曰工艺研究
鹿茸(Cornu Cervi Pantotrichum)为鹿科动物梅花鹿Cervus nippon Temminck或马鹿Cervus phus Linnaeus的雄性未骨化密生茸毛的幼角。中医理论认为鹿茸具有“补肾阳、益精血、强筋骨、托疮毒”之功效[1],是滋补的上品,现代研究发现鹿茸中含有大量的粗蛋白,其在进入人体后被人体胃内和肠内的消化酶降解,进而生成氨基酸、多肽等功能物质[2],从而发挥其药效和保健作用,但是传统的鹿茸有效物质的提取方法多为水提法或醇提法,无法体现鹿茸在人体内的代谢过程,从而造成实验结果不理想[3]。近年来随着生物技术和代谢组学在中药有效物质中的应用,中药体内代谢研究已经成为中药药效物质研究的一个新的研究方向。基于此,本研究采用正交试验法对鹿茸体外胃内仿生提取进行了最优工艺优化,现将研究结果报道如下:
1 仪器与试药
1.1 仪器
DZF-6050真空干燥箱(上海一恒科技有限公司),FA1204B电子分析天平(上海精密科学仪器有限公司),ZRS-6G智能溶出实验仪(天津天大天发有限公司),飞鸽LXJ-IIB低速大容量离心机(上海安亭科学仪器厂),SpectrumLab752s紫外分光光度计(上海棱光技术有限公司),RE-52A旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 试药
甘氨酸对照品(中国药品生物制品检定所,批号:140689-201404),胃蛋白酶(中国惠世生化试剂有限公司,批号:120408),盐酸(北京化工厂,批号:20061019),茚三酮(上海三爱思试剂有限公司,批号130808),无水磷酸二氢钠(天津市光复精细化工研究所,批号:20101025),磷酸氢二钾(北京化工厂,批号:20111103),水为蒸馏水。
鹿茸,由吉林吉春药业有限公司提供,经长春中医药大学中药鉴定教研室主任姜大成教授鉴定为马鹿茸(Cervus elaplus Linnaeus)。
2 方法与结果
2.1 总氨基酸的含量测定
2.1.1 甘氨酸标准液的制备精密称取甘氨酸标准品4 mg,置于50 mL容量瓶中,加蒸馏水溶解并稀释至刻度,即得80μg/mL的标准品溶液储备液。
2.1.2 鹿茸仿生提取物溶液的制备精密称取鹿茸细粉(80目)5 g,依据各工艺条件下工艺参数进行提取,提取结束后,离心(4800 r/min),取上清液,将上清液置于旋转蒸发仪中,60℃减压回收至适量,并定容至50 mL,过滤,即制成生药量0.1 g/mL鹿茸仿生提取物溶液。
2.1.3 供试品溶液的制备取鹿茸仿生提取物溶液2.5 mL,置于25 mL的容量瓶中,补加水5.00 mL,再分别加入磷酸盐缓冲液和2%茚三酮各1 mL,摇匀。沸水浴加热15 min,迅速用冷水冷却至室温,加蒸馏水稀释至刻度,过滤,即得
2.1.4 对照品溶液的制备取甘氨酸标准品溶液2.5 mL置于25 mL的容量瓶中,补加水5.00 mL,再分别加入磷酸盐缓冲液和2%茚三酮各1 mL,摇匀。沸水浴加热15 min,迅速用冷水冷却至室温,加蒸馏水稀释至刻度,过滤,即得
2.1.5 测定方法取1.00 mL蒸馏水置于25 mL量瓶中,按“2.1.3”项下供试品溶液制备方法制成空白溶液。在570 nm波长处以空白溶液为参比,测定供试品及对照品溶液吸光度A值,采用对照品比较法计算其总氨基酸含量[4]。
2.1.6 精密度考察依次量取等量供试品溶液和对照品溶液,按“2.1.5”项下测定方法分别连续进行6次A值测定,结果供试品溶液吸光度的相对标准偏差(RSD)为0.12%,对照品峰面积的RSD为0.11%,均小于2%,说明仪器精密度良好。
2.1.7 稳定性考察按照供试品/对照品溶液制备方法制备溶液,分别于供试品/对照品溶液制备后的0、5、10、15、20、30、45、60、90、120 min,按“2.1.5”项下测定方法,依次取供试品溶液/对照品溶液适量,测定其A值,结果供试品溶液峰面积的RSD为1.13%,对照品溶液峰面积的RSD为1.02%,均小于2%,说明在120 min内供试品溶液和对照品溶液稳定性良好。
2.1.8 重复性考察按照“2.1.3”项下供试品溶液制备方法,分别制备6份供试品溶液,按照“2.1.5”项下测定方法,分别进行测定其A值,结果其RSD为2.46%,说明重复性良好。
2.1.9 线性关系考察分别吸取甘氨酸标准液1.50、2.00、2.50、3.00、3.50、4.00 mL置于25 mL的容量瓶中,按“2.1.4”项下对照品溶液制备方法依次制备不同浓度的对照品溶液,按“2.1.5”项下测定法分别测定其A值。分别以浓度(X)与吸光度(Y)为横纵坐标,制作标准曲线,线性方程为Y=0.0594X+0.005,r=0.9999,说明对照品溶液在4.8~11.2μg/mL浓度范围内,峰面积与浓度呈良好线性关系。
2.1.10 加样回收率试验依次精密量取供试品溶液1.0、1.2、1.5 mL,置于25 mL量瓶中,精密量取10μg/mL甘氨酸标准品溶液0.7、0.9、1.1 mL,置于量瓶中,按“2.1.3”项下供试品溶液制备方法制备不同浓度回收率供试品溶液,每个浓度各制备3份,共计9份供试品,按“2.1.5”项下测定方法分别测定其A值,结果溶液平均回收率为98.60%,RSD为2.99%,说明该方法准确性良好。
2.2 仿生提取工艺的初筛
鹿茸细粉粒度(A)、鹿茸细粉与提取介质的体积比(B)、提取时间(C)、提取次数(D)、提取温度(E)及转速(F)可能会对鹿茸水煎液仿生提取的效果产生一定的影响,因此使用L8(27)正交试验表对鹿茸提取工艺影响因素进行初步的筛选,因素水平见表1,正交试验结果见表2。

表1 鹿茸最优仿生提取工艺初步筛选因素水平表
由表2可知,因素B、因素C和因素D(即鹿茸细粉与提取介质体积比、提取时间、提取次数)对仿生提取实验结果的影响较小,故在进一步最优提取条件的筛选过程中,采用单因素分析对上述因素进行优化筛选;因素A、因素E和因素F(即鹿茸细粉粒度、提取温度和转速)对仿生提取的实验结果影响较为显著,故在进一步最优提取条件的筛选过程中,采用L9(34)正交试验表对上述因素进行进一步的优化筛选;同时初步确定仿生提取最优工艺为:A2B1C2D1E2F2,即鹿茸细粉粒度为100目,鹿茸细粉与提取介质体积比为1∶100,提取时间为2 h,提取次数为1次,提取温度为37℃,转速为75 r/min。
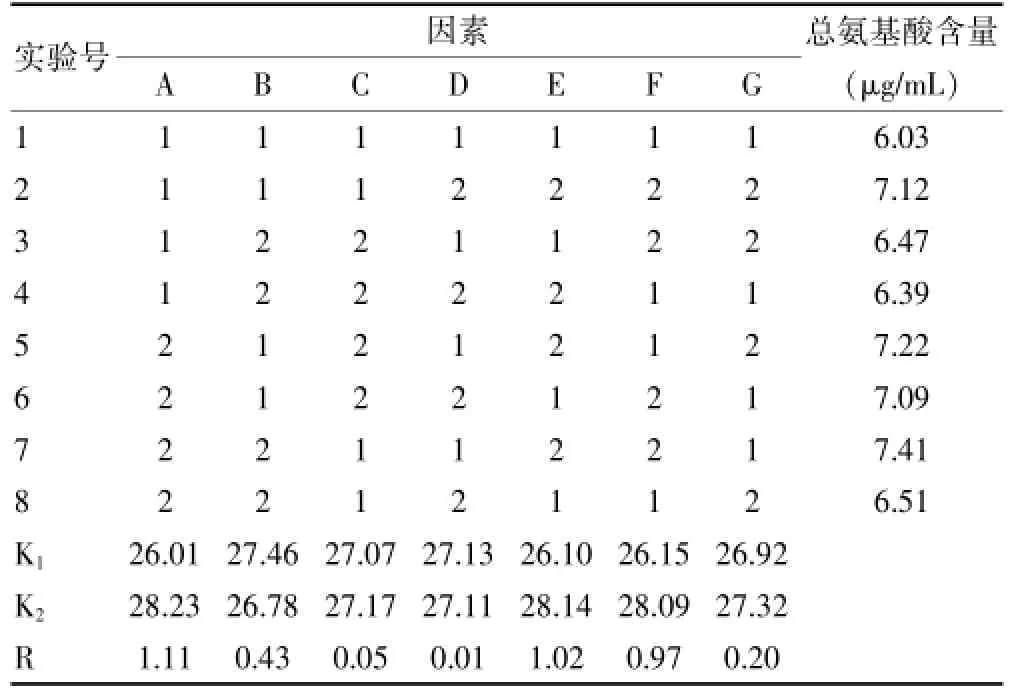
表2 正交试验结果综合评价直观分析结果
2.3 仿生提取工艺的优化
2.3.1 鹿茸细粉与提取介质体积比的筛选依次取100目鹿茸细粉3份,每份2 g,分别加入50、100、200 mL的提取介质,按“2.2”项下仿生提取初步最优工艺A2C2D1E2F2依次进行仿生提取处理,以氨基酸总量作为指标,采用单因素分析进行最优鹿茸细粉与提取介质体积比的筛选。最优鹿茸细粉与提取介质体积比筛选结果见表3。

表3 最优鹿茸细粉与提取介质体积比单因素分析结果
分析表3结果可知,鹿茸细粉与提取介质体积比为1∶50及1∶100,其氨基酸含量明显高于1∶25,且1∶50与1∶100所得产物中的氨基酸含量无显著差异,故从实际实验效率角度考虑,故选择1∶50作为鹿茸仿生提取最优鹿茸细粉与提取介质体积比。
2.3.2 提取时间的筛选依次取100目鹿茸细粉3份,每份2 g,分别依次加入100 mL的提取介质,按“2.2”项下仿生提取初步最优工艺A2B1D1E2F2依次进行1.0、1.5、2.0 h的仿生提取处理,以氨基酸含量作为指标,采用单因素分析进行最优仿生提取时间的筛选。最优仿生提取时间的筛选的结果见表4。

表4 最优仿生提取时间单因素分析结果
分析表4结果可知,1.0、1.5、2.0 h鹿茸仿生提取物的氨基酸含量无明显差异,从实验效率角度进行考虑,选择1.0 h作为最优仿生提取时间。
2.3.3 提取次数的筛选依次取100目鹿茸细粉3份,每份2 g,分别依次加入100 mL的提取介质,按“2.2”项下仿生提取初步最优工艺A2B1C2E2F2进行仿生提取,依次提取1、2、3次,以氨基酸含量作为指标,采用单因素分析进行最优提取次数。最优提取次数筛选的结果见表5。

表5 最优提取次数单因素分析结果
分析表5结果可知,3组仿生提取产物氨基酸含量无明显差异,故从实验效率角度考虑,选择1次作为鹿茸仿生提取最优提取次数。
2.3.4 最优鹿茸细粉粒度、提取温度和转速的筛选依次按照L9(34)正交试验表中工艺参数进行仿生提取,以总氨基酸含量作为指标,因素水平见表6,直观分析见表7,方差分析见表8。
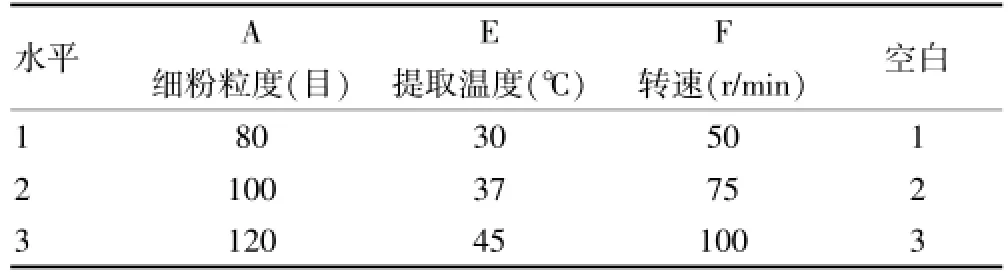
表6 L9(34)正交试验因素水平表
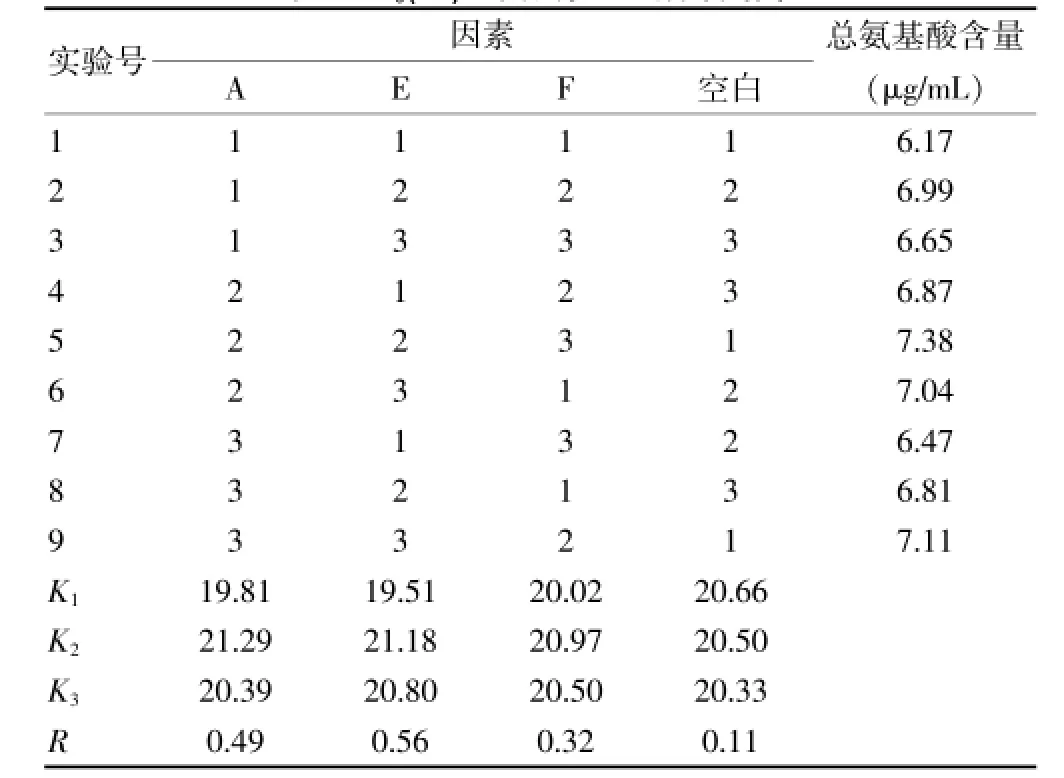
表7 L9(34)正交试验直观分析结果
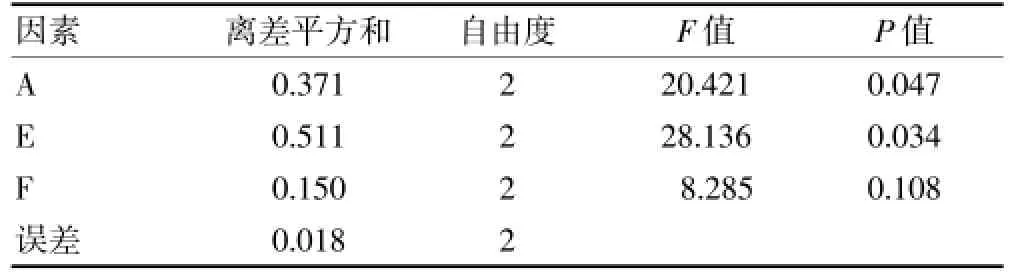
表8 正交试验结果综合评价的方差分析
由方差分析结果可知,因素A(鹿茸细粉粒度)和因素E(温度)对提取物的氨基酸含量具有显著影响(P<0.05),因素F(转速)对提取物的氨基酸含量无显著影响,结合直观分析结果,得出最优提取工艺为A2E2F1,即鹿茸细粉100目,提取温度为37℃,转速为50 r/min。
2.4 验证性实验
为检验实验结果的可靠性,采用上述工艺参数进行鹿茸仿生提取实验进行3次平行实验,3批验证实验总氨基酸含量均值为7.43μg/mL,RSD=2.17%,说明工艺稳定、可靠。
2.5 结果
最优鹿茸仿生提取工艺为:鹿茸细粉粒度为100目,鹿茸细粉与提取介质体积比为1∶50,在37℃温度下,转速50 r/min,提取1 h,提取1次,且工艺稳定、可靠。
3 讨论
随着现代人们健康意识的加强,功能保健产品的市场份额越来越大,中药作为我国传统药物,在我国有着2000多年的用药历史,同时也证明了中药疗效的确切,近些年来以传统中药为基础,开发功能保健产品已成为中药开发的另一个方向,一些名贵的中药材如人参、冬虫夏草等均已开发出多种保健食品[5]。鹿茸作为我国传统的名贵中药,现代研究发现,鹿茸中含有丰富的粗蛋白[6],这些粗蛋白进入人体之后,会被消化酶降解生成多肽和氨基酸,具有良好的调节机体免疫力作用[7],目前也是中药保健食品的开发焦点药物之一,虽然市场上有一些鹿茸的保健食品,但是其有效物质提取方法基本上都是沿用传统的水提法或醇提法[8],忽视了鹿茸在人体内的代谢过程,因而其功能保健作用并不是十分理想。随着代谢组学和生物技术等新兴学科的应用,体内代谢研究已成为药物研究的必然方向。基于“还原论”的思维体系,为了进一步的模拟中药在人体内的代谢转化过程,建立了中药仿生提取理论,即以中药粗提物或部位作为底物,添加至一定量的仿生溶媒(人工胃液、肠液)体系中,在温和的条件下,动态地进行培养,使水煎液中的化学成分与仿生溶媒中的生物酶进行相互作用,从而模拟中药水煎液在人体内的转化、吸收过程[9]。鉴于鹿茸中粗蛋白成分较多,且进入人体后将被分解生成氨基酸,本次实验研究以总氨基酸含量作为含量测定指标。
正交试验设计和单因素分析方法已在中药有效物质提取工艺优化中应用多年[10-11],其可有效提高实验效率,传统的工艺优化多在单因素分析的基础上开展正交试验设计[12],其多建立在传统提取工艺的基础上,从而人为地将非关键因素进行单因素分析、关键因素进行正交试验设计,存在一定的主观性[13-14]。本次实验研究所建立的鹿茸体外胃内仿生提取工艺为一种新型的提取工艺,无传统提取工艺基础,因此本次实验针对提取过程中的工艺参数先采用L8(27)正交试验对工艺参数进行初筛,通过统计分析,对整体工艺有较大影响因素的参数进一步进行正交试验设计,无明显影响的因素进行单因素分析,从而有效提高了整体工艺设计的科学性和客观性,避免了人为经验对实验结果造成的影响;同时使用智能溶出仪模拟人体胃环境,采用人工胃液作为提取溶液,模拟人体胃环境温度,有效模拟了鹿茸在在人体内的代谢过程,并基于此获得了鹿茸最优仿生提取工艺,为鹿茸体外代谢研究和相关功能保健食品的开发奠定了实验基础。
中药仿生提取研究基于人体代谢模型,通过使用人工消化液对中药进行提取,相当于药物在体外进行“预消化”处理,可能提高中药的生物利用度,改善中药生物利用度低下的弊端[15];同时通过人体消化液与中药中有效成分发生化学作用,可以丰富有效物质化合物结构库,为中药有效物质的筛选提供帮助。虽然目前中药放生提取仍处于起始阶段,但是随着相关学科的发展,中药仿生提取将成为中药药效物质研究的一种新方法,为中药有效物质的开发及应用作出巨大贡献。
[1]胡朝奇,陈新,徐会丹.基于仿生提取理论的鹿茸氨基酸成分研究[J].上海中医药杂志,2013,47(10):78-81.
[2]Huang M,Jin J,Sun H,et al.Reversal of P-glycoproteinmediated multidrug resistance of cancer cells by five schizandrins isolated from the Chinese herb Fructus Schizandrae[J].Cancer Chemother Pharmacol,2008,62(6):1015.
[3]杨秀伟.基于体内过程的中药有效成分和有效效应物质的发现策略[J].中国中药杂志,2007,32(5):365-370.
[4]汪树理,孙继红,王艳梅.带血与排血梅花鹿茸骨片游离氨基酸含量的比较分析[J].氨基酸和生物资源,2009,31(3):62-63.
[5]肖立宁,陈剑伟,高朝辉,等.氨基酸维生素制剂的抗疲劳作用研究[J].解放军医学杂志,2012,37(1):23-25.
[6]赵磊,李继海,朱大洲,等.5种鹿茸营养成分的主成分分析[J].光谱学与光谱分析,2010,30(9):2571-2575.
[7]齐艳萍.鹿茸对小鼠肿瘤及免疫功能的影响[J].黑龙江八一农垦大学学报,2012,24(1):55-57.
[8]陈新,胡朝奇,张洪长,等.仿生化提取人参皂苷类成分的初步研究[J].中国药房,2012,23(19):1752-1754.
[9]胡朝奇,陈新,徐会丹.正交试验优选五味子体外胃内仿生转化工艺[J].中国实验方剂学杂志,2013,19(21):33-36.
[10]刘方艺,谢友良,蒋东旭,等.正交设计法优化经络贴巴布剂基质配方研究[J].中国医药导报,2011,8(10):68-70.
[11]吕子明,于向红,刘晓燕,等.正交试验法优选甘草浸膏的喷雾干燥工艺[J].中国医药导报,2013,10(5):109-111.
[12]李跃辉,凌艳君,朱沛,等.正交试验优选鼻敏宁颗粒提取工艺[J].中国医药导报,2014,11(2):114-116.
[13]郭亚群.正交试验法优化黄芪免疫增强颗粒剂的提取工艺[J].浙江中医药大学学报,2011,35(3):55-56.
[14]孙学惠,陈宇峰,吴琼,等.正交试验优选黄芪桂枝五物汤提取工艺研究[J].山西医药杂志,2013,42(5):486-488.
[15]胡朝奇,陈新,徐会丹.鹿茸氨基酸口服液基础配方开发[J].中国实验方剂学杂志,2013,19(14):70-73.
Optimization of processing technology for Cornu Cervi Pantotrichum stomach bionic extraction in vitro by orthogonal test
XUGang1HUChaoqi1BAIJun2CHENXin2
1.Wuhu Simcere Sino-implant Pharmaceutical Co.Ltd.,Anhui Province,Wuhu 241080,China;2.School of Pharmacy, Changchun University of Traditional Chinese Medicine,Jilin Province,Changchun 130117,China
ObjectiveTo develop the optimum process of Cornu Cervi Pantotrichum stomach bionic extraction in vitro.MethodsCornu Cervi Pantotrichum powder particle size,volume ratio of Cornu Cervi Pantotrichum powder with extraction medium,extraction temperature,speed,extraction time,frequency were used as factors,and the total content of amino acid in Cornu Cervi Pantotrichum was used as index.The orthogonal test and single factor analysis methods to develop the optimum process of Cornu Cervi Pantotrichum stomach bionic extraction was used in vitro.ResultsThe optimum process:Cornu Cervi Pantotrichum powder particle size was 100 mesh,volume ratio of Cornu Cervi Pantotrichum powder with extraction medium was 1∶50,temperature was 37℃,speed was 50 r/min,extraction time was 1 h,frequency was 1.ConclusionThe optimum process of Cornu Cervi Pantotrichum stomach bionic extraction in vitro is stable and reliable.It realizes the metabolism process for Cornu Cervi Pantotrichum in human gastric juice preliminarily and does important significance for the development and application of effective substance in Cornu Cervi Pantotrichum.
Cornu Cervi Pantotrichum;Stomach;Bionic extraction;Process optimization
R284
A
1673-7210(2015)04(c)-0021-05
2015-01-17本文编辑:卫轲)
吉林省中医药管理局项目中医药科技项目(编号2010-pt011)。
徐刚(1971.10-),男,硕士研究生,芜湖先声中人药业有限公司总经理、技术中心主任;研究方向:药物制剂和质量标准研究。
陈新(1965.5-),女,教授,长春中医药大学中药化学教研室主任;研究方向:中药药效物质基础开发与利用。
