PEG 修饰青蒿素脂质纳米粒的体外释放及抗巨噬细胞摄取特性
2015-01-10栾淑伟程慧芳王锐利梁桂贤张淑秋
栾淑伟,赵 青,程慧芳,王锐利,梁桂贤,张淑秋
山西医科大学药学院,太原 030001
青蒿素(artemisinin,ART)是从植物黄花蒿中提取分离得到的具有内过氧桥结构的倍半萜内酯类化合物[1],为目前治疗疟疾的一线药物。该类药物因其特殊的化学结构,可减少血液中传播疟疾的疟原虫配子体,主要作用于膜系结构,干扰了疟原虫的表膜-线粒体功能,阻断了宿主红细胞浆对疟原虫的营养供给,具有良好的临床效果。青蒿素在水中几乎不溶,现有的制剂主要有油针、片剂、栓剂等。本课题组将其制成青蒿素脂质纳米粒(artemisinin nanostructured lipid carrier,ART-NLC),制成冻干粉稳定性好,静脉注射给药后血药浓度平稳。
纳米结构脂质载体(NLC)静脉注射给药存在一些问题:可被单核巨噬细胞(mononuclear phagocyte macrophage,MPM)吞噬,体内循环时间短,限制了其靶向给药。为了克服上述问题,充分利用NLC 的载药优势,对其表面修饰成为近年来研究NLC 的热点[2]。其中用聚乙二醇(polyethyleneglycol,PEG)或其衍生物对NLC 进行表面修饰的研究日益活跃,并将有良好的前景。由于PEG 分子的亲水性和柔顺性,PEG 修饰后NLC 将较少受到调理素的调理,进而减少其被MPM 识别吞噬的机会,体内循环时间延长,称为长循环纳米结构脂质载体(PEGNLC)[3]。PEG-NLC 具有长循环特性,再借助NLC控释作用,可以延长载药粒子在血液循环滞留时间,从而增强药物在血液循环系统中的被动靶向性和疗效[4]。
由于PEG-NLC 的表面特性等理化性质是影响其体内命运的关键因素[5]。本研究在本实验室先前工作的基础上,构建3 种不同聚合度的聚乙二醇硬脂酸酯(PEGn-SA,n=25、40、55)表面修饰的青蒿素脂质纳米粒(PEGn-ART-NLC),探讨PEGn-ART-NLC 的体外释放及巨噬细胞(J774)摄取特性,为静脉注射PEG-NLC 长循环给药系统提供理论和实验依据。
1 材料与方法
1.1 药品和试剂
青蒿素原料药(ART,重庆华立武陵山制药有限公司,纯度99.0%~101.0%,批号C00120130510);青蒿素标准品(中国食品药品检定研究所,批号20100609);中链甘油酸三酯(MCT,德国萨索尔);单硬脂酸甘油酯(GMS,天津市光复精细化工研究所,批号20130326);PEGn-硬脂酸酯(n=25、40、55)(梯希爱化成工业发展有限公司);聚氧乙烯氢化蓖麻油(RH40,上海运宏化工制剂辅料有限公司);泊洛沙姆188 (F68,德国巴斯夫);纯化水(Heal Force);巨噬细胞细胞株(J774,中科院上海细胞库);DMEM 培养基(Dulbecco’s modified Eagle’s medium)、胎牛血清(fetal bovine serum)购自Gibco公司;乙腈、甲醇(色谱纯,山东禹王试剂有限公司,批号2013061005);其他试剂均为分析纯。
1.2 仪器
高效液相色谱仪(美国Agilent 1200);马尔文粒度仪(Malvern,1079008);高压乳匀机(APV-2000);高速分散均质机(上海标本模型厂,FJ-200);台式离心机(上海安亭科学仪器厂,TDL-5-A);HY-2 调速多用振荡器(江苏中大仪器厂);FA1104N 电子天平(上海民桥精密科学仪器有限公司);85-2 数显恒温磁力搅拌器(荣华仪器制造有限公司)。
1.3 方法
1.3.1 ART-NLC 的制备
PEGn-ART-NLC 和ART-NLC 的处方见表1,处方筛选及工艺优化工作将另文报道。制备方法均采用高压乳匀法。
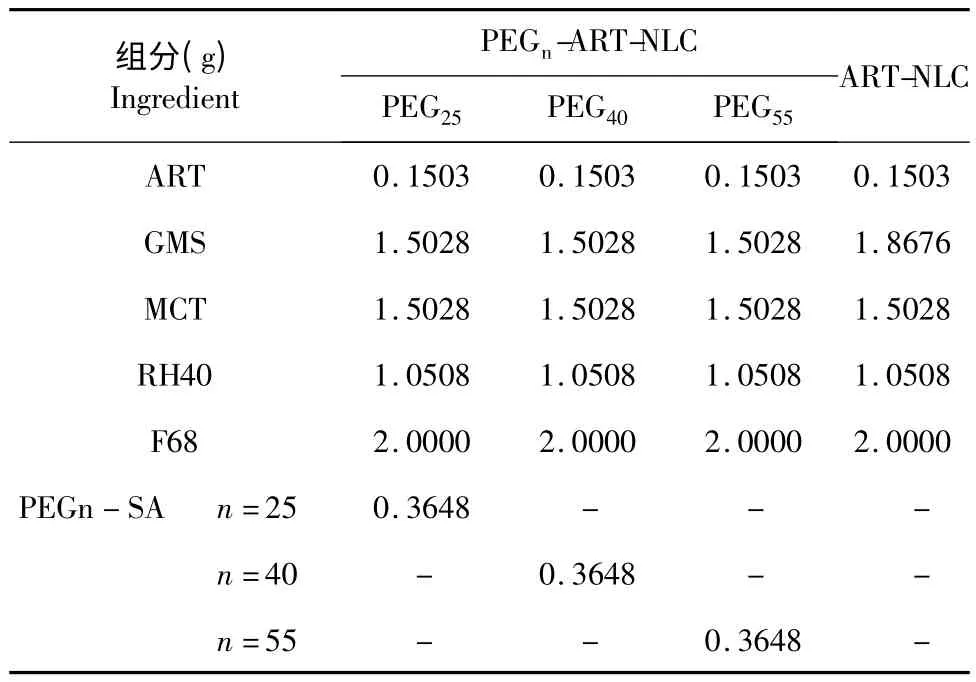
表1 PEGn-ART-NLC(n=25、40、55)及ART-NLC 处方组成Table 1 Formulations of ART long-circulating nanostructured lipid carriers (PEGn-ART-NLC,n=25,40,55)and ART nanostructured lipid carrier (ART-NLC)
1.3.2 ART 体外含量测定
采用本实验室已建立的HPLC-柱后衍生化-UV检测方法[6]测定ART 含量。青蒿素分子结构内无共轭基团,仅在紫外区203 nm 处有较弱的末端吸收。与碱反应后,分子内的过氧桥结构被破坏,重排形成共轭结构,产物在289 nm 处有最大吸收。由于反应有碱存在,损坏色谱柱,不宜直接进样,因此选用柱后衍生化法进行测定。
色谱条件如下:色谱柱:C18液相色谱柱(5 μm,150 mm×4.6 mm);流动相:乙腈-0.1 mol/L 醋酸盐缓冲盐(77∶23);流速:流动相0.7 mL/min,柱后衍生试剂(1 mol/L KOH 90%乙醇溶液)0.2 mL/min;柱温:30 ℃;柱后反应温度:70 ℃;进样量:20 μL;检测波长:289 nm。
1.3.3 体外释放实验
1.3.3.1 释放介质的选择
为研究ART-NLCs 体外释放规律,经试验选用pH 7.4 磷酸盐缓冲液(PBS)作释放介质。
1.3.3.2 ART-NLCs 体外释放
分别精密量取各ART-NLCs 溶液1 mL,置于预先处理好的透析袋(截留相对分子质量1~1.2 万)中,平行操作3 份,扎紧袋口后,完全放入装有200 mL pH 7.4 PBS 溶液的磨口三角锥瓶中,封口,于(37 ±0.5)℃,100 rpm 恒温振荡。在设定的不同时间点1、2、3、4、6、8、12、24、36、48 h 分别取样2 mL,同时补加(37 ±0.5)℃空白释放介质2 mL。48 h后,将透析袋取出剪开,转移到10 mL 容量瓶中,加入5 mL 乙腈,超声5 min 使NLC 完全破乳,乙腈定容。以该溶液作为时间无穷大时刻的样品。0.45 μm 微孔滤膜过滤样品,取续滤液20 μL,按“1.3.2”项HPLC-柱后衍生化-UV 检测方法测定药物浓度。
1.3.3.3 考察透析袋对释放的影响
用乙腈配制1.5 mg/mL ART 溶液,精密量取该溶液1 mL,置于预先处理好的透析袋(截留相对分子质量1~1.2 万)中,按“1.3.3.2”项下操作进行。
1.3.3.4 考察血浆对释放的影响
另精密量取各ART-NLCs 溶液1 mL,置于预先处理好的透析袋(截留相对分子质量1~1.2 万)中,随即加入0.5 mL 人血浆,混合均匀,按“1.3.3.2”项下操作进行。
1.3.3.5 体外释放计算公式
按公式F(%)=mi/mo×100%(1)计算累计释放量。其中F 为累计释放量,mi为每个时间点的累计药物含量,mo为ART-NLCs 中药物的含量。
1.3.4 J774 细胞体外摄取实验[7]
1.3.4.1 J774 细胞混悬液的制备
用含10%胎牛血清(FBS)DMEM 吹打混悬细胞,稀释至细胞数1 ×105/mL。
1.3.4.2 PEGn-SA 聚合度对J774 细胞体外摄取的影响
于离心管中分别加入J774 细胞悬液1 mL 和样品0.5 mL(PEGn-ART-NLC 或ART-NLC)(n=5),以0.5 mL 双蒸水作为对照组,于(37 ±0.5)℃水浴中50 rpm 振摇30 min,取出后在冰浴中终止吞噬,离心(1000 rpm,5 min),弃去上清液。用pH 7.0 的PBS 分次洗涤,离心,弃去上清后得J774 细胞样品。
取离心分离后得到的J774 细胞样品,依次加入乙腈400 μL,超声粉碎(超声时间1 s,间隔1 s,超声30 次),3500 rpm 离心15 min,0.45 μm 微孔滤膜过滤样品上清液,取续滤液20 μL,按“1.3.2”项HPLC-柱后衍生化-UV 检测方法测定药物浓度。上式中Wt为加入药物的总量,WU为J774 细胞摄取的药物量。
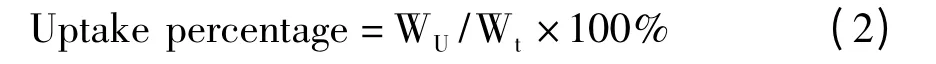
1.3.4.3 蛋白吸附对J774 细胞体外摄取的影响
另取J774 细胞悬液1 mL,样品0.5 mL (PEGn-ART-NLC 或ART-NLC)及血浆0.5 mL,按“1.3.4.2”项下操作进行。
1.3.4.4 孵育时间对J774 细胞体外摄取的影响
在(37 ±0.5)℃分别孵育0.5、1、2 h,按“1.3.4.2”项下操作进行。
1.3.5 估算水化层的厚度[7]
NLC 表面覆有柔顺的PEG 长链,亲水性的PEG链上具有很多亲水位点,可吸附大量水分形成一层水分子的空间位阻,称为固定水化层[8]。利用Gouy-Chapmann 扩散双电层模型,估算固定水化层厚度(Fixed aqueous layer thichness,FALT),公式如下:
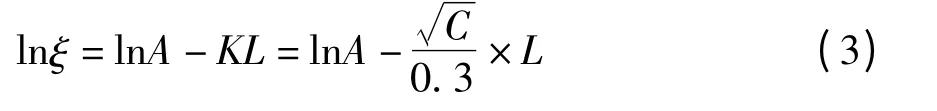
其中,ξ 为Zeta 电位的绝对值,A 为常数,K 为Debye-Hückel 参数,等于,C 为电解质的浓度,L为FALT/nm。
以0、0.01、0.05、0.1 mol/L 的NaCl 电解质溶液将ART-NLC、PEG25-ART-NLC、PEG40-ART-NLC和PEG55-ART-NLC 稀释,测得Zeta 电位,代入公式3 求算L。
2 结果与讨论
2.1 ART 体外含量测定
ART 在2~20 μg/mL 浓度范围内线性关系良好,标准曲线为A=63.468x+9.7071,r=0.9999。
ART 高、中、低3个浓度(18、10、5 μg/mL)的平均回收率分别为99.6%、99.4%、99.3%(n=3)。日内精密度(RSD)0.32%、1.17%和1.70%(n=5),日间RSD 0.67%、1.45%和1.82%(n=3)。
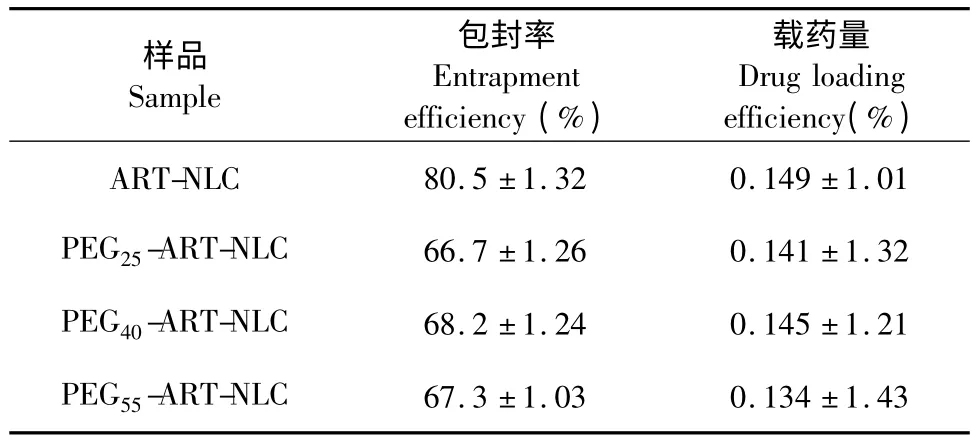
表2 ART-NLCs 的包封率及载药量(n=3)Table 2 Entrapment rate and drug-loading rate of ART-NLCs (n=3)
ART-NLCs 的包封率及载药量见表2。
2.2 体外释放实验
2.2.1 考察透析袋对释放的影响
ART 溶液在4 h 内基本完全透过透析袋,并测得药物溶液体外释放透析袋回收率,为(99.8 ±0.90)%,结果表明,透析袋对ART 脂质纳米粒的释放无限速作用。
2.2.2 PEGn-SA 聚合度对体外释放的影响
按“1.3.1”项下处方,考察PEGn-SA 的加入量不变,PEG 聚合度n 分别为25、40、55 时,PEG25-ART-NLC、PEG40-ART-NLC、PEG55-ART-NLC、ARTNLC 及青蒿素溶液的体外释放曲线,结果见图1(A)。加入血浆后以上各制剂的体外释放曲线,结果见图1(B)。
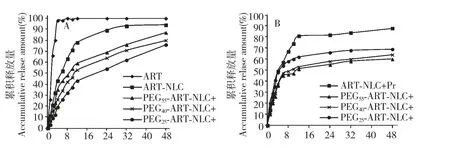
图1 青蒿素体外释放曲线:(A)PEGn-ART-NLC(n=25、40、55)、ART-NLC 和青蒿素溶液在PBS 中的释放曲线;(B)PEGn-ART-NLC(n=25、40、55)和ART-NLC 在加入人血浆的PBS 中的释放曲线(n=3)Fig.1 In vitro release profiles of ART:(A)Release profiles of ART from PEGn-ART-NLC (n=25,40,55),ART-NLC and ART solution in PBS;(B)Release profiles of ART from PEGn-ART-NLC (n=25,40,55)and ART-NLC in PBS with human plasma (n=3)
由图1 中A、B 可见,随PEGn-SA 聚合度增大,PEGn-ART-NLC(n=0、25、40、55)体外释放增加,48 h 内分别释放了94%、76%、80%、87%。加入人血浆后,ART-NLC、PEGn-ART-NLC 均比在未加入血浆的PBS 中释放加快;但随PEGn-SA 聚合度增大,PEGn-ART-NLC(n=0、25、40、55)体外释放减少,48 h 内分别释放了88%、69%、64%、60%。
采用透析与血浆透析两种方法研究ART-NLCs体外释放,结果表明不加血浆PEGn-ART-NLC(n=25、40、55)三种制剂释放度随PEGn-SA 聚合度的增大而增加,其原因可能是NLC 表面的PEGn-SA 聚合度越大,亲水性越强,使得药物与NLC 胶体溶液扩散层的亲和力增大,更易于释放。血浆的加入使得ART-NLC、PEGn-ART-NLC(n=25、40、55)四种制剂释放速度均明显加快,其主要机理可能是由于血浆中多种蛋白成分迅速吸附于NLC 表面,发生相互作用,影响了脂质的膜稳定性,导致药物通透性有所增加;血浆中其他成分如酶也可能促进药物从NLC中的释放速度。但PEGn-ART-NLC 与血浆混合释放度降低的原因可能是PEGn-SA 插嵌到NLC 的表面,形成一层厚厚的“云层”,避免了纳米粒之间的聚集,并阻止其他聚合物与之发生相互作用,使PEGn-ART-NLC 膜更加稳定,从而使药物不易被释放出来[9]。
2.3 J774 细胞体外摄取实验
与ART-NLC 相比,J774 细胞对PEGn-ART-NLC的摄取量明显减小(P<0.01),并受PEGn-SA 聚合度的影响,PEGn-SA 含量一定时,PEGn-ART-NLC 与J774 细胞37 ℃孵育分别0.5、1、2 h 后,J774 细胞对PEGn-ART-NLC 的摄取量均随PEGn-SA 聚合度增大而降低。其中J774 细胞对PEG55-ART-NLC 的摄取量明显小于PEG40-ART-NLC 和PEG25-ART-NLC(P<0.01)。
J774 细胞对PEGn-ART-NLC 和ART-NLC 的体外摄取作用受孵育时间的影响,摄取量随孵育时间的延长而增大。分别在1 h 和2 h 后出现显著性差异(P<0.01)。
J774 细胞对ART-NLCs 体外细胞摄取作用受蛋白吸附的影响,与不加血浆相比,加入血浆后各试管中J774 细胞对ART-NLCs 的摄取量均明显增大(P<0.01),其中J774 细胞对PEG25-ART-NLC 的摄取量要明显大于PEG40-ART-NLC 和PEG55-ART-NLC(P<0.01)。J774 细胞与ART-NLCs 孵育不同时间后,各时间点可见,与不加血浆相比,加入血浆后各试管中J774 细胞对PEGn-ART-NLC 和ART-NLC 的摄取量均明显增大(P<0.01)。
J774 细胞对PEGn-ART-NLC 和ART-NLC 的摄取结果见表3,图2。
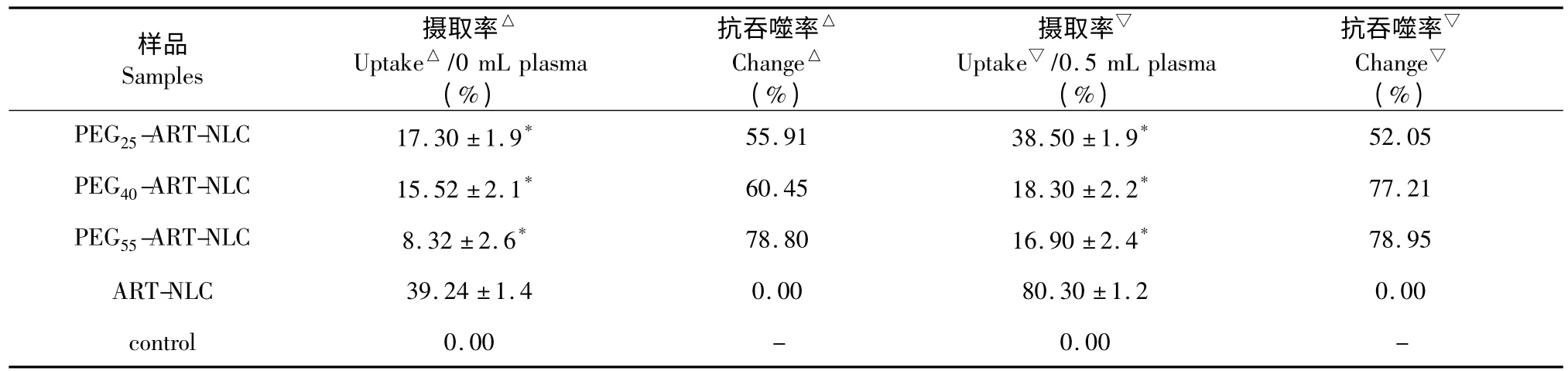
表3 ART-NLCs 与J774 细胞37 ℃孵育0.5 h 后摄取量的比较(n=5)Table 3 In vitro uptake of ART-NLC and PEGn-ART-NLC by J774 at 37 ℃(n=5)
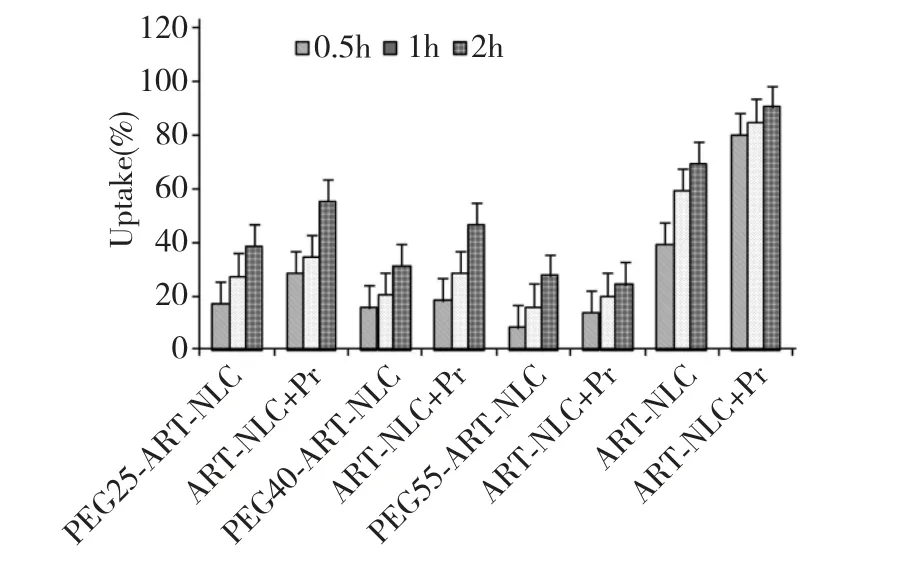
图2 37 ℃J774 细胞与ART-NLCs 分别孵育0.5、1、2 h后的摄取量(n=5)Fig.2 Uptake of ART-NLCs by J774 after incubation at 37℃for 0.5,1 and 2 h (n=5)
体外巨噬细胞摄取实验是体外评价PEG-NLC长循环能力的常用方法[3]。
机体MPS 系统识别异物的机制为[9]:当异物进入体内后多种蛋白成分迅速吸附于纳米粒表面。若增加纳米粒的表面亲水性,就可减少调理素(蛋白质)的吸附,因此PEG 的亲水性柔韧长链及其高密度覆盖层是减小蛋白吸附的必要条件。
J774 细胞对PEGn-ART-NLC 与ART-NLC 的摄取量相比,PEGn-SA 表面修饰的NLC 表现出显著的抗吞噬性,可能是用PEGn-SA 对ART-NLC 进行表面修饰后,PEG 长链的柔韧性使PEGn-ART-NLC 的空间结构时刻发生变化而使J774 细胞难以对其产生有效的识别,从而使J774 细胞对PEGn-ART-NLC的摄取减少。一般而言,PEG 长链的长度越长,其柔韧性越好,其抵抗细胞摄取的作用越强,本实验可见随PEGn-SA(n=25、40、55)聚合度增大,J774 细胞对PEGn-ART-NLC 的摄取量增加。高哲等[10]的研究获得了同样的结果,可能与PEGn-ART-NLC 具有较厚的表面固定水化层和较高的PEG 链密度和较强的干扰蛋白吸附到脂质纳米粒表面的能力有关[7]。
2.4 固定水化层厚度的估算
以0、0.01、0.05、0.1 mol/L 的NaCl 电解质溶液稀释PEG25-ART-NLC、PEG40-ART-NLC 和PEG55-ART-NLC,测得Zeta 电位结果见表4。根据公式3将lnξ 对进行线性回归,见图3,其斜率即为L。ART-NLC、PEG25-ART-NLC、PEG40-ART-NLC 和PEG55-ART-NLC 的固定水化层厚度L 分别为0.31、1.76、1.86 和2.04 nm。
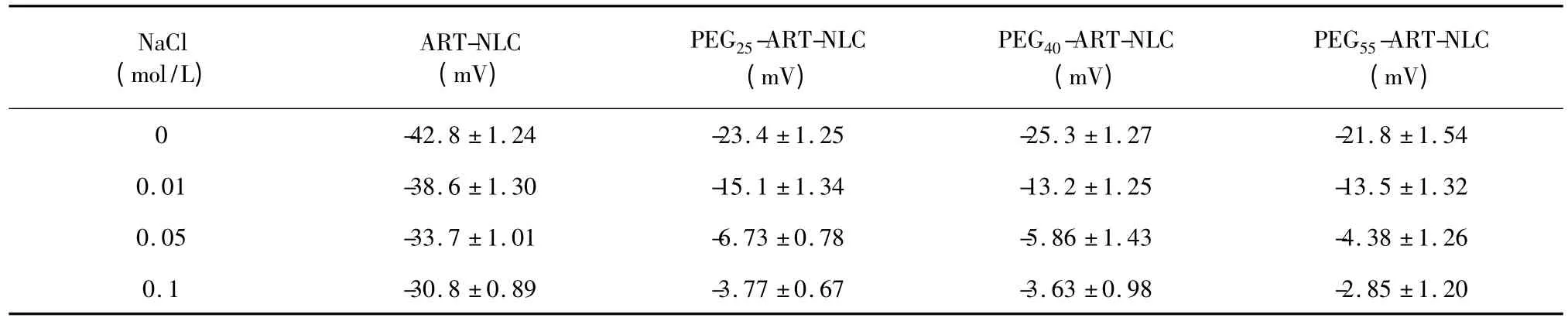
表4 ART-NLCs 在不同NaCl 浓度下的Zeta 电位Table 4 Zeta potential of ART-NLCs in different concentrations of NaCl
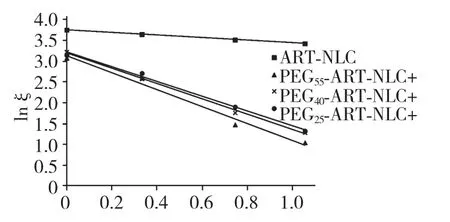
图3 lnξ 对的线性回归Fig.3 Regression of lnξto
L 是影响PEG 表面修饰长循环给药系统的重要表面性质,增加L 可显著延长粒子的体内循环时间。PEGn-SA 含量相同时,随着PEGn-SA 聚合度的增加,PEGn-ART-NLC Zeta 电位(绝对值)减小,L增大,体外J774 细胞摄取减少。可见PEGn-SA 对ART-NLC 的修饰作用,与PEGn-SA 在ART-NLC 表面的空间结构密切相关。
根据Needham 的模型[11],L 可体现PEG 链在纳米粒表面的长度;Needham 认为,PEG 可在纳米粒表面形成“线型”或“蘑菇”样的构型,在线性构型中,PEG 链是舒展的,理论上聚合度为40 的PEG 线型构型的链长为16.7 nm,而实际上,PEG 链在纳米粒表面往往以弯曲、折叠、压缩的形式存在,即“蘑菇”样构型,PEG25-ART-NLC、PEG40-ART-NLC 和PEG55-ART-NLC 形成的固定水化层分别仅有1.76 nm、1.86 nm 和2.04 nm;“蘑菇”样构型对PEGn-ART-NLC 有两方面的影响:其一,PEG 链减少了其摆动的可能性,也就是说PEG 链的柔韧性下降;其二,表观上增加了单位PEG 链对纳米粒表面的覆盖面积,从而一定程度上增加了保护作用[12]。
本研究为构建PEGn-SA 表面修饰的NLC 长循环给药系统提供了理论和实验依据,下一步本文拟进行不同PEGn-ART-NLC 体内动力学的比较性研究,证明PEG 表面修饰青蒿素脂质纳米粒具有长循环作用,将另文报道。
1 Liu JM(刘静明),Ni MY(倪慕云),Fan JF(樊菊芬),et al.The structure and reaction of Qinghaosu.Acta Chem Sin(化学学报),1979,37:129-141.
2 Zhang XX,Pan WS,Gan L,et al.Preparation of a dispersible PEGylate nanostructured lipid carriers(NLC)loaded with 10-hydroxycamptothecin by spray-drying.Chem Pharm Bull,2008,56:1645-1650.
3 Yu L(于莲),Cui D(崔丹),Ying XY(应晓英),et al.Research progress in drug delivery of surface modified lipid nanoparticles.Chin J Mod Appl Pharm(中国现代应用药学),2011,28:108-112.
4 Soppimath KS,Aminabhavi TM,Kulkarni AR,et al.Biodegradable polymeric nanoparticles as drug delivery devices.J Control Release,2001,70(122):1-20.
5 Bures P,Huang Y,Oral E,et al.Surface modifications of molecular imprinting of polymers in medical and pharmaceutical applications.J Control Release,2001,72(123):25-33.
6 Gao WQ(高伟褀),Luan SW(栾淑伟),Wang RL(王锐利),et al.Determination of equilibrium solubility and apparent octanol/water partition coefficient of artemisinin in different solvents.Drug Eval Res(药物评价研究),2013,36:35-38.
7 Fang C(方超),Shi B(施斌),Hong MH(洪鸣凰),et al.Influence of particle size and MePEG molecular weight on in vitro macrophage uptake and in vivo long circulating of stealth nanoparticles in rats.Acta Pharm Sin(药学学报),2006,41:305-312.
8 Sadzuka Y,Nakade A,Hirama R,et al.Effects of mixed polyethyleneglycol modification on fixed aqueous layer thickness and antitumor activity of doxorubicin containing liposome.Int J Pharm,2002,238:171-180.
9 Xiong YX(熊迎新),Yin ZN(尹宗宁).Effect of surface modification on target-oriented drug delivery systems.Chin New Drug J (中国新药杂志),2004,13:1275-1279.
10 Gao Z(高哲),Chen J(陈建).The inference of PEG modified solid lipid nanoparticles on biotransport in gastrointestinal tract and elimination in vivo.J Tongji Univ (同济大学学报,医学版),2011,32:35-39.
11 Needham D,Stoicheva N,Zhelev DV.Exchange of monooleoyl phosphtidy-choline as monomer and micelle with membranes containing poly(ethylene glycol)-lipid.Biophys J,1997,73:2615-2629.
12 Zhang XX(张馨欣),Pan WS(潘卫三),Gan Y(甘勇),et al.In vitro and in vivo study of long-circulating nanostructrued lipid carries containing hydroxycamptothecin//The Sixth Pharmaceutical Association Annual (第六届中国药学会学术年会论文集).Guangzhou,2006.1926-1938.
