泻根醇酸对NMDA 诱导的PC12 细胞损伤的保护作用研究
2015-01-10张胜男张玉琴陈立典褚克丹阙金花
张胜男,李 煌,张玉琴,徐 伟,陈立典,黄 枚,褚克丹,阙金花
福建中医药大学药学院,福州 450122
脑缺血目前已成为世界范围内的主要致残、致死因素[1]。并且随着年龄的增长发病率逐渐升高。然而,缺血性中风的发病机制较为复杂,兴奋性毒性、钙超载、氧化应激、凋亡、炎症反应等[2-5]。文献报道,脑缺血损伤与细胞外钙离子大量内流有关[6],钙超载被认为是神经细胞死亡的最终共同途径[7]。因此,钙离子浓度的维持在脑缺血病理变化中起着重要作用。
天花粉是葫芦科植物栝楼Trichosanthes kirilowii Maxim.或双边栝楼Trichosanthes rosthorinii HarIlls 的干燥根,具有清热泻火、消肿排脓之功效。现代药理研究表明,天花粉对于减轻大鼠脑缺血再灌注损伤具有一定的作用[8]。然而,其作用于脑缺血的成分尚未明确。泻根醇酸是天花粉中四环三萜类成分,具有细胞毒性、抗炎、抗肿瘤、抗氧化等生物活性[9-13]。但是,其对神经细胞作用的影响尚无报道。本文以NMDA 建立PC12 钙离子超载模型,观察泻根醇酸对NMDA 诱导的PC12 细胞损伤的影响,并用Western Blot 法检测CREB 等相关基因蛋白的表达,初步在分子细胞水平上探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 试剂
PC12 细胞株购于北京北纳创联生物技术研究院;泻根醇酸(bryonolic acid)由福建中医药大学药学院分离提供,纯度>98%;胰蛋白酶、RPMI-1640培养基、胎牛血清(FBS)均购于美国Hyclone 公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)、N-甲基-D-天冬氨酸(NMDA)、Fura-2/AM 均购于美国Sigma 公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购于南京建成生物工程研究所;Bax、Bcl-2、CREB、p-CREB、CaMKII、p-CaMKII、β-actin 均购于美国Cell Signaling Technology 公司。
1.1.2 主要仪器设备
超净工作台(苏州安泰空气技术公司,SW-CJ-2FD);CO2细胞培养箱(Thermo,3111);酶联免疫检测仪(TECAN,Infinite M200 Pro);倒置显微镜(江南光电集团有限公司,YS100);全自动凝胶成像系统(Bio-rad,Gel Dox XR+)等。
1.2 实验方法
1.2.1 细胞培养
PC12 细胞培养于RMPI-1640 完全培养基中(含10% FBS、100 U/mL 青霉素和链霉素)的培养基,置于37 ℃、5% CO2培养箱中培养。2~3 d 传代一次,倒置显微镜下观察细胞生长状态,选取对数生长期的细胞进行实验。
1.2.2 实验分组
取对数生长期的PC12 细胞按照2 ×104个/孔接种于96 孔培养板上,37 ℃、5% CO2恒温恒湿培养箱中培养24 h 后,用PBS 轻轻荡洗1 次,并按分组需要加药。正常组加入等量的1640 培养基,模型组和药物组分别加入1640 培养基和不同浓度的BA,预孵育24 h 后,加入NMDA 使其终浓度为20 mM,共孵育6 h。
1.2.3 MTT 法检测细胞活力
孵育结束后,每孔加入5 mg/mL 的MTT 10 μL,继续培养4 h,吸弃培养基,加入100 μL DMSO,待蓝紫色甲瓒颗粒完全溶解后,用酶联免疫检测仪测定波长570 nm 下的吸光度值(A)。细胞存活率(%)=实验组A 值/正常对照组A 值×100%。
1.2.4 LDH 活性测定
孵育结束,收集各组细胞上清液,实验步骤按照试剂盒说明书操作,酶联免疫检测仪波长450 nm 下测定吸光度值A,计算LDH 活性。
1.2.5 细胞内钙离子浓度测定
取对数生长期的PC12 细胞按照2 ×104个/孔接种于96 孔培养板上,37 ℃、5% CO2恒温恒湿培养箱中培养24 h 后,用PBS 轻轻荡洗1 次并分组。正常组、模型组、给药组(100 μM BA),方法同上。孵育结束吸弃培养基,用D-PBS 清洗,加入完全培养基,用Fura-2/AM 5 μM 37 ℃孵育45 min,用含有0.2%牛血清蛋白的D-PBS 清洗。测定前,细胞置于37 ℃孵育5 min。荧光条件:以340 nm 和380 nm波长交替激发,发射波长为510 nm,酶标仪测定。
1.2.6 Western blot 检测CaMKII、p-CaMKII、CREB、p-CREB、Bax、Bcl-2 的表达
取对数生长期的PC12 细胞按照4 ×105个/孔接种于6 孔培养板上,在37 ℃、5% CO2恒温恒湿培养箱中培养24 h 后,用PBS 轻轻荡洗1 次,实验分成正常组、模型组、给药组(100 μM BA),方法同上。孵育结束,加入裂解液提取各组细胞蛋白样品,BCA 法进行蛋白定量。取适量样品,加入等体积5×蛋白上样缓冲液,100 ℃金属浴6 min。各组取20 μg 进行SDS-聚丙烯酰胺凝胶(5%浓缩胶、13%分离胶)电泳分离。将分离蛋白转移到PVDF 膜,5%脱脂奶室温封闭2 h,分别加入5%脱脂奶配制的一抗[β-actin(1∶1000)、CaMKII (1∶1000)、p-CaMKII(1∶1000)、CREB (1∶1000)、p-CREB (1∶1000)、Bax(1∶1000)、Bcl-2 (1∶1000)],4 ℃过夜。TBST 洗3×10 min,加入5%脱脂奶配制的二抗(1∶7000)室温孵育2 h,TBST 洗3 ×10 min,ECL 发光显影。
1.2.7 统计学方法
2 实验结果
2.1 BA 对NMDA 诱导PC12 细胞损伤的作用
20 mM NMDA 能成功诱导PC12 细胞损伤,存活率仅为51.6 ±2.8%,与正常对照组相比具有统计学意义(P<0.01),而PC12 细胞经过BA 高、中、低三种浓度预处理后,存活率均有不同程度增加,且药物组100 μM 和1000 μM 与模型组相比差异显著(P<0.05),并随着剂量的增加有明显的量效关系。说明BA 对NMDA 诱导的PC12 细胞损伤具有较好的保护作用。结果见图1A。
2.2 BA 对NMDA 诱导PC12 细胞LDH 释放的影响
BA 可以抑制NMDA 引起的LDH 的释放。模型组的LDH 释放率为106.5 ±11.3%,明显高于正常组(P<0.01);而预先用BA 孵育的给药组其LDH 释放率较模型组有所降低,并100 μM 和1000 μM 的BA 组差异显著(P<0.01)。结果见图1B。
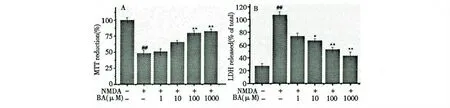
图1 BA 对NMDA 诱导PC12 细胞的影响(D,n=8)Fig.1 Effect of BA on NMDA-induced PC12 cells (D,n=8)
2.3 BA 对NMDA 诱导PC12 细胞内钙离子浓度的影响
PC12 经NMDA 处理后,细胞内钙离子浓度明显高与正常组,具有统计学意义(P<0.01);但是,当用100 μM BA 预先处理后,与模型组相比,钙离子水平显著降低(P<0.01)。说明,BA 对PC12 的保护作用可能与调节细胞内钙离子浓度有关。结果见图2。
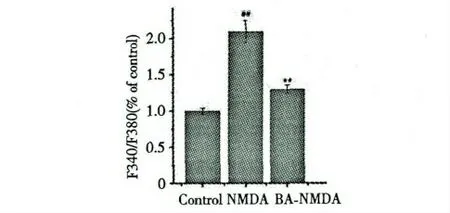
图2 BA 对NMDA 诱导PC12 细胞内钙离子浓度的影响(D,n=6)Fig.2 Effect of BA on intracellular Ca2+ concentration in NMDA-induced PC12 cells(D,n=6)
2.4 BA 对NMDA 诱 导PC12 细 胞CaMKII、p-CaMKII、CREB、p-CREB、Bax、Bcl-2 的表达
如图3 所示,与正常组相比,模型组中Bcl-2、p-CREB 表达量显著降低,p-CaMKII、Bax 表达水平显著升高。与模型组相比,BA 药物组Bcl-2、p-CREB则显著上调、Bax 表达降低。CaMKII 和CREB 在各实验组中表达无显著性差异,p-CaMKII 表达在模型组和药物组表达无显著性差异。
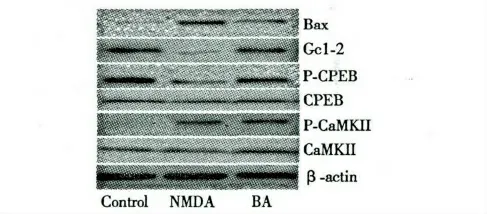
图3 BA 对NMDA 诱导的PC12 细胞蛋白水平表达的影响Fig.3 Effect of BA on protein levels on NMDA-induced PC12 cells
3 讨论
目前,缺血性中风是继癌症、心血管疾病的第三种致死致残的疾病。然而,对于治疗急性脑缺血的临床药物较少,有必要开发研究新的治疗药物。兴奋性毒性是脑缺血引起神经细胞死亡的一个重要原因[14]。NMDA 是一种兴奋性氨基酸,能通过作用于突触后神经原的相应受体,激活受体门控性钙通道,引起细胞内钙超载。胞内钙超载继发性引起线粒体中毒,细胞能量代谢障碍,内源性兴奋性氨基酸(EAA)过度释放,加重神经毒性,导致细胞死亡。NMDA 诱导的神经细胞死亡与p-CREB 和Bcl-2 低表达,Bax 高表达有关[15]。
PC12 细胞是大鼠肾上腺嗜铬细胞瘤的细胞株,具有神经细胞特性,可传代培养,类型较为单一,细胞特性稳定,常用于体外神经性疾病的研究。目前,已有高浓度的NMDA 损伤PC12 细胞的模型用于脑卒中的文献报道[16,17]。本实验研究表明,给药组细胞活力明显升高,LDH 释放量减低。说明BA 对NMDA 诱导的PC12 损伤细胞有保护作用。
Ca2+是细胞内关键的第二信使,在神经细胞中,胞内自由钙离子浓度的变化能调控多种不同神经功能,对酶活性、神经递质释放、神经可塑性以及基因表达等方面起着非常重要的作用。静息状态下,细胞内游离钙离子浓度仅为10-8~10-7M,细胞受到刺激,可升高到10-6M。脑缺血再灌注后,细胞内的Ca2+超载,脑组织中钙调蛋白(CaM)活性和含量也明显升高。临床上多种CaM 抑制剂可抑制神经原细胞的Ca2+内流,从而抑制脑缺血对神经损伤的作用,缩小梗死面积。
Ca2+/钙调蛋白依赖(CaM)的蛋白激酶II(CaMKII)是一种多功能丝氨酸/苏氨酸蛋白激酶,在脑突触后致密区蛋白中占1%~2%。它分为α、β 两个亚型,在Ca2+敏感的信号通路中起主导作用,是不同外界刺激引起的神经可塑性改变的基础。Ca2+/CaM 复合物能够激活CaMKII 发生自磷酸化,发挥蛋白激酶活性,调控细胞中许多反应[18,19]。文献表明,CaMKII 磷酸化是脑缺血病变的一个重要过程[20,21]。CaMKII 能够激活CREB,调控特定基因的表达。
cAMP 应答元件结合蛋白(CREB)是一种重要的核转录因子,在神经系统中发挥着重要作用。它参与了神经细胞增殖,神经诱导分化、神经突触生长等生理活动[22,23]。因此,CaMKII 和CREB 可以作为神经元凋亡中许多信号通路中的交汇点。
本实验结果表明,天花粉中泻根醇酸对NMDA诱导的PC12 细胞损伤具有保护作用,可明显提高NMDA 诱导的PC12 细胞的存活率,减少LDH 的释放,并且呈剂量依赖关系。NMDA 能引起PC12 细胞内CaMKII 磷酸化;BA 干预后,p-CREB、Bcl-2 水平上调,Bax 表达下调。BA 可能通过Ca2+-CaMKIICREB 信号通路调控脑缺血引起细胞凋亡。基于此,泻根醇酸有望成为治疗脑缺血的神经保护类化合物,具有广阔的开发前景和研究意义。
致谢:本课题在康复技术协同创新中心和国家中医药管理局中医康复研究中心资助下,在福建省科技厅福建省中药学重点实验室完成。
1 Simerabet M,Robin E,Aristi I,et al.Preconditioning by an in situ administration of hydrogen peroxide:involvement of reactive oxygenspecies and mitochondrial ATP-dependent potassium channel in a cerebral ischemia-reperfusion model.Brain Res,2008,1240:177-184.
2 Candelario-Jalil E.Injury and repair mechanisms in ischemic stroke:considerations for the development of novel neurotherapeutics.Curr Opin Investig Drugs,2009,10:644-654.
3 Janardhan V,Qureshi AI.Mechanisms of ischemic brain injury.Curr Cardiol Reports,2004,6:117-123.
4 Amantea D,Nappi G,Bernardi G,et al.Post-ischemic brain damage:pathophysiology and role of inflammatory mediators.FEBS,2009,276:13-26.
5 Doyle KP,Simon RP,Stenzel-Poore MP.Mechanisms of ischemic brain damage.Neuropharmacology,2008,55:310-318.
6 Ma SW,Liu HX,Jiao HY,et al.Neuroprotective effect of ginkgolide K on glutamate-induced cytotoxicity in PC 12 cells via inhibition of ROS generation and Ca2+influx.Neuro Toxicol,2012,33:59-69.
7 Bano D,Nicotera P.Ca2+signals and neuronal death in brain ischemia.Stroke,2007,38:S674-676.
8 Chen W (陈威),Zhang SW (张思为),Wang H(王红).Study of radices trichosanthis on neuronal apoptosis in rats with local cerebral ischemia reperfusion.Mod J Integr Tradit Chin Med West Med (现代中西医结合杂志),2011,20:1844-1845.
9 Tanaka S,Uno C,Akimoto M,et al.Anti allergic effect of bryonolic acid from luffa cylindrica cell suspension cultures.Planta Med,1991,57:527-530.
10 Takeda T,Kondo T,Mizukami H,et al.Chem.Bryonolic acid production in hairy roots of Trichosanthes kirilowii Max.var Japonica Kitam.Transformed with Agrobacterium rhizogenes and its cytotoxic activity.Chem Pharm Bull (Tokyo),1994,42:730-732.
11 Kondo T,Inoue M,Mizukami H,et al.Cytotoxic activity of bryonolic acid isolated from transformed hairy roots of Trichosanthes kirilowii var.japonica.Biol Pharm Bull,1995,18:726-729.
12 Akihisa T,Tokuda H,Ichiishi E,et al.Anti-tumor promoting effects of multiflorane-type triterpenoids and cytotoxic activity of karounidiol against humancancer cell lines.Cancer Lett,2001,173:9-14.
13 Barker EC,Gatbonton-Schwager TN,Han Y,et al.Bryonolic acid:A large-scale isolation and evaluation of heme oxygenase 1 expression in activated macrophages.J Nat Prod,2010,73:1064-1068.
14 Mao QQ,Zhong XM,Li ZY,et al.Paeoniflorin protects against NMDA-induced neurotoxicity in PC12 cells via Ca2 +antagonism.Phytother Res,2011,25:681-685.
15 Lin WY,Chang YC,Lee HT,et al.CREB activation in the rapid,intermediate,and delayed ischemic preconditioning against hypoxic-ischemia in neonatal rat.J Neurochem,2009,108:847-859.
16 Negis Y,Unal AY,Korulu S,et al.Cell cycle markers have different expression and localization patterns in neuron-like PC12 cells and primary hippocampal neurons.Neurosci Lett,2011,496:135-140.
17 Kim JY,Jeong HY,Lee HK,et al.Neuroprotection of the leaf and stem of Vitis amurensis and their active compounds against ischemic brain damage in rats and excitotoxicity in cultured neurons.Phytomedicine,2012,19:150-159.
18 Choi SS,Seo YJ,Kwon MS,et al.Increase of phosphorylation of calcium/calmodulin-dependent protein kinase-II in several brain regions by substance P administered intrathecally in mice.Brain Res Bull 2005,65:375-381.
19 Takano H,Fukushi H,Morishima Y,et al.Calmodulin and calmodulin-dependent kinase IImediate neuronal cell death induced by depolarization.Brain Res,2003,962(1-2):41-47.
20 Tang K,Liu C,Kuluz J,et al.Alterations of CaMKII after hypoxia-ischemia during brain development.J Neurochem,2004,91:429-437.
21 Meng F,Guo J,Zhang Q,et al.Autophosphorylated calcium/calmodulin-dependent protein kinase II alpha (CaMKII alpha)reversibly targets to and phosphorylates N-methyl-D-aspartate receptor subunit 2B (NR2B)in cerebral ischemia and reperfusion in hippocampus of rats.Brain Res,2003,967:161-169.
22 Lonze BE,Riccio A,Cohen S,et al.Apoptosis,axonal growth defects,and degeneration of peripheral neurons in mice lacking CREB.Neuron,2002,34:371-85.
23 Redmond L,Kashani AH,Ghosh A.Calcium regulation of dendritic growth via CaM kinase IV and CREB-mediated transcription.Neuron,2002,34:999-1010.
