黄芪多糖对免疫抑制模型小鼠Treg 细胞及Th17 细胞亚群的影响
2015-01-10王雪梅贾天玉冯燕海雒艳萍曹明强于红娟马兴铭
王雪梅,贾天玉,管 彬,冯燕海,雒艳萍,曹明强,于红娟,马兴铭,3*
1兰州大学口腔医学院;2 兰州大学基础医学院;3 甘肃省循证医学与临床转化重点实验室,兰州 730000
多糖是指由10个以上单糖分子链接成的碳水化合物,天然活性多糖是一种良好的免疫增强剂,能够显著提高机体的特异性或非特异性免疫[1]。黄芪多糖(astragalus polysaccharide,APS)作为中药黄芪中重要的天然有效活性成分,具有抗炎、抗肿瘤、抗应激、抗氧化、增强免疫功能等的免疫调节效应[2-4]。近年发现一种主要分泌IL-17 的特殊CD4+Th 细胞亚群,即Th17 细胞亚群,降低或阻断Th17细胞的活性可缓解炎症反应的发生和发展[5]。CD4+CD25+调节性T 细胞(Treg)是一类发挥免疫抑制功能的T 细胞,能够有效抑制和调节机体效应淋巴细胞的增殖、活化[5]。我们的前期实验研究发现黄芪多糖药物能够促进口腔粘膜上皮的再生与增殖,减小口腔溃疡面积、减少黏膜组织的淋巴细胞浸润,具有缓解口腔黏膜的炎症反应的活性[3],降低哮喘模型大鼠支气管中的淋巴细胞、嗜酸性粒细胞以及巨噬细胞数量,减轻支气管及肺泡的炎症反应[4],缓解炎症反应的机制尚不清楚。因此,本实验建立免疫抑制小鼠模型,用流式细胞仪分析小鼠脾脏中CD4+T 细胞、CD4+CD25+Treg 细胞的比例,ELISA 检测小鼠血清IL-17 的含量,首次研究黄芪多糖对免疫抑制模型CD4+CD25+Treg 细胞亚群及Th17 细胞活化的影响,进一步揭示黄芪多糖缓解炎症反应的免疫调节机制。
1 材料与方法
1.1 实验动物与试剂
清洁级昆明种雌性小鼠50 只,体重(20 ±2)g,由兰州大学实验动物中心提供(合格证号:医动字第14-005 号),饲养环境温度22 ±1 ℃,自由进食、饮水。黄芪多糖购陕西创升生物科技有限公司(多糖含量40%)。抗鼠CD4-FITC(eBioscience)、抗鼠CD25-APC(eBioscience)、IL-17 ELISA 试剂盒、淋巴细胞分离液购自达科为生物工程有限公司。RPMI-1640 培养基为Gibco 产品。环磷酰胺注射液由山西普德药业股份有限公司(批号:04130901)。
1.2 动物模型的建立与给药
小鼠随机分为模型对照组、黄芪多糖高、中、低剂量组和空白对照组,每组10 只。模型对照组和黄芪多糖药物组小鼠于第1 d、第2 d、第3 d、第10 d腹腔注射环磷酰胺80 mg/(kg·d),建立免疫抑制模型[6]。模型对照组于建模第4 d 灌服生理盐水0.2 mL/20g·d;黄芪多糖药物组于建模第4 d 灌服不同剂量黄芪多糖,药物剂量分别为1.0 g/(kg·d)(高剂量组)、0.5 g/(kg·d)(中剂量组)、0.25 g/(kg·d)(低剂量组);空白对照组在相同时间点分别注射和灌服等体积生理盐水,连续给药10 d。次日眼球后采血,分离血清并经56 ℃30 min 灭活,-20 ℃保存备用。分离胸腺和脾脏并称量湿重,分别计算胸腺或脾脏指数,同时制备脾淋巴细胞悬液。
1.3 淋巴细胞悬液制备与流式细胞仪检测
无菌取脾,剪碎研磨,加入适量不完全1640 培养液,过200 目尼龙网,制备脾细胞悬液,用淋巴细胞分离液(2000 rpm 离心40 min)密度梯度离心法,分离脾脏淋巴细胞,PBS 缓冲液洗涤细胞一次,调整淋巴细胞悬液浓度为1 ×107个/mL。取淋巴细胞悬液100 μL,按照试剂盒说明分别加入荧光素标记的FITC-CD4 与APC-CD25 单克隆抗体,避光4 ℃孵育30 min,加入预冷PBS 1 mL 重悬细胞,2400 rpm离心5 min,弃上清,细胞沉淀重悬于500 μL 缓冲液,经400 目尼龙网过滤细胞后上机,BD LSRFortessa 型流式细胞仪(美国BD 公司)检测并分析小鼠脾脏CD4+T 细胞/淋巴细胞、CD4+CD25+Treg 细胞/淋巴细胞、CD4+CD25+Treg 细胞/CD4+T 细胞的百分比。
1.4 血清IL-17 含量检测
酶联免疫吸附法(ELISA)测定各组小鼠血清IL-17 含量,操作按说明书进行。
1.5 统计学方法
实验数据用SPSS17.0 软件的One-Way 方差分析(ANOVA),以平均值±标准差即±SD 表示,最小显著差(LSD)进行统计处理。
2 实验结果
2.1 黄芪多糖对小鼠免疫器官质量的影响
各组小鼠的胸腺指数和脾脏指数变化无统计学差异,表明0.25~1.0 mg/(kg·d)剂量范围的黄芪多糖对免疫抑制小鼠的胸腺和脾脏质量无明显影响。
2.2 黄芪多糖对小鼠CD4+ T 细胞、CD4+ CD25+Treg 细胞亚群比例的影响
流式细胞分析仪检测免疫抑制模型小鼠脾脏CD4+T 细胞/淋巴细胞、CD4+CD25+Treg 细胞/淋巴细胞及CD4+CD25+Treg 细胞/CD4+T 细胞的百分比的结果见图1~3。与空白对照组比较,免疫抑制各组小鼠CD4+T 细胞数占淋巴细胞数的比例均显著降低(P<0.05);与模型对照组比较,黄芪多糖高、中剂量组小鼠CD4+T 细胞数的比例明显降低,具有显著性差异(P<0.05)(图1 左)。模型对照组CD4+CD25+Treg 细胞占淋巴细胞数的比例升高,与空白对照组比较无统计学意义(P >0.05),但经黄芪多糖药物作用后,高、中剂量组小鼠CD4+CD25+Treg 细胞数的比例降低(P<0.05)(图1 右)。模型对照组CD4+CD25+Treg 细胞占CD4+T 细胞数的比例显著升高,与空白对照组比较有统计学意义(P<0.05),经黄芪多糖药物作用后,小鼠脾脏CD4+CD25+Treg 细胞的比例均升高,尤其以高、中剂量组升高最明显(图2、图3)。表明黄芪多糖未显示出拮抗环磷酰胺诱导的Treg 细胞上升,而与环磷酰胺协同上调小鼠脾脏CD4+CD25+Treg 细胞数/CD4 +T 细胞数的比例,降低CD4+T 细胞的比例,提示黄芪多糖具有提高小鼠脾脏Treg 细胞数而下调免疫功能的活性。
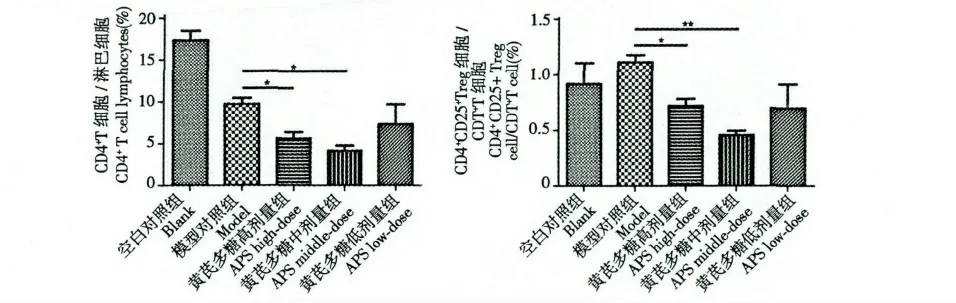
图1 CD4 +T 细胞、CD4 + CD25 +Treg 细胞占淋巴细胞的比例(* P<0.05,**P<0.01)Fig.1 The proportion of CD4 +T cells or CD4 + CD25 +Treg cells among lymphocytes (* P<0.05,**P<0.01)
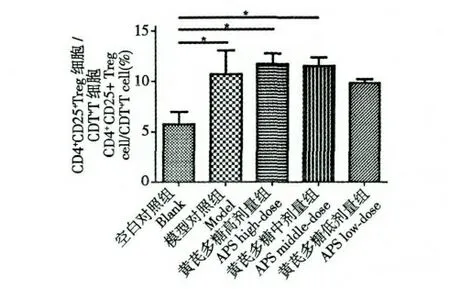
图2 CD4 + CD25 +Treg 细胞占CD4 +T 细胞的比例(* P<0.05)Fig.2 The proportion of CD4 + CD25 +Treg cells among CD4 +T cells (* P<0.05)
2.3 黄芪多糖对小鼠血清IL-17 水平的影响
黄芪多糖对免疫抑制模型小鼠血清IL-17 水平的影响见图4。模型对照组小鼠血清IL-17 的含量明显升高,与空白对照组比较有统计学意义(P<0.01),经过黄芪多糖药物作用后,黄芪多糖各剂量组小鼠血清IL-17 的含量均降低,尤其高、中剂量组小鼠血清IL-17 的含量降低显著(P<0.01,P<0.05)(图4)。表明黄芪多糖能够拮抗环磷酰胺促小鼠分泌IL-17 的作用,对小鼠的Th17 细胞的功能具有下调作用,抑制其分泌IL-17。
3 讨论
CD4+T 细胞在适应性免疫应答、炎症反应中发挥重要作用,根据其生物学功能和产生细胞因子的不同,主要包括Th1 细胞亚群、Th2 细胞亚群、Th17细胞亚群和CD4+CD25+Treg 细胞亚群[5,7,8]。既往认为Th1/Th2 细胞亚群功能失调,会引起严重的炎症反应并诱导产生多种自身免疫病。自从2005 年Th17 细胞作为一个新的CD4+T 细胞亚群被确认之后,发现Th17 细胞介导炎性反应、参与多种自身免疫病、移植排斥等的发生和发展,Th17 细胞主要的效应分子是其分泌IL-17,IL-17 能有效地介导中性粒细胞动员、募集活化过程,促进炎症反应,通过抑制CD4+Th17 细胞活化或拮抗IL-17,可有效缓解炎症反应的发生和发展[5,9]。CD4+CD25+Treg 细胞是一类在维持免疫耐受和免疫应答的负调节中发挥作用,能够抑制和调节机体CD4+效应Th 细胞的增殖、活化[5,8],已有多项研究将Treg 细胞用于自身免疫性病、超敏反应性疾病的治疗,并取得了良好的结果,通过上调体内Treg 细胞的数量,从而抑制机体T细胞活化,可有效缓解炎症损伤[10]。本实验研究发现黄芪多糖具有提高脾脏Treg 细胞数,抑制CD4+Th17 细胞活化,降低血清IL-17 的水平,是其有效缓解炎症损伤的机制之一。
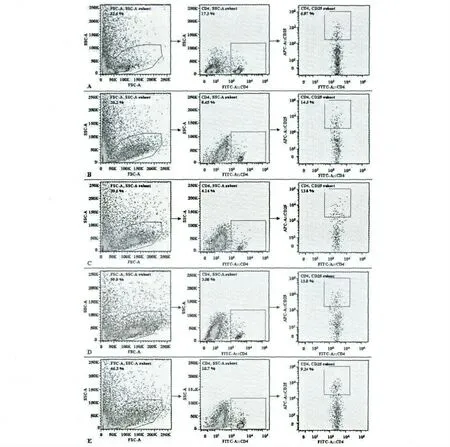
图3 流式细胞仪检测小鼠脾脏CD4 +T 细胞、CD4 +CD25 +Treg 细胞百分比Fig.3 Flow cytometric examination of CD4 +T cells and CD4 + CD25 +Treg cells proportion
黄芪是一味药用历史悠久、临床应用广泛的传统补益类中药。黄芪多糖是从中药黄芪中分离提纯的主要天然有效活性成分,具有抗病毒、抗肿瘤、抗衰老、抗辐射、抗应激、抗氧化等多种活性[1]。黄芪多糖作为一种免疫调节剂,能明显升高大鼠淋巴细胞活性,促进IL-1、IL-2、TNF-α 等细胞因子的分泌及抗体的产生,从而发挥显著增强免疫作用[11]。另一方面,研究发现黄芪多糖药物能够促进口腔黏膜上皮细胞增殖,减少黏膜组织的淋巴细胞浸润,缓解口腔黏膜的炎症损伤,促进溃疡愈合[3];黄芪多糖具有降低哮喘模型大鼠支气管中的淋巴细胞、嗜酸性粒细胞以及巨噬细胞数量,减轻支气管及肺泡的炎症,可用于治疗哮喘[4];黄芪多糖能够降低1 型糖尿模型小鼠胰岛组织中炎症细胞的浸润,使其炎性细胞因子IL-1、IL-2、IL-6、TNF-α 和INF-γ 的表达水平明显下调,用于预防1 型糖尿病的发生[12]。表明黄芪多糖具有双向的调节作用,对口腔溃疡、哮喘、糖尿病等炎症损伤具有缓解作用,减少炎症组织的淋巴细胞浸润。本实验利用免疫抑制剂环磷酰胺建立免疫抑制模型小鼠,用黄芪多糖连续灌胃干预10天后,黄芪多糖未显示出拮抗环磷酰胺诱导的Treg细胞上升[13],而与环磷酰胺发挥协同效应,明显上调小鼠脾脏CD4+CD25+Treg 细胞数/CD4+T 细胞数的比例,尤其以高、中剂量组升高最明显。CD4+CD25+Treg 细胞比例的升高,有效抑制机体效应淋巴细胞的增殖、活化,导致CD4+T 细胞的比例的降低,抑制小鼠的Th17 细胞的活化,对抗环磷酰胺促进小鼠分泌IL-17 的作用,从而抑制Th17 细胞分泌IL-17。因此,黄芪多糖具有提高脾脏Treg 细胞数、抑制Th17 细胞活化的作用,可作为一种潜在的用于治疗和预防炎症损伤性疾病的中药调节剂,但其上调节CD4+CD25+Treg 细胞数和抑制Th17 细胞活化的分子机制仍需进一步研究。
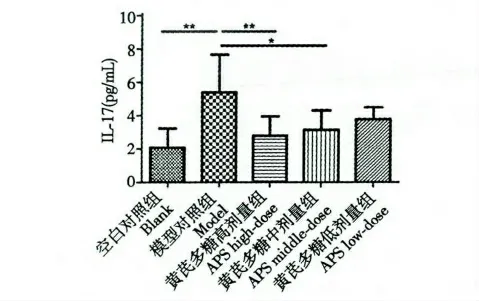
图4 小鼠血清IL-17 含量(* P<0.05,**P<0.01)Fig.4 The serum IL-17 levels in immunesuppressed mice(* P<0.05,**P<0.01)
1 He WJ (何文涓),Yuan ZJ (袁志坚),He XS (何晓升).Research progress on pharmacological effects of Astraglus polysaccharide.Chin J Biochem Pharm (中国生化药物杂志),2012,33:692-694.
2 Dou H (窦辉),Fu TJ (付铁军),Zhang F (张帆),et al.Chemical constituents of Huangqi injection.Nat Prod Res Dev(天然产物研究与开发),2002,14:14-17.
3 Wang XM(王雪梅),Bo L (薄磊),Qi J (祁晶),et al.Therapeutic effects of astragalus polysaccharides on oral ulcers in rats.Nat Prod Res Dev (天然产物研究与开发),2013,25:321-324.
4 Li CD (李承德),Zhou WB (周文宾),Sun Y (孙艳),et al.Effects of astragalus polysaccharide on Thl7/Treg associated cytokines and airway inflammation in OVA-induced asthmatic rats.Chin Pharm Bull (中国药理学通报),2013,29:1275-1279.
5 Xin CH,Joost J.Oppenheim.Th17 cells and Tregs:unlikely allies.J Leukocyte Biol,2014,95:723-731.
6 Tian WH (田卫花),Ma XM (马兴铭),Liu Y (刘英),et al.Effects of aqueous extracts from Sophora moorcroftiana on cellular immunological functions in the immunosuppressive mice.Nat Prod Res Dev (天然产物研究与开发),2009,21:472-479.
7 He Y (何英),Zheng CQ (郑长青),Lin Y (林艳),et al.Research on Th17 cell and its biological effect.Prog Mod Biomed (现代生物医学进展),2009,9:1769-1772.
8 Ma XM (马兴铭),Ding JB (丁剑冰).Medical Immunology(医学免疫学).Beijing:Tsinghua University Press,2013.127-128.
9 Hu JH (胡锦辉),Bi SL (毕胜利),Lv Y (吕元).The Th17 cell is gradually gaining in-depth study.Chin J Immu(中国免疫学杂志),2012,28:372-378.
10 Cheng JY (程佳音),Lv XX (吕小迅).Research progress in regulatory T cells.Acad J Guangdong Pharm Coll (广东药学院学报),2012,28:102-107.
11 Li R,Chen W,Wang W,et al.Extraction,characterization of Astragalus polysaccharide and its immune modulating activities in rats with gastric cancer.Carbohydr Polym,2009,78:738-742.
12 Chen W (陈蔚),Li YM (李益明),Yu MH (俞茂华),et al.Immunoloregulation effects of Astragalus polysaccharides on T helper lymphocyte subgroups in nonobese diabetic mice.Chin J Mod Med (中国现代医学杂志),2007,17:28-32.
13 Yuan XJ (苑晓娟),Fan WP (樊卫平),Zhang K (张凯),et al.Regulatory effect of low dose cyclophosphamide on CD4+CD25+Treg cells in mice.Immu J (免疫学杂志),2011,27:292-296.
