联合提取铁皮石斛中生物碱及多糖的研究
2015-01-10荣永海仝战旗
原 琳,李 娇,荣永海,仝战旗,荣 龙*
1北京航空航天大学生物与医学工程学院,北京 100191;2 解放军总医院,北京 100853
铁皮石斛(Dendrobium officinale)属于兰科石斛属,是一种多年生附生草本植物。铁皮石斛可入药,为名贵中药铁皮枫斗的原植物,具有益胃生津,滋阴清热等多种功效。现代药理研究表明,铁皮石斛具有增强免疫力、抗疲劳、抗氧化、促进消化、降血糖、降血压等作用[1]。铁皮石斛中含有多种化学成分,包括氨基酸、多糖、生物碱、菲类化合物等[2]。从石斛中分离得到的生物碱叫做石斛碱,为碱性的含氮有机化合物。研究表明,石斛碱为石斛的主要有效成分之一。石斛碱种类繁多,并具有多种生理活性,包括:降血压、抗肿瘤、镇静镇痛及抗菌抗疟等。石斛碱的抗肿瘤活性已在动物实验中得到证实,且石斛碱相较其他抗肿瘤药具有低毒性、低成本的特点,因此生物碱的提取纯化已成为近年来的一个研究热点。此外,铁皮石斛中还含有高达18.20 %的多糖。铁皮石斛多糖主要具有抗氧化及增强免疫力等生理功能。同时,铁皮石斛多糖也具有抗肿瘤的功效,可以抑制肝癌HepG2 细胞及人宫颈癌HelaS3 细胞的生长[3]。
铁皮石斛中的生物碱和多糖均为重要的功能化合物。以往的研究[4-7]基本仅分离提取铁皮石斛中的单一活性成分,导致铁皮石斛原材料的极大浪费。因此,生物碱和多糖的联合提取对于铁皮石斛资源的综合利用来说具有重要的现实意义。本研究应用了闪式提取法这一新型提取技术,具有温和、高效、节能的优点。本实验室以往的研究[8-11]将其用于多种原材料活性成分的分离提取,均取得了良好的效果。本研究探讨了利用闪式提取技术从铁皮石斛中联合提取生物碱及多糖的工艺方法,并对工艺中的酶解条件进行了优化。
1 材料与仪器
铁皮石斛冷冻鲜品(原料干重以原料鲜重13.78%计),由江门市鸿豪实友生物有限公司提供。纤维素酶:北京鸿润宝顺科技有限公司,2000 U/g;木瓜蛋白酶:北京鸿润宝顺科技有限公司,980000 U/g;石斛碱标准品:中国食品药品检定研究院,99.8%;溴甲酚绿:天津市光复精细化工研究所,pH 值变色范围3.8(黄绿)~5.4(蓝);乙腈:J&K,色谱纯;其他试剂均为国产分析纯试剂;水为双蒸水。
高精度磁浮天平,BELENGINEER;闪式提取器:JHBE-50 型,河南金鼎科技发展有限公司;低速台式离心机:TDL-5-A 型,上海安亭科学仪器厂;循环水式多用真空泵,上海知信实验仪器技术有限公司;数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;DHG-9071A 型电热恒温干燥箱,上海精宏实验设备有限公司;旋转蒸发器:RE-52AA 型,上海亚荣生化仪器厂;紫外可见分光光度计:SP-756 型,上海光谱仪器有限公司;高效液相色谱仪:600 型,Waters;液相色谱仪:1200 系列,安捷伦科技有限公司;示差折光检测器:Knauer。
2 实验方法
2.1 生物碱测定
生物碱测定采用酸性染料比色法。
2.1.1 标准曲线的绘制
精密称取石斛碱标准品1 mg,用氯仿溶解,用容量瓶定容至100 mL,以配制成10 μg/mL 的石斛碱标准品溶液。分别取标准溶液1、2、3、4、5 mL 置于分液漏斗中,用氯仿稀释至10 mL。分别加入pH 4.5 的邻苯二甲酸氢钾缓冲液5 mL 及0.04%溴甲酚绿2 mL,剧烈振摇3 min,室温下静置30 min。将氯仿层用药棉滤过,取续滤液5 mL,加入0.01 mol/L NaOH-乙醇溶液1 mL,摇匀。用分光光度计在620 nm 下测定其吸光度,由吸光度A 对浓度C(μg/mL)进行回归计算,得到标准曲线方程:A=-0.0019 +0.1651C,R2=0.9992。
2.1.2 样品的测定
精密称取本实验制得的生物碱样品50 mg 置于100 mL 容量瓶中,用氯仿溶解并定容至100 mL。取10 mL 置于分液漏斗中,其余按“2.1.1 标准曲线的绘制”项下方法进行测定。
2.2 多糖测定
多糖测定采用苯酚-硫酸比色法[12]。
2.2.1 标准曲线的绘制
精密称取葡萄糖标准品20 mg 置于100 mL 容量瓶中,加水溶解,并定容至刻度,以配置成200 μg/mL 的葡萄糖标准溶液。将此标准溶液稀释至20、40、60、80、100、120 μg/mL,各浓度稀释液各取1 mL 置于具塞试管中,分别加入5%苯酚溶液1 mL,震荡混匀后立即加入浓硫酸5 mL,混匀后在100 ℃下水浴20 min,冰浴5 min。用分光光度计在488 nm 下测定显色后溶液的吸光度,由吸光度A 对浓度C(μg/mL)进行回归计算,得到标准曲线方程:A=-0.0046 +0.0081 C,R2=0.9992。
2.2.2 样品的测定
精密称取本实验制得的多糖样品20 mg 置于100 mL 容量瓶中,加水溶解至刻度,取1.0 mL 置于具塞试管中,其余按“2.2.1 标准曲线的绘制”项下方法进行测定。
2.3 联合提取方法
2.3.1 生物碱的提取
称取一定量的铁皮石斛冷冻鲜品,剪碎,加入8倍体积无水乙醇,以3500 rpm 闪提1 min,间隔1 min,再闪提1 min。以5000 rpm,离心15 min。取沉淀,加入15 倍体积水,以4000 rpm 闪提1 min,间隔1 min,再闪提1 min。以5000 rpm,离心15 min。加水浸没沉淀,真空抽滤,重复3~4 次,洗净沉淀,即得到铁皮石斛粗渣。向铁皮石斛粗渣中加50 倍体积水,加入16 U/g 纤维素酶和19600 U/g 木瓜蛋白酶,用6 mol/L 盐酸将pH 值调至5.5,在50 ℃下酶解2 h 后过滤。用水洗净滤渣。取洗净的滤渣,在真空干燥箱中干燥,之后加入氨水和6 mol/L NaOH溶液碱化。加入3 倍体积丙酮,回流5~8 h 进行脱脂。过滤,取滤渣,用三氯甲烷充分提取其中的生物碱。过滤后取滤液置于蒸发皿中,在水浴锅上将其中的三氯甲烷蒸干。用甲醇将生物碱溶解,离心后取沉淀,待其自然干燥便得到生物碱。
2.3.2 结合多糖的提取
取第一次过滤后得到的滤液,与第二次水洗沉淀得到的洗液合并,在旋转蒸发仪上蒸发浓缩至原体积的1/10。加入乙醇达80%质量百分浓度,在-20 ℃下静置醇沉1 h。以5000 rpm,离心15 min。取沉淀,经无水乙醇、丙酮和乙醚三次脱水,干燥后便得到结合多糖。
2.3.3 游离多糖的提取
取第二次离心后得到的上清,与第一次水洗沉淀得到的洗液合并,在旋转蒸发仪上蒸发浓缩至原体积的1/10。加入乙醇达80%质量百分浓度,在-20 ℃下静置醇沉1 h。以5000 rpm,离心15 min。取沉淀,经无水乙醇、丙酮和乙醚三次脱水,干燥后便得到游离多糖。
2.4 酶解条件的优化
2.4.1 料液比对生物碱及多糖提取率的影响
取一定量的铁皮石斛粗渣,平均分成5 份,分别加入20、30、40、50、60、70 倍体积水,同时加入20 U/g 纤维素酶和19600 U/g 木瓜蛋白酶,用6 mol/L 盐酸将pH 值调至5.5,在50 ℃下酶解2 h,过滤后分别测定料液比为1∶20、1∶30、1∶40、1∶50、1∶60、1∶70时,滤渣中生物碱及上清中多糖的提取率。综合分析后确定酶解的最佳料液比。
2.4.2 纤维素酶添加量对生物碱及多糖提取率的影响
取一定量的铁皮石斛粗渣,平均分成5 份,分别加入8、16、24、32、40、48 U/g 纤维素酶,同时加入50倍体积水和19600 U/g 木瓜蛋白酶,用6 mol/L 盐酸将pH 值调至5.5,在50 ℃下酶解2 h,过滤后分别测定纤维素酶添加量为8、16、24、32、40、48 U/g时,滤渣中生物碱及上清中多糖的提取率。综合分析后确定酶解的最佳纤维素酶添加量。
2.4.3 木瓜蛋白酶添加量对生物碱及多糖提取率的影响
取一定量的铁皮石斛粗渣,平均分成5 份,分别加入9800、19600、29400、39200、49000、58800 U/g木瓜蛋白酶,同时加入50 倍体积水和20 U/g 纤维素酶,用6 mol/L 盐酸将pH 值调至5.5,在50 ℃下酶解2 h,过滤后分别测定木瓜蛋白酶添加量为9800、19600、29400、39200、49000、58800 U/g 时,滤渣中生物碱及上清中多糖的提取率。综合分析后确定酶解的最佳木瓜蛋白酶添加量。
2.4.4 酶解时间对生物碱及多糖提取率的影响
取一定量的铁皮石斛粗渣,平均分成5 份,分别加入50 倍体积水、20 U/g 纤维素酶和19600 U/g 木瓜蛋白酶,用6 mol/L 盐酸将pH 值调至5.5,在50℃下分别酶解1、1.5、2、2.5、3、3.5 h,过滤后分别测定酶解时间为1、1.5、2、2.5、3、3.5 h 时,滤渣中生物碱及上清中多糖的提取率。综合分析后确定最佳酶解时间。
2.5 产品得率及纯度的计算方法

2.6 生物碱HPLC 检测
2.6.1 色谱条件
色谱柱为Waters SunFireTMC18柱(4.6 mm×150 mm,5 μm);流动相为乙腈:0.1%三乙胺=40∶60;流速为1 mL/min;柱温为室温;检测波长为240 nm;进样量为20 μL。
2.6.2 石斛碱标准品检测
准确称取石斛碱标准品0.05 g,用乙腈溶解,定容至10 mL。用上述色谱条件进行检测。
2.6.3 生物碱样品检测
准确称取本工艺制得的生物碱样品50 mg,用乙腈溶解,定容至10 mL。用上述色谱条件进行检测。
2.7 多糖分子量测定
制得的多糖分子量通过凝胶渗透色谱(Gel permeation chromatography,GPC)测定,采用彭锋[13]等人的方法。色谱条件:色谱柱为PL aquagel-OH 50柱(300 mm ×7.7 mm,Polymer Laboratories 有限公司);流速保持在0.5 mL/min;洗脱剂为含20 mmol/L NaCl 的5 mmol/L PBS 缓冲液(pH 值为7.5);柱温为30 ℃。使用PL 支链淀粉(分子量分别为783、12200、100000、1600000 Da,Polymer Laboratories 有限公司)作为标准品进行校准。样品用含20 mmol/L NaCl 的5 mmol/L PBS 缓冲液(pH 值为7.5)溶解配制。
3 结果与讨论
3.1 酶解条件单因素实验的结果
不同酶解料液比对生物碱及多糖提取率的影响如图1(A)所示。随着加水比例的增大,细胞吸水胀破,生物碱的提取率显著增大,在料液比为1∶30时生物碱提取率达到最大,之后随着加水比例的增大逐渐减小,可能原因是,加水使纤维素酶及木瓜蛋白酶被大幅度稀释,破坏其保持稳定所需的条件,因此,两种酶的酶解能力均下降,无法溶解细胞壁,由于细胞壁的保护作用,防止了细胞胀破。多糖提取率起初处于较高水平,可能原因是细胞壁酶解产生了部分多糖,使多糖测定结果偏高。之后随着加水比例的增大,多糖提取率逐渐减小,其原因与生物碱提取率减小相同,料液比达到1∶40 后,多糖提取率趋于稳定。综上,可选择1∶30 作为最适酶解料液比,此时生物碱提取率最大,且多糖提取率也较高。
不同纤维素酶添加量对生物碱及多糖提取率的影响如图1(B)所示。生物碱提取率随着纤维素酶添加量的增加而增大,在纤维素酶添加量为24 U/g时,生物碱的提取率达到最大,之后趋于平缓。多糖提取率随着纤维素酶添加量的增加显著增大,在纤维素酶添加量达到32 U/g 时,多糖的提取率达到最大,而后稍有下降。综上,可选择32 U/g 作为最适纤维素酶添加量,此时多糖提取率最大,而生物碱提取率也保持在最高水平。
不同木瓜蛋白酶添加量对生物碱及多糖提取率的影响如图1(C)所示。生物碱提取率随着木瓜蛋白酶添加量的增加而增大,在木瓜蛋白酶添加量为19600 U/g 时,生物碱的提取率达到最大,之后趋于稳定,增加木瓜蛋白酶添加量生物碱提取率也不再增大。多糖提取率随着木瓜蛋白酶添加量的增加而逐渐增大,在木瓜蛋白酶添加量达到39200 U/g 之后,多糖提取率趋于稳定,再增加木瓜蛋白酶添加量多糖提取率仅有少量增大。综上,可选择39200 U/g 作为最适木瓜蛋白酶添加量,此时生物碱提取率处于最高水平,而多糖提取率也处于较高水平。
不同酶解时间对生物碱及多糖提取率的影响如图1(D)所示。生物碱提取率随着酶解时间的增加而增大,在酶解时间延长到1.5 h 后,生物碱提取率开始趋于平缓。多糖提取率随着木瓜蛋白酶添加量的增加而逐渐增大,在酶解时间达到2.5 h 之后,多糖提取率趋于平缓。综上,可以选择2.5 h 作为酶解的最适时间。在此酶解时间下,生物碱及多糖提取率均在较高水平,且可以节省工艺时间和能源,提高提取效率。
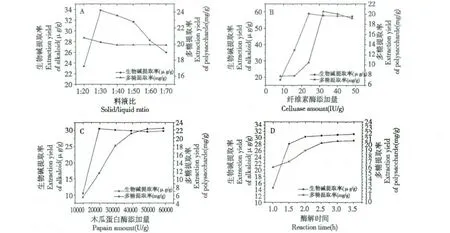
图1 不同料液比(A)、纤维素酶添加量(B)、木瓜蛋白没添加量(C)及酶解时间(D)对生物碱及多糖提取率的影响Fig.1 Effect of material/solvent ratio(A),amount of cellulose added(B),amount of papain added(C),and hydrolysis time (D)on the extraction yields of alkaloid and polysaccharide
3.2 各成分测定结果
用最优工艺条件所提取的各成分定量测定结果见表1。
人工种植的铁皮石斛中总生物碱含量约为0.0190%~0.0430%,而野生一年生铁皮石斛总生物碱含量约为0.0343%,不同品种和生长年限的铁皮石斛生物碱含量基本在一个固定的范围内变动[14]。研究报道,野生铁皮石斛中多糖含量约为20.98%~22.32%,而组织培养的铁皮石斛中多糖含量约为20.65%~22.18%。本实验所提取的生物碱质量占原料湿重的0.01875%,同时,由表1 可知,本工艺所提取的总多糖得率为23.5%。因此,本工艺方法对铁皮石斛中的生物碱及多糖进行了有效提取。另外,所提取的生物碱、结合多糖及游离多糖的纯度分别达到了78.2%、81.3%及90.6%。综上,本工艺成功从铁皮石斛中联合提取了生物碱和多糖两种物质,且保证了各成分的得率和纯度,提高了铁皮石斛原材料的利用率。
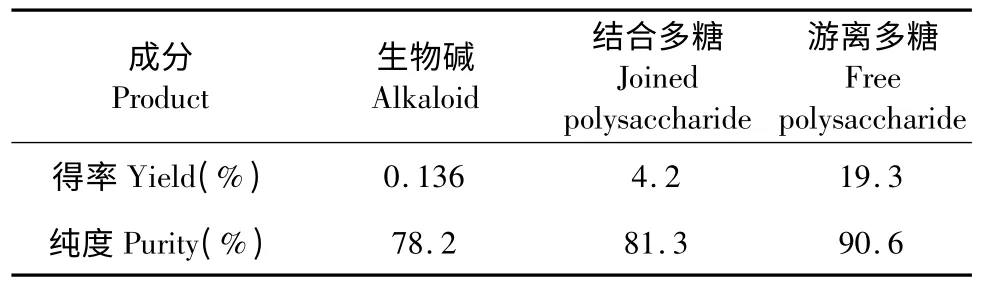
表1 铁皮石斛中各成分定量测定结果Table 1 Quantitative determination of products
3.3 生物碱HPLC 检测
石斛碱标准品及本工艺所制得的生物碱样品的HPLC 色谱图如图2 所示,结果表明,样品与标准品出峰时间基本相同,因此,本工艺所提取分离的生物碱可基本确定为石斛碱。
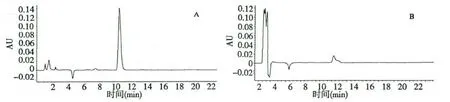
图2 石斛碱标准品及铁皮石斛生物碱样品的HPLC 色谱图Fig.2 HPLC chromatograms of dendrobine standard (A)and D.officinale alkaloid sample (B)
3.4 多糖分子量测定
如图3 所示,本研究所制得的多糖经GPC 分析,得到结合多糖及游离多糖的重均分子量分别为2373Da、17987Da。
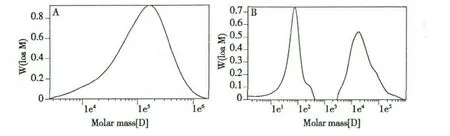
图3 凝胶渗透色谱测定结合多糖(A)及游离多糖(B)分子量结果Fig.3 GPC chromatograms of joint polysaccharide(A)and free polysaccharide(B)
4 结论
本研究利用闪式提取、酶解等方法成功从铁皮石斛中联合提取了生物碱及多糖两种生物活性成分,对于铁皮石斛这种珍贵中药材的综合利用具有重要意义。利用本研究所确定的提取方法及提取条件所得到的生物碱、多糖具有较高的提取率及纯度。此工艺方法简单高效、节约能源及试剂。综上,本方法适于在工业化生产中推广,从铁皮石斛中的提取得到的生物碱及多糖具有广阔的应用前景。
1 Lv GY(吕圭源),Yan MQ(颜美秋),Chen SH(陈素红).Review of pharmacological activities of Dendrobium officinale based on traditional functions.Chin J Chin Mater Med (中国中药杂志),2013,38:489-493.
2 Tu GC(屠国昌).Chemical composition,pharmacological effects and clinical applications of Dendrobium officinale.Strait Phar J (海峡药学),2010,22:70-71.
3 Sheng JR(盛家荣),Li ZH(李志华),Yi YB(易艳波),et al.Advances in the study of polysaccharide from Dendrobium officinale.J Guangxi Acad Sci (广西科学院学报),2011,04:338-340.
4 Zhou ST(周术涛),Lei ZL(雷志力),Yu QX(俞巧仙),et al.Study on the preferred extraction of polysaccharides from dendrobium cadidum with uniform design and orthogonal design.Sci Tech Food Ind (食品工业科技),2010,11:296-297.
5 Huang XJ(黄晓君),Nie SP(聂少平),Wang YT(王玉婷),et al.Optimized Extraction and compositional analysis of polysaccharides from dried stems of Dendrobium officinale.J Food Sci (食品科学),2013,22:21-26.
6 Wu Y(武芸),Deng JQ(邓洁群),Yang T(杨婷),et al.Optimization of extraction of water-soluble polysaccharides from tissue culture seedling of Dendrobium officinale.Nat Prod Res Dev (天然产物研究与开发),2013,12:1709-1714.
7 Hu JM(胡建楣),Li JL(李静玲),Feng P(冯鹏),et al.Optimization of enzymatic extraction of polysaccharide from Dendrobium officinale by Box-Behnken design and response surface methodology.Chin Med Mat (中药材),2014,01:130-133.
8 Li J(李娇),Rong YH(荣永海),Rong L(荣龙).Flash extraction of polysaccharide from Dendrobium officinale.Chin Med Mat (中药材),2013,09:1524-1527.
9 Liu J(刘静),Rong YH(荣永海),Wang ZB(王志滨),et al.Continuous extraction and separation of active ingredients of mangosteen.Chin Med Mat(中药材),2010,4:629-632.
10 Liao Y(廖怡),Rong YH(荣永海),Rong L(荣龙).Combined extraction of superoxide dismutase and catalase from earthworm Eisenia fetida.Nat Prod Res Dev (天然产物研究与开发),2012,11:1538-1544.
11 Shang GN(商桂娜),Rong YH(荣永海),Rong L(荣龙).Extraction and purification of GSH-Px from earthworm.Nat Prod Res Dev (天然产物研究与开发),2013,1:76-82.
12 Fan YN(樊懿娜),Zhao T(赵婷),Zhou Y(周叶),et al.Determination of polysaccharide content in Grifola frondosa by phenol-sulferic acid method.J Anhui Agri Sci(安徽农业科学),2011,25:15256-15257.
13 Peng F,Ren JL,Xu F,et al.Comparative study of hemicelluloses obtained by graded ethanol precipitation from sugarcane bagasse.J Agric Food Chem,2009,14:6305-6317.
14 Zhu Y(诸燕),Zhang AL(张爱莲),He BW(何伯伟),et al.Quantitive variation of total alkaloids contents in Dendrobium officinale.Chin J Chin Mater Med (中国中药杂志),2010,18:2388-2391.
