二羟基对苯二甲酸的合成研究进展
2015-01-09鲍春阳曹龙海王文彬
田 勇,鲍春阳,曹龙海,王文彬,于 振
(1.黑龙江省科学院 石油化学研究院,黑龙江 哈尔滨 150040;2.黑龙江省科学院 高技术研究院,黑龙江 哈尔滨 150020)
二羟基对苯二甲酸的合成研究进展
田 勇1,2,鲍春阳1,2,曹龙海1,2,王文彬1,2,于 振1
(1.黑龙江省科学院 石油化学研究院,黑龙江 哈尔滨 150040;2.黑龙江省科学院 高技术研究院,黑龙江 哈尔滨 150020)
二羟基对苯二甲酸类化合物是功能材料及医药等的重要原料中间体,具有良好应用前景。对2,5-二羟基对苯二甲酸、2,6-二羟基对苯二甲酸、2,3-二羟基对苯二甲酸三种化合物进行了合成方法的综述。以苯酚类化合物为起始原料,经Koble-Schmitt法的制备路线为此类化合物最常用合成方法,其工艺具有操作简便、安全,环境友好及适宜工业生产等特点。
二羟基对苯二甲酸;合成;Koble-Schmitt法
前言
对苯二甲酸(TPA)因其苯环类直链化合物的刚性,已成为高分子材料的重要合成单体,然而此类聚合物由于分子链上缺少如羟基类活性侧基,导致其材料的抗紫外性、复合粘结性及抗压性能并不理想。因此,以多羟基对苯二甲酸类化合物如某些二羟基对苯二甲酸化合物取代TPA作为聚合物单体,是对高分子材料的改性。二羟基对苯二甲酸类化合物已成为非常重要的一类有机中间体,广泛应用于药物和功能材料的合成,特别是高分子改性材料(如有机发光材料以及改性纤维PBO、M5、PBX等)方面,可以利用分子中的羟基构成的氢键来改善一些性能。二羟基对苯二甲酸类化合物兼具有对苯二甲酸类和类水杨酸类物质的性质,潜在的性能备受关注,展现出良好的应用前景。
本文探讨了2,5-二羟基对苯二甲酸(2,5-DHTA)、2,6-二羟基对苯二甲酸(2,6-DHTA)、2,3-二羟基对苯二甲酸(2,3-DHTA)三种二羟基对苯二甲酸化合物的合成方法。这三种化合物按起始原料不同,主要可由对苯二甲酸衍生物、苯酚衍生物以及环己二酮二甲酸二甲酯等为原料路线合成[1]。
1 环己二酮二甲酸二甲酯原料路线合成
由环己二酮二甲酸二甲酯出发的合成反应按如下方程式进行。
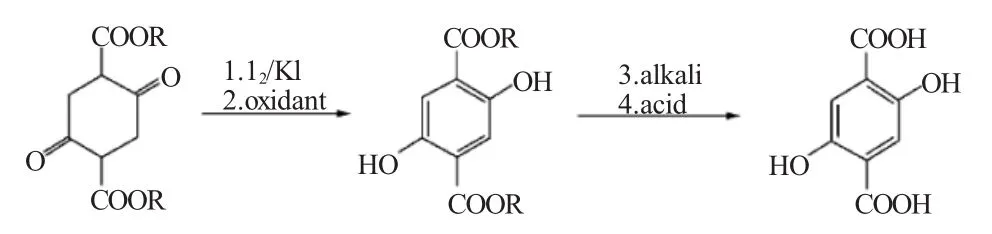
张首才等[2]以1,4-环己二酮-2,5-二甲酸二甲酯(DMSS)为原料,碘、碘化钾为催化剂,在双氧水作用下制备中间产品DMDHT。DMDHT在碱性环境下温度98℃反应1h,得到黄色粉末,提纯后得2,5-DHTA,收率高达83.29%,高效液相色谱分析产品纯度高达99.9%。
黄玉东等[3]以环己二酮二甲酸二甲酯为原料与极性溶剂混合,加入占环己二酮二甲酸二甲酯质量分数1%~10%碘和碘盐,反应30~40min后,在温度为80~100℃条件下,加入与原料物质的量比为1∶0.5~1∶3的氧化剂,反应3~6h,冷却至室温、过滤、去离子水水洗,将产物与水按1∶2~3的质量比混匀,再加入与产物物质的量比为1∶2~4的强碱水溶液,通氮气保护加热至90~100℃降到室温,然后再按与环己二酮二甲酸二酯物质的量比为1∶2~3的配比加入强酸,反应4~6h后降至室温,然后过滤、水洗,用混合溶剂重结晶、过滤,真空干燥10~24h得到2,5-DHTA,收率90%,纯度大于99%。专利中提到也可用该法制备2,6-DHTA,但未报道具体实验数据。该法在常压下就可以反应,制得产品纯度和收率较好。但起始原料环己二酮二甲酸二甲酯尚无商品供应;强酸、强碱对反应设备有所限制。
2 对苯二甲酸衍生物原料路线合成
以对苯二甲酸衍生物为原料,合成路线比较多,有生物发酵法、羟基自由基加成重排法、氨基对苯二甲酸重氮化水解法、卤代物水解法等。但是工业化均有一定的难度,如生物发酵法容易造成二次污染,羟基自由基加成重排法反应设备较复杂,氨基对苯二甲酸重氮化水解法路线长、条件苛刻,卤代物水解法精制后处理比较麻烦。
2,5-二卤代对苯二甲酸在碱的水溶液中生成相应的2,5-二卤代对苯二甲酸二元盐,2,5-二卤代对苯二甲酸二元盐在弱碱性条件下与水中的铜配体和碱反应生成2,5-二羟基对苯二甲酸二元盐,再在酸性条件下将其转化为2,5-DHTA。如Ritter[4]以2,5-二溴对苯二甲酸为原料,在N2气保护下,于Na2CO3水溶液中,用CuBr与外消旋N,N'-二甲基环己烷-1,2-二胺的配合物为催化剂,制得2,5-DHTA,纯度81%(1HNMR法),收率72%。
在氢氧化钾碱性和铜粉做催化剂的条件下利用苯酚和2,5-二溴对苯二甲酸(DBTA)的缩合可制备2,5-DHTA。而2-氨基对苯二甲酸二甲酯在碱性条件下水解为2-氨基对苯二甲酸后进行重氮化反应,再将产物在酸性条件下水解也能合成2,5-DHTA。
3 苯酚衍生物原料路线合成
以苯酚衍生物为原料合成羟基对苯二甲酸类化合物多采用Koble-Schmitt法进行。首先苯环上羟基与氢氧化钾或碳酸钾反应生成钾盐,然后再与二氧化碳发生亲电取代而在芳环上引入羧基,最后经酸化而得目标产物。
3.1 Koble-Schmitt法合成2,3-DHTA
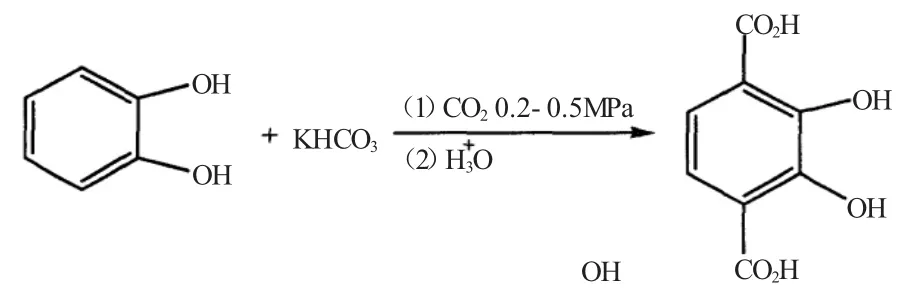
1944年Weizmann等首先用Kolbe-Schmitt法由间甲氧基苯酚钠盐制得2,3-DHTA。Weizmann和Cason各自由邻苯二酚出发,在反应温度210℃以上时,都合成了高选择性的2,3-DHTA。当CO2压力为7~14MPa,反应温度225℃,反应8h,收率可达81%。
2004年雷光东等[5]在较低CO2压力下用Kolbe-Schmitt法合成了2,3-DHTA:邻苯二酚与碳酸氢钾物质的量配比为1∶2~1∶4,CO2压力0.2~0.5MPa,190~210℃反应3~5h。冷却后用水溶解,盐酸调pH值至2~3,再在n(乙醇)∶n(乙醚)=3∶1混合溶剂中重结晶制得2,3-DHTA,收率62%以上。合成反应式如下所示。
3.2 Koble-Schmitt法合成2,5-DHTA
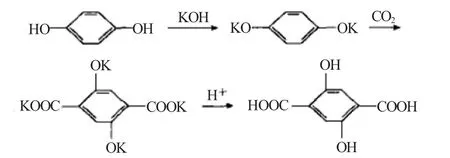
1974年Komoriya等将对苯二酚与KOH和K2CO3混合后通CO2至5.0MPa,210℃反应5h,反应物加水溶解后调pH值至中性,用乙酸乙酯萃取分出未反应的对苯二酚后加酸析出2,5-DHTA。纯度大于99.5%,收率为36.87%。1997年Sikkema等[6]将对苯二酚、K2CO3和HCOOK按物质的量比为1.1∶1∶2.04混合后,通CO2气至压力0.12MPa,200℃反应4h。反应混合物用约50倍(与对苯二酚的质量比)0.5%亚硫酸钠水溶液溶解后,加盐酸析出亮黄色目标产物,2,5-DHTA的粗收率几乎达100%。
2007年漆琳等[7]以正辛烷为溶剂,对苯二酚、氢氧化钾、碳酸钾与CO2通过Kolbe-Sehmitt反应合成2,5-DHTA。在温度220℃,压力11.5MPa、搅拌速率400r/min等条件下反应4h,2,5-DHTA的收率可达76.52%。反应历程如下:
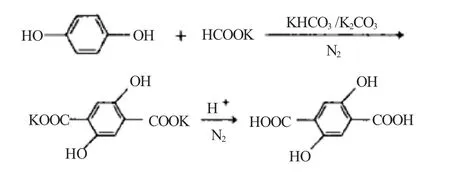
孙硕等[8]用对二甲苯为溶剂、对苯二酚和碱金属碳酸盐及碱金属碳酸氢盐作为原料,在N2的气氛和一定压力下制备2,5-DHTA。反应方程如下:
美国专利[9]提出在中性溶剂中制备2,5-DHTA,收率在65%~90%以上,主要缺点是反应压力高达8~11MPa。
3.3 Koble-Schmitt法合成2,6-DHTA
以3,5-二羟基苯甲酸为原料可按Kolbe-Schmitt法制备2,6-DHTA[10~11]。将1份3,5-二羟基苯甲酸、2份K2CO3、6.25份甘油和1.25份干冰混合后,通CO2气体至压力为8.0 MPa,150℃反应16h。反应物加水溶解后用酸调pH为酸性用Et2O-EtOAc萃取,以饱和食盐水洗涤后,蒸出Et2O-EtOAc,真空干燥得0.5份2,6-DHTA。
2015年王坤等[12]采用常压Koble-Schmitt反应制备2,6-DHTA。将碳酸钾、水加热搅拌均匀后,滴加甲酸。反应2h后,蒸出水,再向里面加入与甲酸钾的质量比为1∶4.36的3,5-二羟基苯甲酸,碳酸钾,通入二氧化碳,在180~190℃下反应4h。待冷却后,用亚硫酸钠的热水溶液溶解反应物,用活性炭脱色,调节pH值,用酸碱中和精制,酸洗得到浅黄色的2,6-DHTA。收率为83.32%。
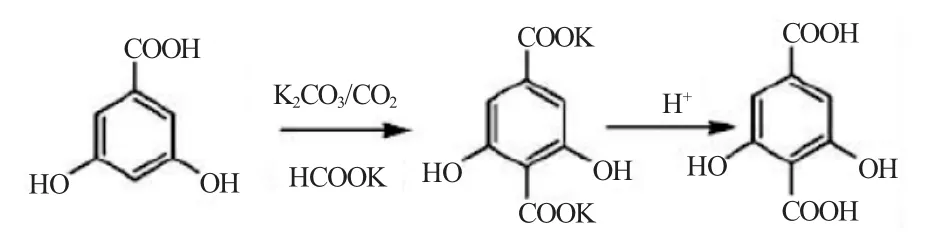
上世纪50年代Hauptschein等[13~15]采用5-三氟甲基间苯二酚为原料,先经Kolbe-Schmitt反应进行羧化,然后用硫酸水解得到2,6-DHTA。5-三氟甲基间苯二酚、K2CO3在通入CO2压力达到约2.05MPa下,反应温度由室温缓慢升至220℃,反应10h。反应物用热水溶解后调pH值至6后用醚萃取,活性炭脱色后酸析得到4-三氟甲基-2,6-二羟基苯甲酸,将上步产物在硼硅管中与浓硫酸一起加热水解为羧基后,在乙醇和水中重结晶得到2,6-DHTA。
2014年赵德明等[16]以3,5-二羟基苯甲酸为原料,常压下经Kolbe-Schmitt反应得2,6-DHTA。在甲酸钾熔融状态下,m(3,5-二羟基苯甲酸)∶m(甲酸钾)=1∶5.46,反应温度180~190℃,反应时间4h,收率87.32%,质量分数为99.62%。
3.4 苯酚衍生物合成DHTA的其他方法
氧化脱保护法:1940年Hans等以3,6-二甲基邻苯二酚为原料,先将其酚羟基用硫酸二甲酯甲醚化得到2,3-二甲氧基对二甲苯,再用KMnO4氧化为2,3-二甲氧基对苯二甲酸,最后在48%HBr溶液中加热将甲醚酸解得2,3-DHTA。该方法路线长,环境污染重,工业化比较困难。
羟基苯腈水解法:1954年Loudon等以硫代丙二腈和草酸单乙酯在乙醇钠存在下进行环合反应得到2,3-二羟基对苯二腈,然后在50%氢氧化钠水溶液中水解酸化得到2,3-DHTA。
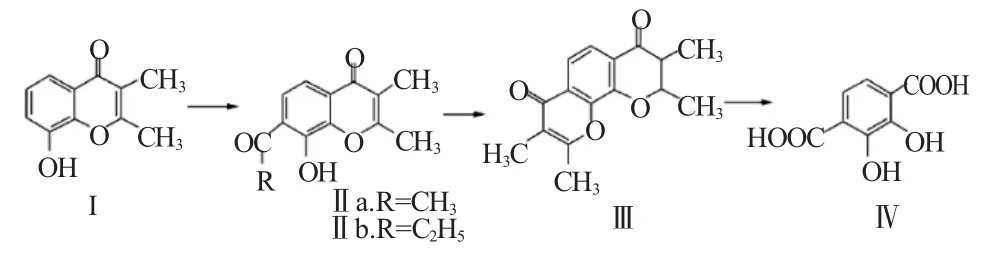
水解开环法:1962年Paolo等以8-羟基-2,3-二甲基苯并-γ-吡喃酮(Ⅰ)为原料,与氯化铵丙酸酰基化反应得Ⅱb;化合物Ⅱb再与无水乙酸钠和乙酸酐在180℃环合反应8h,过滤、干燥、乙醇重结晶得无色晶体Ⅲ;最后将化合物Ⅲ在20%KOH水溶液中回流20h水解开环反应,酸析得目标产物2,3-DHTA,总收率10.5%。该方法的缺点是原料价格高,反应时间长,收率低。
4 结束语
比较上述合成二羟基对苯二甲酸的方法可发现,Kolbe-Schmitt法是制备2,5-DHTA、2,6-DHTA以及2,3-DHTA的通用合成方法。Kolbe-Schmitt法虽然需用压力反应设备,反应时间也较长,但由于原料易得,后处理简便,条件加以优化可以实现工业化,是最具工业前景的生产路线。随着材料和制药等行业的发展,二羟基对苯二甲酸类化合物展现了良好的应用前景,需求逐年增长。目前这几种化合物多以试剂级供应,因此应加快其工业化合成技术的研发。
[1] 张建庭,王坤,赵德明,等.多羟基对苯二甲酸类化合物的合成与应用研究进展[J].应用化学,2010,(11):1241~1250.
[2] 张首才,林险峰.2,5-二羟基对苯二甲酸的合成与表征[J].吉林师范大学学报(自然科学版),2013,(4):8~11.
[3] 黄玉东,林宏,王峰,等.二羟基苯二甲酸的制备方法:CN, 101239905A[P].2008-03-19.
[4] RITTER J C.Process for the synthesis of 2,5-dihydroxyterephthalic acid:US,7335791[P].2006-11-28.
[5] 雷光东,卢志云,谢明贵.4,6-二羟基-1,3-苯二甲酸和2,3-二羟基-1,4-苯二甲酸的一步合成方法:CN,1634849A[P]. 2004-09-30.
[6] SIKKEMA D J,REICHWEIN A M.process for dicarboxylating dihydric phenols:WO,9717315[P].1997-05-15.
[7] 漆琳,沈玉堂,殷恒波,等.2,5-二羟基对苯二甲酸的合成及表征[J].精细石油化工,2007(1):23~25.
[8] 孙硕,黄玉东,林宏,等.2,5-二羟基对苯二甲酸的合成研究[J].化学与黏合,2007(6):413~415.
[9] OETZE JAKOB SIKKEMA.Process for Dicarboxylating Dihydric Phenols:US,6040478[P].2000-03-21.
[10] GRAY J S,MARTIN G C J,RIGBY W.Aurofusarin[J].J Chem Soc,1967(5):2580~2587.
[11] HARRIS C M,KIBBY J J,FEHLNER J R,et al.Amino Acid Constittuents of Ristocetin A[J].J Am Chem Soc,1979,(2):437~ 445.
[12] 王坤,吴狄,胡启山.有机中间体2,6-二羟基对苯二甲酸的合成工艺优化[J].四川文理学院学报,2015(2):29~32.
[13] HAUPTSCHEIN M,NODIFF E A,SAGGIOMO A J.Trifluoromethyl Derivatives of Hydroxybenzoic Acids and Related Compounds[J].Journal of the American Chemical Society,1954(4):1051~1054.
[14] HAUPTSCHEIN M,SAGGIOMO A J,STOKES C S.Trifluoromethylaminosalicylic Acids and Related Reactions[J].Journal of the American Chemical Society,1955(8):2284~2287.
[15] HAUPTSCHEIN MURRAY.4-Trifluoromethylsalicylic Acids and their Preparation:US,2894984[P].1958-05-15.
[16] 赵德明,王臣栋,宋嘉彬,等.2,6-二羟基对苯二甲酸的合成及酯化反应研究[J].浙江工业大学学报,2014,(6):627~631.
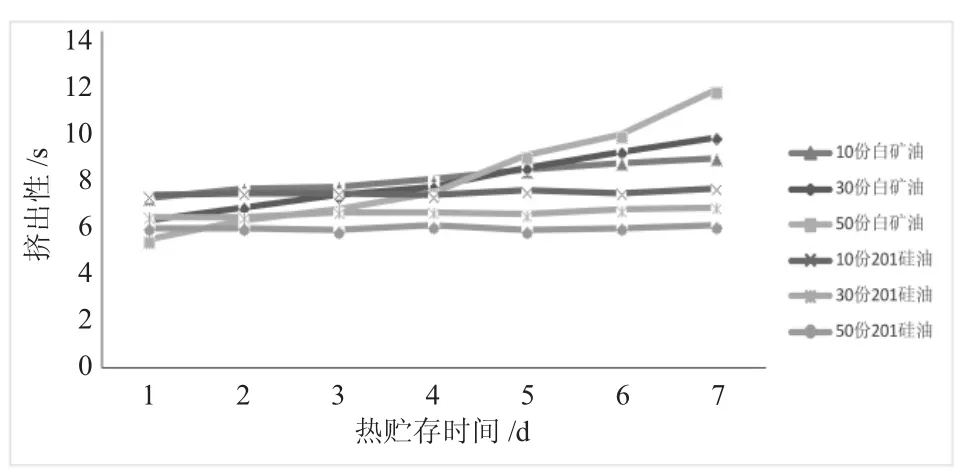
图2 试样80℃条件下挤出性曲线Fig.2 The extrusion curves of the samples at 80℃
由图2可以看出,白矿油做增塑剂时,试样热贮后的挤出时间随热贮时间的增加而逐渐增加,且白矿油的添加量越大,挤出时间增加越久,挤出性越差;201硅油做增塑剂时,试样热贮后挤出时间随时间变化不明显,相对比较稳定,但随201硅油添加量的增加,挤出时间会变长,挤出性变差。导致以上情况可能是白矿油在热贮过程中从胶体中渗出挥发,使试样的性能变差。
综上所述,添加增塑剂白矿油或201硅油均会影响贮存稳定性,添加量越大,试样贮存稳定性越差。
3 结论
(1)白矿油添加量在一定范围内可代替201硅油做硅酮密封胶增塑剂,在本实验配方中,其添加量不应超过50质量份,避免试样性能达不到标准要求。
(2)白矿油代替201硅油做通用中性硅酮密封胶增塑剂,制成的试样在常温下质量损失较明显,导致体积有所收缩、邵氏硬度上升,拉伸性能下降,热老化性,施工性和贮存稳定性变差,直接影响品质和档次。
(3)不推荐在通用中性硅酮密封胶中添加白矿油做增塑剂,降低成本的同时必须保证产品的品质。
参考文献:
[1] 来国桥,幸松民.有机硅产品合成工艺及应用[M].北京,化学化工出版社,2000:9.
[2] 马启元.我国建筑密封胶近期进展[J].中国建筑防水,1999(4): 5~7.
[3] 全文高,陈炳耀,胡小康,等.不同生产工艺对中性硅酮密封胶性能的影响[J].粘接,2013,10:72~74.
[4] 王跃林,王洪敏,张恒.有机硅建筑密封胶标准进展[J].有机硅材料,2001,15(5):25~32.
The Progress in Synthesis of Dihydroxyl Terephthalic Acid
TIAN Yong1,2,BAO Chun-yang1,2,CAO Long-hai1,2,WANG Wen-bin1,2and YU Zhen1
(1.Institute of Petrochemistry,Heilongjiang Academy of Sciences,Harbin 150040,China;2.Institute of Advanced Technology,Heilongjiang Academy of Sciences,Harbin 150020,China)
The dihydroxyl terephthalic acids are the important intermediate raw materials for the synthetic functional materials and medicines which have an excellent application prospect.The synthesis methods of three typical chemicals(2,5-DHTA,2,6-DHTA and 2,3-DHTA)are summarized.The preparation process of dihydroxyl terephthalic acid by Koble-Schmitt reaction with using phenol-type substances as starting materials is the common synthesis method,which has some advantages such as simple operation,safety,environment friendly and it is suitable for industrial production.
Dihydroxyl terephthalic acid;synthesis;Koble-Schmitt method.
TQ322.97
A
1001-0017(2015)06-0451-04
2015-08-06
田勇(1973-),男,黑龙江桦南人,硕士,研究员,主要从事有机合成方面的研究。
