离心去除精浆对绒山羊细管冻精品质的影响
2015-01-08杨军祥谢文章执笔
薛 健,于 轩,杨军祥,谢文章,王 珂,*(执笔)
(1.甘肃省畜牧兽医研究所,甘肃 平凉744000;2.甘肃省畜牧管理局;3.甘肃省环县畜禽改良站)
利用陇东优质高产绒山羊种公羊精液,通过人工授精技术改良当地绒山羊是目前培育陇东绒山羊新类群的最有效的手段之一,推广优质细管冻精可以显著提高当地绒山羊品种质量,而冻精活力是影响受胎率关键因素。目前羊的细管冻精活力不高,是制约羊细管冷冻精液推广应用的关键因素。在国内,1981年中国农业科学院畜牧所冷冻山羊冻精试验取得成功,赵晓娥等在制作波尔山羊的细管冷冻精液时,采用离心去除掉精浆,获得了良好的冷冻效果。通过参考山羊精液冷冻保存关键技术和研究成果,本试验对陇东绒山羊精液采取离心去除精浆,稀释后细管封装,液氮熏蒸冷冻,以期提高陇东绒山羊细管冻精的活力。
1 材料与方法
1.1 试验羊的选择
选择2~3岁,体质健康,性欲旺盛的陇东优质绒山羊种公羊3只,饲养在甘肃省畜牧兽医研究所实验羊场,受体母羊为环县普通陇东绒山羊。
1.2 试剂药品及仪器
葡萄糖、柠檬酸、三羟甲基氨基甲烷(Tris)均为国产分析纯,青霉素,链霉素均哈尔滨制药厂产品。卵黄为市场购买的新鲜鸡蛋中抽取,冷冻液氮槽为自制,移液枪(德国Eppendorf),显微镜(日本NIKON)。
1.3 精液制备
采用假阴道法采精,每只公羊每日采精液2次,间隔15min,将两次所采同一试验种公羊的精液混合,平均每只羊采精量为1.5mL左右,密度在22.5亿/mL,鲜精活力在0.75以上。通过观感和镜检后进行第一次基础液稀释。
1.4 稀释液配方
基础液:蒸馏水100 mL,Tirs 3.32g,柠檬酸1.82g,葡萄糖1.0g,青霉素1 000万IU,链霉素1 000μg;稀释I液:取基础液80mL加入20mL卵黄;稀释II液:取I液46mL,加入甘油4mL。冷冻稀释液的甘油最终浓度为4%。
1.5 稀释冷冻
将采集的精液进行显微镜检测,按试验设计进行离心处理。预先将稀释I液在36 ℃水域中平衡10min,按体积比1∶4稀释处理的精液,用16层纱布包裹,在4 ℃冰箱缓慢降温平衡60min后,使之与等温平衡的稀释II液等倍稀释混合,然后再平衡60min,在4 ℃低温下用0.25mL麦管封装。将封装好的细管精液至于冷藏架上,在4 ℃冰箱置留30 min,准备在冷冻槽中采用液氮熏蒸冷冻。
1.6 试验设计
将采集的新鲜精液分为3份,第1份(对照组)精液不做离心处理;第2份(试验组1)为离心去除分精浆,精液按体积比1∶5加入基础液稀释后离心(1 250r/min、6 min),然后去掉一半上清;第3 份(试验组2)为离心完全去精浆组,精液按体积比1∶5加入基础液稀释,直接离心(1 250r/min、6min),反复离心3次,全部除去精浆。
1.7 精子品质的检测及指标
冷冻细管从液氮罐中取出后,空气浴5s,迅速投入38 ℃温水中10s解冻。目测评估活力(简称估测):为便于在显微镜下计数,用移液枪取5μL待测精液,滴在载玻片,加上盖玻片,置于显微镜下放大400倍检查,计数一个视野下直线前进运动精子与非直线运动精子的比例,求出活率。
精子顶体完整率的检测:细管冻精解冻后,取10μL 精液滴于载玻片的左端,用另一张边缘光滑的载玻片呈35°角自右面接触液滴,拉向另一侧,制成抹片。自然风干5~10min后,用福尔马林磷酸盐固定液固定15 min,水洗干燥后,用姬姆萨染色90min,蒸馏水冲洗,干燥,在400倍显微镜下观察300个精子,统计顶体完整的精子数。每次至少计算200个精子。
精子活率(%)=直线前进运动精子数/总精子数×100%
精子顶体完整率(%)=顶体完整的精子总数/所数总精子总数×100%
1.8 数据处理
各项指标数据以平均数±标准差表示,采用SPSS19.0软件对数据进行方差分析。
2 结果与分析
2.1 离心对陇东绒山羊精子活力的影响
随机抽取不同批次中每个组别的9支细管检验活率,各阶段精子活率由表1可见。应用基础液洗涤法除去精浆后及在降温平衡后,对照组、试验组1和试验组2 之间精子活率差异均不显著(P >0.05)。但冷冻后试验组1与对照组、试验组2之间活率差异极显著(P<0.01),活率为33.41%,基本接近人工授精精子活率要求。
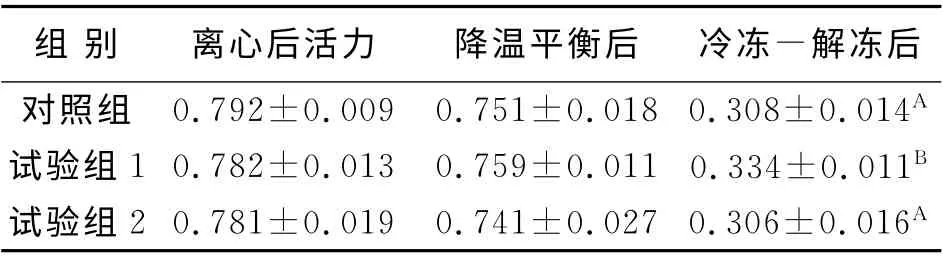
表1 不同处理后精子活率的比较
2.2 离心对陇东绒山羊精子顶体完整率的影响
抽取方法同上,由表2知,在离心后精子的顶体完整率相比差异不显著(P>0.05),降温平衡后不同处理间顶体完整率差异显著(P<0.05),解冻后试验组2与对照组和试验组1相比差异显著(P<0.05)。
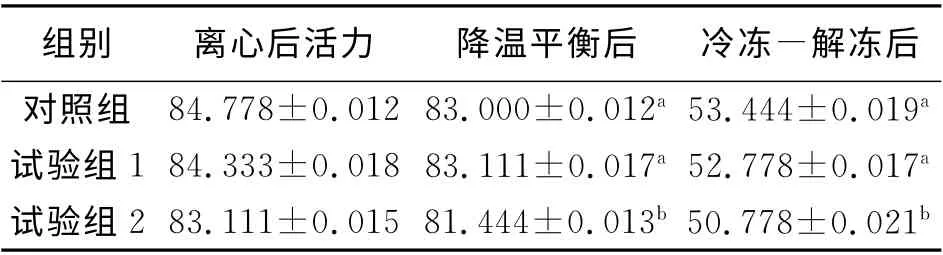
表2 不同处理后精子顶体完整率比较
2.3 离心对受体母羊受胎率的影响
细管冻精人工授精在环县进行,挑选散户饲养的陇东绒山羊作为受体母羊,在自然发情条件,随即抽取细管冻精,进行人工授精(人工授精次数为一次)。经过统计分析,细管冻精母羊受胎率对照组为46.15%,试验组1为49.33%,试验组2为46%,组间差异不显著(P>0.05)。
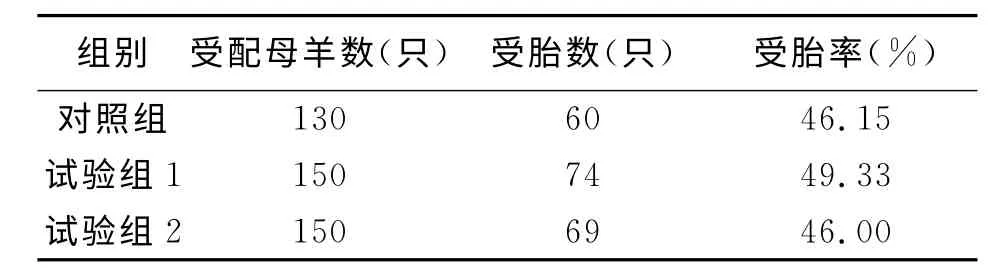
表3 不同处理后细管冻精受胎率比较
3 讨论
精液是由精子和精浆两部分组成,两者的成份分各不相同。精浆的成份分应适合精子的生存,两者之间要求取得一定平衡状态,否则精子便受到损害。因此,充分了解精液的生理、生化特性和它们之间的相互关系,有助于研究精子在冷冻过程中的变化,以进一步提高冷冻精液活力和受胎率。哺乳动物的精浆充当着精子载体,稀释精子和为精子提供代谢物质的功能,同时精浆某些蛋白质成分,如去能因子、山羊卵黄凝结酶等,抑制精子的获能、顶体反应的发生、诱导顶体酶的提前释放,从而影响精子活力和受胎率。因此,在精子的冷冻保存等体外处理过程中有必要对精浆的性质加以考虑,对精浆的副作用了解,利于进一步了解冷冻保存对精子造成的伤害及其原因,从而改进冷冻保存方法,提高细管冷冻精液品质。
在本研究中,除去部分精浆组后冷冻的精子活率、顶体完整率检测指标均优于未离心组和完全除去精浆组,同时除去部分精浆组后受体母羊的受胎率高于其它组,这一结果同kisopatron和Ashworth的研究结果一致,这表明去除精浆后对冷冻后精子品质有明显提高作用;另外,Jasko等以500r/min离心18min除去稀释过的精浆后可显著提高马的精子活力和运动速度。精浆中一些类似Zn2+的自由离子、游离氨基酸及过氧化物之类也能削弱精子的一些生理功能,而通过离心处理也能降低此类成分的含量,从而提高精液的冷冻效果。保留部分精浆进行降温平衡处理,精浆中的一些有益蛋白质成分也可能与精子膜结合,从而降低精子细胞膜在整个冷冻过程中遭受损伤机率,并有助于维持冷冻精子的膜完整性。一些研究认为,除去精浆对提高精子品质有利,但对不同除去精浆方法的效果却存在不同观点。在本研究中,利用离心法洗涤精液除去部分精浆,解冻后精液品质试验组明显优于对照组。但Maxwell等认为,离心会严重伤害精子,导致精子活力下降。Harrison提出在Ficoll液中离心可除去精浆并对精子的机械性损伤最小,这种损失随离心力、离心液及离心后剩余精浆浓度而不同。本试验从冻后活率来看,明显高于未离心的细管冻精;从受胎率来看,去除部分精浆的细管冻精高于为未离心的细管冻精。由此可见,1 250r/min离心法是一种有效的去除精浆途径,提高陇东绒山羊细管冻精活率及受体母羊受胎率的有效方法。
[1] 薛科邦,周步峰,张建军,等.陇东优质高产绒山羊选育的研究[J].畜牧兽医杂志,2011,30(3):11-13.
[2] 杨凌,桑润滋,张会文.羊精液冷冻保存技术研究进展[J].中国草食动,2004,24(1):49-51.
[3] 赵晓娥,王光亚,马保华.布尔山羊细管冷冻精液研究初报[J].西北农业大学学报,1999,27(1):19-22.
[4] 马毅.波尔山羊除精浆冷冻精液机理的研究[D].陕西杨凌:西北农林科技大学,2002.
[5] 杨军祥.除去精浆对波尔山羊冷冻精液品质的影响[J].中国草食动物,2009,29(2):22-24.
[6] 朱士恩.家畜繁殖学[M].北京:中国农业出版社,2009.
[7] Tulip K,Holtz W.Effect of glycerolization procedure and removal of seminal plasma on post-thaw survival and GOT release from boer goat spermatozoa[J].Theriogenology,1994,42(3):547-555.
[8] Jiang Z L,Li Q W,Li W Y,et al.Effect of low density lipo-protein on DNA integrity of freezing-thawing boar sperm byneutral comet assay[J].Animal Reproduction Science,2007,99(3-4):401-407.
[9] Centurion F,Vazquez J M,Calvete J J,et al.Influence of Porcine Spermadhesins on the Susceptibility of Boar Spermatozoa to High Dilution[J].Biology of Reproduction,2003,69:640-646.
[10] Garcia M A,Graham E F.Dialysis of bovine semen and its effect on fresh and freeze-thawed spermatozoa[J].Cryobiology,1987,24(5):446-454.
[11] Manaskova P,Balinova P,Kraus M,et al.Mutual interactions of boar seminal plasma proteins studied by immuno-logical and chromatographic methods[J].American Journal of Reproductive Immunology,2003,50(5):399-410.
[12] Maxwell W M C,Welch G R,Johnson L A.Aialility and membrane integrity of spermatozoa after dilution and flow cytometric sorting in the presence or absence of seminal plasma[J].Reprod.Fertil.Develop,1997(8):1165-1178.
[13] Azeredo G A,Esper C R,Resende K T.Evaluation of plasma membrane integrity of frozen-thawed goat spermatozoa with or without seminal plasma[J].Small Ruminant Research,2001(41):257-263.
[14] 杨凌,桑润滋,张乐颖,等.离心处理对波尔山羊冻精品质 的 影 响[J].湖 北 农 业 科 学,2006,45(2):223-225.
