类芽孢杆菌BD3526 抑菌活性物质的初步分离及性质测定
2015-01-08刘玉娟刘振民郭本恒吴正钧
刘玉娟,韩 瑨,吴 江,刘振民,郭本恒,吴正钧*
1乳业生物技术国家重点实验室 光明乳业股份有限公司,上海 200436;2 上海海洋大学食品学院,上海 201306
类芽孢杆菌属(Paenibacillus sp.)细菌是广泛存在于自然界,好氧或兼性厌氧、产生抗逆性内生孢子的杆状细菌,其生理特性丰富多样,是土壤和植物微生态优势种群之一。类芽孢杆菌原属于芽孢杆菌属,1994 年Ash 等[1]基于分子生物学的研究结果,将其从芽孢杆菌属中独立出来,成立类芽孢杆菌属。类芽孢杆菌属的菌株在生长过程中,能产生耐热抗逆的芽孢,有利于其在环境中存活、定殖与繁殖,在产品开发中因较非芽孢杆菌属细菌有效活菌数量高、性能稳定等优势而备受瞩目,是芽孢杆菌中比较具有应用潜力的菌种之一[2]。其中某些菌株也是重要的植物生防细菌和植物根际促生菌,并且在农业领域已得到广泛的应用[3]。
类芽孢杆菌中的某些菌株,在代谢过程中可产生如多糖、酶、拮抗蛋白、抗生素、植物激素、絮凝剂等多种生物活性物质[4],这些活性物质在环境治理、植物病害防治以及畜牧业方面具有诱人的应用前景。在其产生的抑菌物质中,最主要的是多粘菌素(polymyxin),它是由多种氨基酸和脂肪酸组成的碱性脂肽类抗生素,有A、B、C、D、E 五中类型,分子量都在1200 Da 左右,对G-菌有明显抑制作用[5]。目前研究较多的是多粘菌素B,它除了对G-菌有明显杀菌作用外,还能对其产生的内毒素有一定的抑制作用,但由于其本身的肾毒性和神经毒性,一度限制了它在临床上的应用[6]。还有一类尚未统一命名,它们都含有一个稀有脂肪酸侧链,即15-胍基-3-羟基十五烷酸(GHPD),这类物质主要包括gatavalin,fusaricidins A、B、C、D 或LI-F 系列抗生素[7],分子量大都是900 Da 左右,对白色念珠菌、酿酒酵母菌、黑曲霉、米曲霉、尖孢镰刀菌、金黄色葡萄球菌、单增李斯特菌等具有很好的拮抗作用。
本文对Paenibacillus sp.BD3526 产生的类细菌素抗菌物质进行了研究,为今后该菌在医药、食品和饲料加工等领域的应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 菌种
本实验所用拮抗菌为Paenibacillus sp.BD3526(CGMCC 8333=DSM 28815),是从西藏地区耗牛奶中分离得到。指示菌为金黄色葡萄球菌(Staphylococcus aureus)CGMCC1.879,藤黄微球菌(Micrococcus luteus)CGMCC1.1848,单增李斯特菌(Listeria monocytogenes)CGMCC1.9136,均由乳业生物技术国家重点实验室提供。
1.1.2 培养基
TYC 培养基(g/L;酪朊水解物15 g,酵母抽提物5 g,蔗糖50 g,无水乙酸钠20 g,NaCl 1 g,NaHCO32 g,无水Na2SO40.1 g,L-胱 氨 酸0.2 g,Na2HPO4·12H2O 2 g);营养肉汤(g/L;蛋白胨10 g,牛肉膏3 g,氯化钠5 g),固体培养基加入1.2%的琼脂,培养基121 ℃高压灭菌15 min 后备用。
1.1.3 酶的品种及编号
胰蛋白酶(1800 U/mg,Sigma,CAS:9002-07-7),胃蛋白酶(427 U/mg,Sigma,CAS:9001-75-6),脂肪酶(400 U/mg,Sigma,CAS:9001-62-1),蛋白酶K(30 U/mg,Sigma,CAS:39450-01-6),链霉蛋白酶(3.5 U/mg,Sigma,CAS:9036-06-0)。
1.2 实验方法
1.2.1 菌种的培养
拮抗菌株的培养:将预先保藏的菌种BD3526接种至TYC 固体平板上,30 ℃培养3 d,菌种活化两代备用。指示菌的培养:指示菌接种于LB 固体平板上,37 ℃培养24 h,挑取单菌落于15 mL 营养肉汤中,37 ℃,180 rpm,培养20 h,菌液稀释备用。
1.2.2 抑菌活性的测定
采用点种法[8]。培养好的指示菌菌液,与营养琼脂混合均匀,使最终指示菌浓度为105cfu/mL,将培养基倒入平板中,待其表面水分蒸发完全后,吸取10 μL 待测样品滴加在指示菌平板上,37 ℃培养24 h,观察结果。根据抑菌圈的大小判断样品活性强弱。
1.2.3 MIC 的测定
最低抑菌浓度是衡量抑菌物质性能的一个关键指标。本实验采用倍半稀释法对待测样品进行稀释,将样品稀释到原溶液浓度的1/2、1/4、1/8、1/16、1/32,分别滴加到指示菌平板上,观察抑菌圈的出现情况,能抑制培养基内指示菌生长的最低浓度则为该样品的MIC 值[9]。
1.2.4 抑菌率的测定
无菌96 孔板中依次加入50 μL 初步纯化样品、180 μL LB 培养基、20 μL 指示菌菌液,使最终样品孔中菌浓为105cfu/mL,以无菌水代替样品作为对照。混匀后置于37 ℃恒温培养箱中培养,每隔1 h用酶标仪(Spectra M5,Molecular Devices)测定OD600值[10],共测量18 h。抑菌率按下式计算:

式中,A 为对照组OD600值,A1 为样品组OD600值。
1.2.5 样品的纯化
将平板上菌体刮下,加入丙酮浸提1 h,连续浸提3 次,将3 次浸提液合并,9000 rpm,10 min,4 ℃离心取上清,去除有机溶剂,真空冻干,得到含有抑菌活性物的粗品。冻干后的粗品用甲醇复溶配成浓度为100 mg/mL 的溶液,经0.22 μm 微孔滤膜过滤后,通过Sephadex LH-20 分离,甲醇洗脱,流速为0.6 mL/min,每150 s 收集一管,共收集2 个柱体积。分别检测各管抑菌活性,收集活性组分。
1.2.6 热稳定性测定
将初步纯化的样品用纯水配成2 mg/mL 溶液,分别吸取0.5 mL 样品,置于50、60、70、80、90 ℃水浴中保温2 h,沸水浴15 min,121 ℃条件下处理5 min,以未经热处理的样品作对照,检测抑菌活性。实验设三个平行,并比较组间差异性大小。
1.2.7 pH 适用范围的测定
称取初步纯化样品0.5 mg,分别溶解在pH 3、pH 4、pH 5、pH 6、pH 7、pH 8、pH 9、pH 10 的磷酸盐缓冲溶液中,配成浓度为2 mg/mL 的溶液,检测抑菌活性,以pH 7 样品作对照,比较不同pH 条件下抑菌圈大小。实验设三个平行,取平均值比较差异性大小。
1.2.8 蛋白酶敏感性测定
4 mg/mL 样品溶液分别调节至各酶的最适pH,以1∶3 的比例将酶与样品溶液混合,使酶最终浓度为1 mg/mL,将混合液在37 ℃水浴中保温2 h,调节pH 至中性,以加入同等体积的磷酸盐缓冲溶液样品作为对照,检测抑菌活性[11]。
1.2.9 统计学分析
采用SPSS 21.0 统计软件处理实验数据,单因素方差分析进行显著性实验,并用LSD-t 进行组间差异性比较,P<0.05 表示差异显著具有统计学意义。
2 结果与分析
2.1 样品的纯化
微生物代谢产物大部分是分泌到周围环境中,但也有少数物质是粘附在菌体表面[12]。Paenibacillus sp.BD3526 在发酵过程中,已经证实其产生的抑菌活性物质,既粘附在菌体表面,也分泌到周围环境中。实验初期阶段,以菌体发酵液为研究对象,对抑菌物质进行分离纯化,由于在发酵过程中,受温度、时间、通氧量等影响,检测到抑菌活性不稳定。所以粗提物的制备直接选用菌体,经有机溶剂浸提,再减压去除溶剂后,冷冻干燥,得到抑菌活性物质粗品C。
粗品C 甲醇复溶通过Sephadex LH-20 分离,洗脱曲线见图1,其中第72 管至78 管,即洗脱体积为柱体积的3/5~4/5 时,活性组分流出。为了尽量减少杂质的带入,获得较高纯度的目的物质,选择73、74、75、76、77 五管合并,作为初步纯化后活性组分P。

图1 Sephadex LH-20 洗脱曲线Fig.1 Elution chromatogram of the antimicrobial components of BD3526 on Sephadex LH20
2.2 MIC 的测定
抑菌物质粗品C 纯水复溶,倍半稀释法配成以下浓度:200、100、50、25、12.5、6.25 mg/mL;Sephadex LH-20 初步纯化后的抑菌物质活性组分P 纯水复溶,倍半稀释法配成以下浓度:8、4、2、1、0.5、0.25 mg/mL,以金黄色葡萄球菌CGMCC1.879,藤黄微球菌CGMCC1.1848,单增李斯特菌CGMCC1.9136 为指示菌检测抑菌活性,结果见表1 和表2。由表1和表2 可知,粗品浓度为12.5 mg/mL,Sephadex LH-20 纯化样品浓度为1 mg/mL 时,藤黄微球菌CGMCC1.1848 未有长出;粗品浓度为25 mg/mL,SephadexLH-20 纯化样品浓度为2 mg/mL 时,金黄色葡萄球菌CGMCC1.879 和单增李斯特菌CGMCC1.9136未有长出,由此得出,粗品对藤黄微球菌CGMCC1.1848 的MIC 是12.5 mg/mL,对金黄色葡萄球菌CGMCC1.879 和单增李斯特菌CGMCC1.9136 的MIC 值为25 mg/mL;Sephadex LH-20 纯化样品对藤黄微球菌CGMCC1.1848 的MIC 是1 mg/mL,对金黄色葡萄球菌CGMCC1.879 和单增李斯特菌CGMCC1.9136 的MIC 值为2 mg/mL。经过SephadexLH-20 分离,样品的MIC 值缩小了12.5 倍,表明样品得到了有效的纯化。

表1 粗品各浓度抑菌活性Table 1 Antimicrobial activity of crude extracts with different concentrations
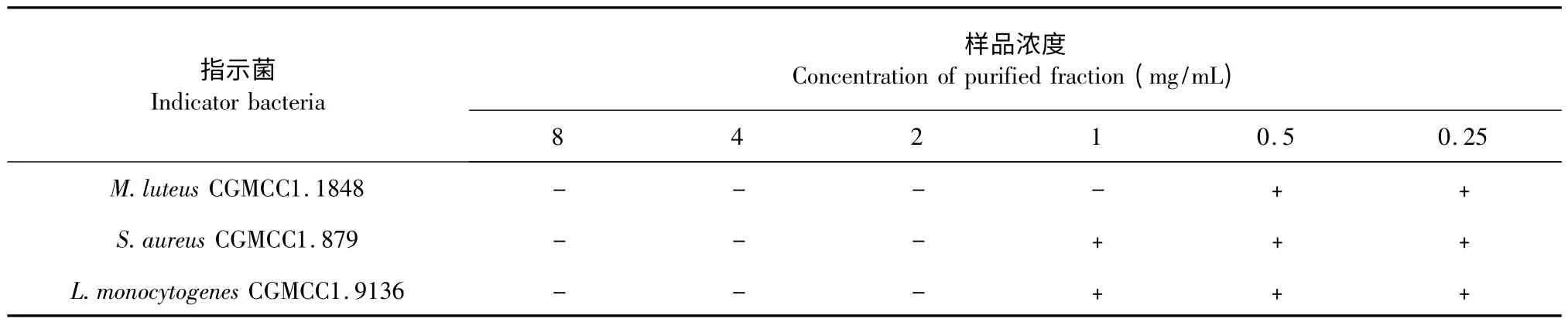
表2 Sephadex LH-20 纯化样品各浓度抑菌活性Table 2 Antimicrobial activity of purified fraction in different concentrations
同时,由以上数据可知,藤黄微球菌CGMCC1.1848 的MIC 值明显低于金黄色葡萄球菌CGMCC1.879 和单增李斯特菌CGMCC1.9136 的MIC 值,故在测定抑菌物质的性质时,选择敏感性较高的藤黄微球菌CGMCC1.1848 作为指示菌。
2.3 热稳定性测定
初步纯化样品P 经不同温度处理后,样品抑菌圈直径平均值见图2。经SPSS 21.0 分析,组间比较,与未经热处理的样品相比,50、60、70、80、90、100、121 ℃处理后样品活性均没有显著性差异(P >0.05),结果表明该样品有良好的热稳定性。
2.4 pH 适用范围的测定

图2 不同温度处理后样品抑菌圈直径Fig.2 Diameter of inhibition zone with different heat treatments
不同pH 值条件下,样品抑菌圈直径平均值见表3。选择pH7 条件下抑菌圈直径做对照,以其他pH 值条件下抑菌圈直径和其差值为纵坐标作图,结果见图3,由图可知,在pH 小于7 的情况下,抑菌圈的直径随着酸性的增强而减小,表明在酸性条件下,抑菌活性会受到一定抑制,pH 在7~9 范围内,抑菌圈直径增大,说明抑菌物质活性增强,pH 大于9 时,与对照组相比,抑菌圈直径减小,活性有所减弱。由此可见,该抑菌活性物质在偏碱性条件下,抑菌作用最强。

表3 不同pH 条件下样品抑菌圈直径Table 3 Inhibition diameter with different pH values
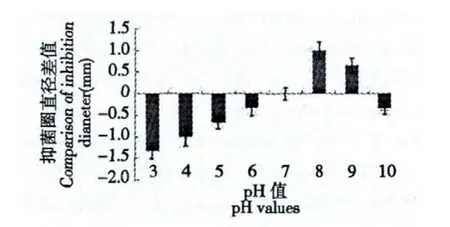
图3 不同pH 条件下抑菌圈直径的比较Fig.3 Comparison of inhibition diameter with different pH values
2.5 蛋白酶敏感性测定
初步纯化样品P,经不同酶处理后各样品活性见下图,由图4 可知,样品经胰蛋白酶、胃蛋白酶、脂肪酶、蛋白酶K 处理后,活性没有明显变化,而经链霉蛋白酶处理后,活性基本消失。依据上述结果,进一步分析初步纯化样品P 在液体培养状态下,对藤黄微球菌CGMCC1.1848 的抑菌作用,结果见图5。在1 mg/mL 浓度下,初步纯化样品P 经链霉蛋白酶处理后,抑菌活性明显下降,在0~18 h 内,未经酶处理的初步纯化样品P 对藤黄微球菌CGMCC1.1848 的最高抑菌率为90.43%,而经链霉蛋白酶处理后样品最高抑菌率为17.45%。与链霉蛋白酶相比,其它酶类作用专一性强,有特异性水解位点,而链霉蛋白酶是一种肽酶,对作用位点肽键的氨基酸组成没有特定的选择性,结果表明活性组分可能是肽类物质。

图4 胰蛋白酶(A)、胃蛋白酶(B)、脂肪酶(C)、蛋白酶K(D)、链霉蛋白酶(E)处理后样品及对照组(F)的抑菌活性Fig.4 Antimicrobial activities of control (F)and samples digested by trypsin (A),pepsin (B),lipase (C),protease K (D),pronase (E)

图5 链霉蛋白酶处理前后样品抑菌率Fig.5 Inhibition rate of samples before and after digestion by pronase
3 结论
本实验以一株类芽孢杆菌BD3526 为研究对象,采用有机溶剂浸提菌体的方法,分离得到对G+菌有明显抑制作用的活性组分,并对其进行了初步的性质测定。经不同温度处理后,样品活性基本保持不变。酸碱适用范围实验表明,样品在酸性条件下,活性会受到些许抑制,在中性偏碱条件下,样品活性最高。样品经链霉蛋白酶处理后活性基本消失,表明该活性物质可能是肽类物质,这与文献报道基本一致[13,14]。
鉴于微生物在发酵过程中,受到影响因素较多,活性不稳定等问题,抑菌物质的提取可以以菌体作为介质,直接破碎细胞得到。经过实验验证,以菌体为介质,重现性较好,但样品组分较为复杂,为分离纯化增加了困难。本实验主要采用了凝胶层析获得了初步纯化的样品,但若想得到纯度较高的样品,作进一步的结构分析,则还需对样品进行纯化。
目前,乳酸链球菌素(Nisin)是唯一被批准应用在食品中的细菌素[15],但其抑菌谱较窄,只对G+菌和部分芽孢菌有抑制作用,对G-菌没有作用,而且Nisin 只有在低酸条件下,才能发挥作用,在中性及偏碱性条件下,几乎全部失活[16]。本实验所用供试菌株BD3526,是从西藏耗牛奶中分离得到,该菌在血平板上未见溶血(数据未公开),同时,目前已有多种(株)类芽孢作为益生菌在医药和畜牧养殖上应用,保证了菌种的安全性。因此,在食品、医药、环境工程等方面具有很高的应用潜力。
1 Piuri M,Sanchez RC,Ruzal SM.Anovel antimicrobial activity of a Paenibacillus polymyxa strain isolated from regional fermented sausages.Lett Appl Microbiol,1998,27:9-13.
2 Wang ZW (王智文),Yuan ST (袁士涛),He L (何亮),et al.Extraction and properties of antifungal active substances produced by Paenibacillus polymyxa Cp-S316.J Agro-Environ Sci (农业环境科学学报),2007,26:1464-1468.
3 Zhao S (赵爽),Liu WC (刘伟成),Qiu JY (裘季燕)et al.Research progress of antimicrobial compounds and disease resistant mechanism of Paenibacillus polymyxa.Chin Agric Sci Bull(中国农学通报),2008,7:347-350.
4 Yang SB (杨少波),Liu XL (刘训理).Research advances in Paenibacillus polymyxa and their bioactive Substances.Microbiol China (微生物学通报),2008,35:1621-1625.
5 Deng Y,Lu Z,Bi H,et al.Isolation and characterization of peptide antibiotics LI-F04 and polymyxin B6 produced by Paenibacillus polymyxa strain JSa-9.Peptides,2011,32:1917-1923.
6 Fortes TO,Alviano DS,Tupin MG,,et al.Production of an antimicrobial substance against Cryptococcus neoformans by Paenibacillus brasilensis Sa3 isolated from the rhizosphere of Kalanchoe brasiliensis.Microbiol Res,2008,163:200-207.
7 Raza W,Hong SW,Qirong S.Use of response surface methodology to evaluate the effect of metal ions (Ca2 +,Ni2 +,Mn2 +,Cu2 +)on production of antifungal compounds by Paenibacillus polymyxa.Biores Technol,2010,101:1904-1912.
8 Maldo NA,Jimenes ZR,Ruizbarba JL.Induction of plantaricin production in Lactobacillus plantarum NC8 after coculture with specific Gram-positive bacteria is mediated by an autoinduction mechanism.J Bacteriol,2004,186:1556-1564.
9 Naghmo UK,Hamma MR,Fliss I,et al.Colistin A and colistin B among inhibitory substances of Paenibacillus polymyxa JB05-01-1.Arch Microbiol,2012,194:363-370.
10 Vanden BL,Van DA,Chopra S,et al.Identification of impurities in polymyxin B and colistin bulk sample using liquid chromatography coupled to mass spectrometry.Talanta,2011,83:1521-1529.
11 Choi SK,Park SY,Kim R,et al.Identification and functional analysis of the fusaricidin biosynthetic gene of Paenibacillus polymyxa E681.Biochem Biophysic Res Commun,2008,365:89-95.
12 Guo Y,Huang E,Yuan C,et al.Isolation of a Paenibacillus sp.strain and structural elucidation of its broad-spectrum li-popeptide antibiotic.Appl Environ Microbiol,2012,78:3156-3165.
13 Deng Y,Lu Z,Lu F,et al.Identification of LI-F type antibiotics and di-n-butyl phthalate produced by Paenibacillus polymyxa.J Microbiol Methods,2011,85:175-182.
14 He Z,Kisla D,Zhang L,et al.Isolation and identification of a Paenibacillus polymyxa strain that coproduces a novel lantibiotic and polymyxin.Appl Environ Microbiol,2007,73:168-178.
15 Zacharof MP,Lovitt RW.Bacteriocins produced by lactic acid bacteria a review article.APCBEE Procedia,2012,2:50-56.
16 Rodr G,Uez J.Heterologous production of bacteriocins by lactic acid bacteria.Int J Food Microbiol,2003,80:101-116.
