乌贼墨黑色素对小鼠脏器系数的影响及排铅效果的研究
2015-01-08李和生
吕 玲,刘 漫,李和生
宁波大学海洋学院食品资源利用研究室,宁波 315211
铅是自然界广泛存在的重金属元素。铅不仅污染环境,还对我们的身体造成严重危害。铅易通过消化道和呼吸道进入人体,其半衰期长,能蓄积在体内[1]并对人体各个系统均有毒害作用,其中主要病变在神经系统和造血系统。铅中毒的早期症状主要是头痛、无法集中注意力、反应迟钝等,中期通常导致贫血和肌肉瘫痪等病症,严重时甚至会导致死亡现象。尤其是对儿童,如果儿童血液中铅的含量超过0.6 μg/mL 时,就会出现智能发育障碍以及行为异常[2]。
黑色素是一种重要的生物资源,是由络氨酸氧化而来的不规则多聚物,因结构中存在可与金属键结合的基团(如-COOH、-NH2、-OH),从而有吸附重金属离子的特性[3]。目前有一些利用黑色素清除体内重金属的报道[4,5]。而乌贼作为一种丰富的海洋生物资源,如何将其充分利用是当今的一个热点问题。乌贼墨是乌贼加工中的废弃物,它具有许多生物活性,如抗肿瘤活性[6-8]、抗氧化活性[9,10]、抗菌活性[11,12]、免疫活性[13]等。乌贼墨中主要的化学成分是黑素色,刘漫等[14]的研究表明乌贼墨黑色素对重金属离子Pb2+有吸附作用。本课题以小鼠为研究对象,建立铅中毒小鼠模型,观察和分析乌贼墨黑色素对小鼠体内Pb2+的脱除作用,为乌贼墨黑色素作为一种毒性阳离子脱毒剂的开发和利用提供科学依据,同时为提高海洋生物资源的综合利用率开拓一条新的途径。
1 材料与方法
1.1 材料与试剂
实验材料:金乌贼购于宁波市路林市场,-20 ℃冷冻储藏。实验动物:ICR 小鼠(24~28 g),清洁级,由浙江省动物中心提供,合格证号:0008604。主要试剂:醋酸铅,上海化学试剂总厂;浓硝酸,国药集团化学试剂有限公司;高氯酸,天津市鑫源化工有限公司。
1.2 主要仪器设备
FD-1D-80 冷冻干燥机,北京博医康实验仪器有限公司;H-1650 高速台式离心机,长沙湘仪离心机设备有限公司;AB 104-N 型分析天平,METTLER TOEDO 公司;2100DV 型电感耦合等电子体发射光谱ICP-AES,Perkin Elmer;TENSOR 27 红外光谱仪,德国Bruker 公司;PB-10 pH 计,德国Sartorius 公司;LDZX-40KB 立式电热压力蒸汽灭菌器,上海申安医疗器械厂;CS101-1AB 电热鼓风干燥箱,重庆银河试验仪器有限公司;KDN-04 消化炉,上海新嘉电子有限公司;移液枪,德国Eppendorf 公司。
1.3 实验方法
1.3.1 乌贼墨黑色素的提取[15]
将冷冻的金乌贼墨囊在4 ℃下解冻,小心去皮去膜,挤出乌贼墨汁并收集于烧杯中。收集完成后加适量超纯水浸泡过夜,然后10000 rpm 离心10 min,弃去上清液,沉淀部分继续加水浸泡,然后再次离心,反复4 次。所得的沉淀用超纯水冲洗,然后冷冻干燥,即得乌贼墨黑色素。
1.3.2 乌贼墨黑色素的红外光谱
称取100 mg 溴化钾和1 mg 干燥的乌贼墨黑色素样品于玛瑙钵中搅拌混匀,在红外灯照射下研磨成细粉,用压片机压制成片。使用TENSOR 27 红外光谱仪,扫描500~3500 cm-1波长范围的光谱吸收值。
1.3.3 动物分组及实验
1.3.3.1 乌贼墨黑色素毒性实验
ICR 小白鼠(雄鼠),体重25 g 左右,随机分为正常组和乌贼墨处理组,每组10 只。正常组小白鼠用3%苦味酸做标记(1~10 号),分两笼饲养:1~5号,6~10 号。乌贼墨处理组同正常组一样标记分笼饲养。正常组灌胃0.2 mL 超纯水,乌贼墨处理组灌胃乌贼墨黑色素(4 g/25 mL,0.2 mL),每日一次。所有小白鼠每日自由进食标准饲料和饮用去离子水。正常组和乌贼墨处理组中的1~5 号灌胃6 d后停止灌胃,24 h 后称重并将其处死,采集肝脏和脑进行称重。剩下的小鼠继续饲养到12 d 后停止灌胃,24 h 后称重并将其处死,采集肝脏和脑进行称重。
1.3.3.2 乌贼墨黑色素对铅中毒小鼠的解毒实验
ICR 小白鼠(雄鼠),体重25 g 左右,随机分为3组(每组10 只):正常组、铅模型组、乌贼墨黑色素治疗组。三组小鼠均用苦味酸标记(1~10 号),每组分两笼饲养(1~5 号和6~10 号)。所有小白鼠每日自由进食标准饲料和饮用去离子水。铅模型组与乌贼墨黑色素治疗组腹腔注射醋酸铅溶液(40 mg/kg),正常组注射等量生理盐水。乌贼墨黑色素治疗组1~5 号于染铅30 min 后灌胃乌贼墨黑色素(4 g/25 mL,0.2 mL)1 次,其余组的1~5 号灌胃等量超纯水,24 h 后将每组的1~5 号处死,采集血液、脑和肝保存待测。乌贼墨黑色素治疗组的6~10 号则于染铅24 h 后灌胃乌贼墨黑色素(4 g/25 mL,0.2 mL)1 次,其余组6~10 号灌胃超纯水,24 h 后处死各组剩下的小鼠,采集血液、脑以及肝保存待测。
1.3.4 测定指标
1.3.4.1 黑色素对小鼠行为、体质量及脏器系数的影响
解剖时观察肝脏病变,称量各组织及体重,计算脏器系数。计算公式如下:

1.3.4.2 小鼠血液、脑、肝中铅含量的测定
小鼠血液、脑和肝脏用硝酸-高氯酸混合液湿式消化。精确取一定体积(或重量)的待测样于消化瓶中,按浓硝酸与高氯酸9∶1 的比例加入浓酸,放置过夜,次日将消化瓶置于消化炉上,先进行低温消解,以免瓶内泡沫过多,当泡沫减少时,则高温煮沸至溶液呈现棕色,此时加少量硝酸再煮沸到冒白烟,至瓶内溶液呈澄清的无色或淡黄色。将消化液冷却至室温,再转移至10 mL 容量瓶中,以去离子水洗消化瓶数次,合并消化液,加水定容。采用ICP-AES测定消化液中的铅含量。
1.3.5 数据分析与统计
2 结果与分析
2.1 乌贼墨黑色素红外光谱

图1 乌贼墨黑色素的红外光谱图Fig.1 IR spectra of melanin from sepia
用红外光谱表征乌贼墨的黑色素的功能基团。由图1 可以看出,乌贼墨黑色素的吸收峰主要是以下三组:3500~3300cm-1、1675~1500 cm-1和1000~1250 cm-1。其中3422.59 cm-1的强吸收峰为O-H 和N-H 伸缩振动;1632.60 cm-1吸收是羧酸基团COO-的振动或芳环C=C 振动或酰胺中C=O 振动;1087.52 cm-1吸收是C-O 伸缩振动。乌贼墨黑色素主要是真黑色素。真黑色素以5,6-二羟基吲哚和5,6-二羟基吲哚酸为前体。吸收峰在3400 cm-1附近表示是C-N 延伸,属于吲哚或吡咯环,吸收峰在1630 cm-1附近表示归属真黑素的吲哚环[16,17]。由图1 可以判断乌贼墨黑色素具有吲哚环结构,与李兴旺从鱿鱼墨中精制黑色素的红外图谱基本一致[18]。
2.2 乌贼墨黑色素对小鼠脏器系数的影响
从表1 可知灌胃6 d 后正常组小鼠的肝脏和脑的脏器系数与乌贼墨处理组基本一致,由统计学分析得出这两组脏器系数无显著差异(P >0.05)。处理12 d 后正常组小鼠与乌贼墨处理组的脏器系数也不具有统计学差异。因此,乌贼墨黑色素不会对小鼠肝和脑的生长造成不良影响。
表1 小鼠脏器系数(n=5,/10-2)Table 1 Organ coefficient of mice(n=5,/10-2)
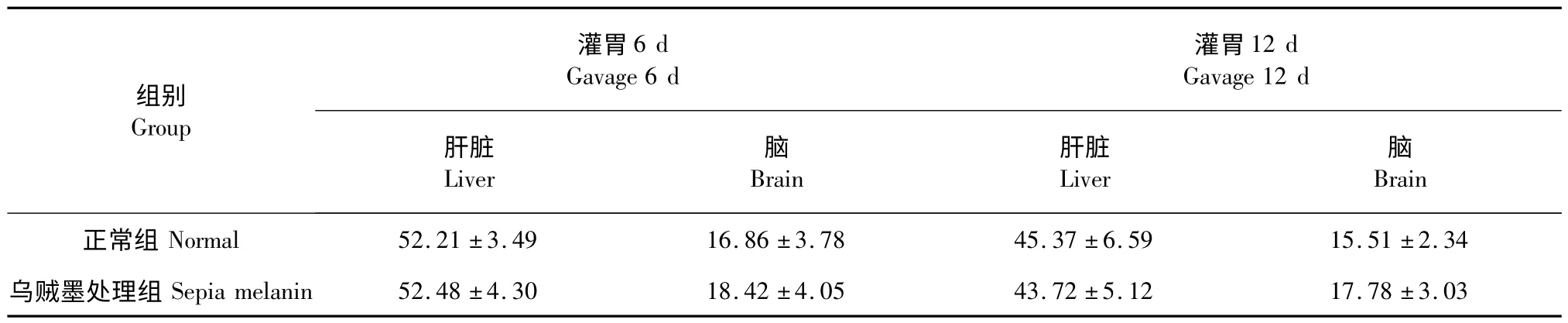
表1 小鼠脏器系数(n=5,/10-2)Table 1 Organ coefficient of mice(n=5,/10-2)
2.3 乌贼墨黑色素对铅中毒小鼠肝脏、脑及血液的排铅作用
小鼠染铅30 min 后灌胃乌贼墨黑色素溶液(4 g/25 mL,0.2 mL)治疗,结果见表2。铅模型组小鼠肝铅、脑铅和血铅含量上升显著,与正常组相比差异极显著(P<0.01),说明铅模型建立成功。治疗组小鼠肝铅和血铅含量与铅模型组相比分别降低了49.47%和80.59%,差异极显著(P<0.01),而脑铅含量下降不明显。
表2 染铅30min 小鼠组织中的铅含量(n=5,)Table 2 Lead content in mice tissues after 30 mins of lead poisoning (n=5,)
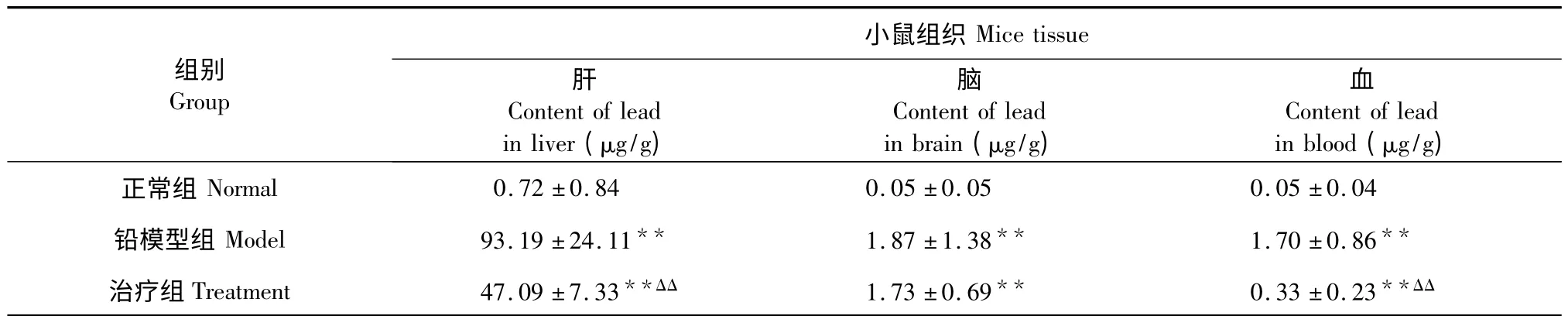
表2 染铅30min 小鼠组织中的铅含量(n=5,)Table 2 Lead content in mice tissues after 30 mins of lead poisoning (n=5,)
注:与正常组比较,* P<0.05,**P<0.01;与铅模型组比较,Δ P<0.05,ΔΔ P<0.01。Note:Compare with normal,* P<0.05,**P<0.01;Compare with model,Δ P<0.05,ΔΔ P<0.01.
小鼠染铅24 h 再灌胃乌贼墨黑色素,治疗24 h后将小鼠处死,各组肝脏、脑及血液中的铅含量见表3。铅模型组中小鼠肝、脑和血液中的铅含量与正常组相比,差异极显著(P<0.01),与表2 中铅模型组相比肝脏、脑及血液中的铅含量上升了22.8%、100%和365.88%。而染铅24h 治疗组小鼠的肝、脑、血液中铅的含量与铅模型组相比分别下降了56.22 %、44.38 %和41.54 %,其中肝脏和血液中铅含量差异极显著(P<0.01),脑铅含量差异显著(P<0.05)。
由表2、表3 的结果可得出乌贼墨黑色素能够促进染铅24 h 以内小鼠肝脏及血液排铅。
表3 染铅24h 小鼠组织中的铅含量(n=5,)Table 3 Lead content in mice tissues after 24 h of lead poisoning(n=5,)
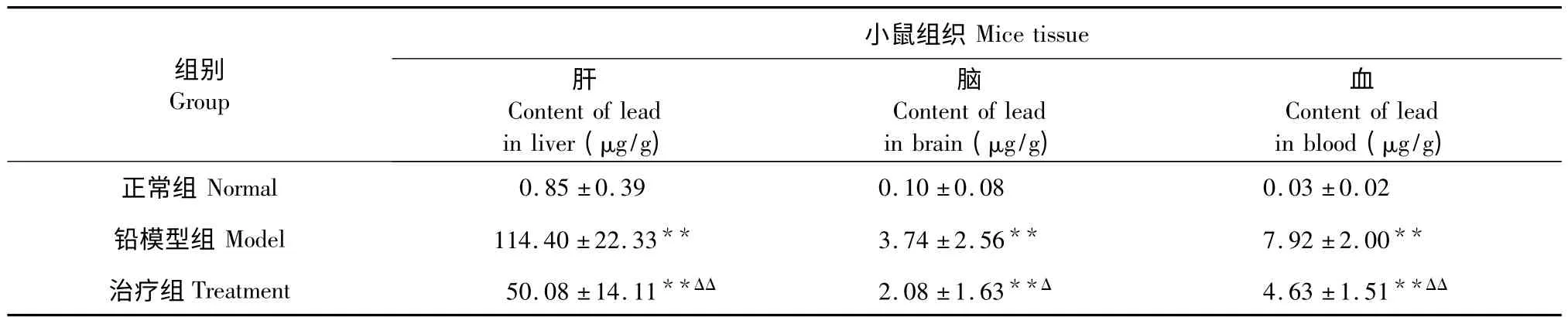
表3 染铅24h 小鼠组织中的铅含量(n=5,)Table 3 Lead content in mice tissues after 24 h of lead poisoning(n=5,)
注:与正常组比较,* P<0.05,**P<0.01;与铅模型组比较,Δ P<0.05,ΔΔ P<0.01。Note:Compare with normal,* P<0.05,**P<0.01;Compare with model,Δ P<0.05,ΔΔ P<0.01.
2.4 铅中毒模型分析
铅中毒的模型有多种,有学者采用给大鼠饮用醋酸铅水来建模,也有学者采用给大鼠喂铅饲料的方法,本实验模型是参阅北京医科大学中德联合实验室的方法[19],采用腹腔注射醋酸铅溶液,建立的小鼠铅中毒模型。由表2 和表3 知铅模型组的脑、肝和血液中铅的含量均与正常组有显著性差异,表明建模成功。
2.5 乌贼墨黑色素对铅中毒小鼠解毒作用分析
由乌贼墨黑色素对铅中毒小鼠的解毒实验可知,小鼠腹腔注入高剂量的铅离子后(染铅30 min)血液与肝脏中的铅含量上升显著,染铅24 h 后血液与肝脏中的铅含量比染铅30 min 时上升了365.88%与22.80 %。由此可以看出血液中铅含量随着时间变化明显,是铅中毒较为明显的一个参考指标。染铅30 min 与24 h 后进行乌贼墨黑色素灌胃治疗,黑色素中的-COOH、-NH2、-OH 基团与铅离子络合,与染铅组比较,小鼠的肝脏和血液铅含量下降显著。表明乌贼墨黑色素对24 h 以内铅中毒小鼠有明显的促排铅作用。而长时间铅中毒,脏器与血液中的铅离子均有一定的蓄积,乌贼墨黑色素是否有显著的治疗效果,有待进一步研究。
3 结论
本文初步研究了乌贼墨黑色素作为解毒剂对铅中毒小鼠体内铅的清除效果。研究结果表明乌贼墨黑色素对小鼠的肝脏和脑生长无不良影响,是一种安全、天然的产物;铅中毒小鼠于染毒30 min 或24 h 灌胃乌贼墨黑色素后,肝脏和血液中铅的清除效果显著(P<0.01)。本文的研究结果可为开发治疗铅中毒的天然药物提供一些科学依据。
1 Roschger A,Hofstaetter JG,Pemmer B,et al.Differential accumulation of lead and zinc in double tidemarks of articular cartilage.Osteoarthritis Cartilage,2013,21:1707-1715.
2 Zhang HF(章海风),Lu HM(陆红梅),Lu XG(路新国).Heavy metal pollution situation of food and its prevention countermeasures.Food Nutri Chin (中国食品与营养),2010,8:17-19.
3 Wang YJ(王玉洁),Fu J(符坚),Shen P(沈萍),et al.Important biological material-melanin and mechanism of function.Amino Acids Biotic Res(氨基酸和生物资源),2003,25:12-14.
4 Nogaj P,Buszman E,Swiatkowska L,et al.The effect of endo-and exogenous melanin on Zn2+and Co2+elimination and distribution in mice.Acta Biochim Pol,1995,42:83-88.
5 Wang ZP(王哲鹏),Deng XM(邓学梅),Wu CX(吴常信).Effect of melanin derived from white silky fowl on accumulation and toxicity of lead in Drosophila melanogaster.Animal Production(动物生产),2007,43(7):50-52.
6 Sasaki J,Ishita K,Takaya Y,et al.Anti-tumor activity of squid ink.J Nutri Sci Vitamino (Tokyo),1997,43:455-461.
7 Takaya Y,Uchisawa H,Matsue H,et al.An investigation of antitumor peptidoglycan fraction from squid ink.Biol Pharm Bull,1994,17:846-849.
8 Zheng YY(郑玉寅),Yang YF(杨永芳),Ding GF(丁国芳),et al.The peptidoglycan extracted from ink of sepia and the inhibition against the growth of prostatic cancer in vitro.Lishizhen Med Mater Med Res (时珍国医国药),2012,23:111-113.
9 Rozanowska M,Sarha T,Land E,et al.Free radicalscavenging propreties of melanin:interaction of eu-and pheo-melanin models with reducing and oxidizing radicals.Free Radical Biol Med,1999,26:518-525.
10 Li HS(李和生),Li X(李晓),Dong YH(董亚辉),et al.Ultrastructure and antioxidative activity of melanin from Cuttlefish.J Chin Inst Food Sci Technol (中国食品学报),2012,12(10):62-66.
11 Smiline ASG,Priyadharshini JV,Suba KP,et al.Antibacterial effect of squid ink on ESBL producing strains of Escherichia coli and Klebsiella pneumonia.Indian J Geo-Marine Sci,2012,41:338-343.
12 Nithya M,Ambikapathy V,Panneerselvam A.Effect of pharaoh’s cuttlefish ink against bacterial pathogens.Asian J Plant Sci Res,2011,1(4):49-55.
13 Guan LM(关玲敏),Wang QH(王庆辉),Zhang P(张佩),et al.Immunoenhancement of squid ink in the immuno-sup-pression mice.Chin J Mar Drugs(中国海洋药物杂志),2010,29(2):36-39.
14 Liu M(刘漫),Li HS(李和生),Xu XH(徐祥浩).Study on adsorption characteristics of sepia melanin adsorbing Pb2+.Sci Technol Food Ind (食品工业科技),2014,35:131-134.
15 Liu Y,Simon JD.Isolation and biophysical studies of natural eumelanins:applications of imaging technologies and ultrafast spectroscopy.Pigment Cell,2003,16:606-618.
16 Wang XY(王鑫玉),Sun SR(孙守荣),Zhou YH(周艳华),et al.Research progress and applications on measurement of melanin.China Animal Husband Veterin Med(中国畜牧兽医),2008,35(5):31-35.
17 Wang Y(王岩),Liu XH(刘学慧),Lu MS(陆懋荪),et al.Study on the structure of several natural melanins by FTIR spectrometer.Chin J Anal Lab (分析实验室),1996,15(6):63-65.
18 Li XW(李兴旺),Wang Z(王糙),Jiang XY(蒋霞云).The purification of melanin extracted from squid ink.J Shanghai Fisheries Univ (上海水产大学学报),2001,10:252-256.
19 Jin YF(金毓芳),Yan J(晏菁).Effects of Lideiyipian on excreting lead in rats with lead poisoning.Guangdong Trace Elements Sci(广东微量元素科学),2001,8(9):30-35.
