蜜楝花及果实中吴茱萸碱、吴茱萸次碱及内酯含量积累变化研究
2015-01-08马英丽杨秋琛尹阳阳
马英丽,杨秋琛,尹阳阳,赵 桦
陕西理工学院生物科学与工程学院,汉中 723000
蜜楝(Evodia lenticellataHuang)为芸香科吴茱萸属植物,主要分布于我国陕西南部和四川等地[1,2]。该植物近成熟果实在民间可入药,功效同吴茱萸果实。
吴茱萸生物碱是吴茱萸属植物吴茱萸、石虎、疏毛吴茱萸的干燥近成熟果实中的一类主要生物碱成分[3]。现代药理学研究发现吴茱萸生物碱类具有重要的药用价值,具有抗肿瘤、保护心脏、调节内分泌系统、调节血糖、减肥、抗炎、镇痛等作用,对阿尔茨海默病作用治疗也有一定的疗效[4-8],在临床得到日益广泛的应用。
目前,对吴茱萸有效成分及其药理作用的研究主要集中在吴茱萸、石虎、疏毛吴茱萸植物,对同属植物蜜楝的研究尚不多见,本实验室曾对蜜楝近成熟果实中脂肪酸和多糖成分做过研究报道,发现与吴茱萸果实相比,蜜楝果实中脂肪酸和多糖的含量及抗菌、抗氧化作用基本相同[9,10]。本文对陕西汉中产蜜楝不同生长阶段的花、果实中吴茱萸、吴茱萸次碱和吴茱萸内酯成分进行了分析研究,并与同地产吴茱萸花和果实中吴茱萸内酯、吴茱萸碱和吴茱萸次碱三种成分积累变化进行比较,以期了解蜜楝植物有效成分含量及其积累动态变化,以期为该植物资源的开发利用提供参考。
1 仪器与材料
1.1 仪器与设备
Waters e2695 高效液相色谱仪,2489 紫外检测器,自动进样器,柱温箱,Empower 色谱工作站(美国Waters 公司);AB204-S 电子分析天平(瑞士Mettler Toledo 公司);KQ-300DE 型数控超声波清洗机(昆山市超声仪器有限公司);UPH-IV-20T 优普超纯水制造系统(成都超纯科技有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司)。
1.2 材料与试剂
蜜楝和吴茱萸花及果实于2014年6月至11月,采自陕西省汉中市汉台区雷家巷,经陕西理工学院杨培君教授鉴定为芸香科吴茱萸属植物蜜楝和吴茱萸。实验材料取自同一生长地植株,每次在5~10 株基本相同的植株上不同部位随机取样,以保证不同时间所采实验材料中有效成分含量变化对比的科学性。吴茱萸内酯、吴茱萸碱及吴茱萸次碱标品购自上海同田生物技术股份有限公司(批号分别为:15011423、14021835、14022444)。
乙腈、四氢呋喃、甲醇均为色谱纯,其他试剂为分析纯,水为自制超纯水。
2 实验方法
2.1 色谱条件
Waters e2695 高效液相色谱仪,Inertsil ODS-3C18色谱柱(4.6 ×150 mm,5 μm),流动相乙腈-四氢呋喃-水混合溶液(41∶1∶58),流速1.0 mL/min,检测波长225 nm,柱温30 ℃,进样量10 μL。
2.2 样品溶液的制备
取蜜楝样品,在55 ℃条件下烘干,粉碎过65 目筛。称取约0.5 g,精密称定,置于具塞100 mL 锥形瓶中,加45 mL 甲醇溶液,准确称重。在超声功率为120 W 超声频率为40 KHz,温度为30 ℃条件下,超声提取40 min,取出,放冷,称重,用纯甲醇溶液准确定容至50 mL 容量瓶,进样前用0.45 μm 的滤膜过滤。同一生长时期实验材料制备三个重复样品供试液,每份样品供试液分别进样测定3 次。
2.3 标准品溶液的制备
精密称取吴茱萸内酯标准品9.93 mg,用甲醇定容于10 mL 容量瓶中,制成0.993 mg/mL 母液,称取吴茱萸碱标准品11.10 mg,用甲醇定容于25 mL 容量瓶中,制成0.444 mg/mL 母液,称取吴茱萸次碱标准品10.310 mg,用甲醇定容于25 mL 容量瓶中,制成0.412 mg/mL 母液,得相应标准品储备液备用。
准确量取吴茱萸内酯标准品储备液0.5、1、1.5、2、2.5 mL,分别用甲醇溶液定容至10 mL 的棕色容量瓶中,配制成浓度分别为49.65、99.30、148.95、198.60、248.25 μg/mL 的吴茱萸内酯标准品梯度溶液备用。
准确量取吴茱萸碱标准品储备液0.5、1、2、3、4、5 mL,分别用甲醇溶液定容至25 mL 的棕色容量瓶中,配制成浓度分别为8.88、17.76、35.52、53.28、71.04、88.80 μg/mL 的吴茱萸碱标准品梯度溶液备用。
准确量取吴茱萸次碱标准品储备液0.5、1、1.5、2、2.5、3 mL,分别用甲醇溶液定容至25 mL 的棕色容量瓶中,配制成浓度分别为8.25、16.50、24.74、32.99、41.24、49.49 μg/mL 的吴茱萸次碱标准品梯度溶液备用。
3 结果与分析
3.1 线性关系考察结果
按照2.1 项下方法,分别测定2.3 项下三种标准品梯度溶液,每个浓度分别进样三次,以标准品溶液浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,分别得吴茱萸内酯的回归方程为Y吴茱萸内酯=1955.4X-5577.3(R2=0.9996),在49.65~248.25 μg/mL 范围内呈良好的线性关系。吴茱萸碱的回归方程为Y吴茱萸碱=89913X+73191 (R2=0.9990),在8.88~88.80 μg/mL 范围内呈良好的线性关系。吴茱萸次碱回归方程为Y吴茱萸次碱=56127X-51856(R2=0.9990),在8.25~49.49 μg/mL 范围内呈良好的线性关系。
分别取浓度为204.40 μg/mL 的吴茱萸内酯母液3 mL,浓度为88.80 μg/mL 的吴茱萸碱母液3 mL,以及浓度为49.49 μg/mL 的吴茱萸次碱母液3 mL,三种母液均加入10 mL 棕色容量瓶中,用甲醇定容至10 mL,可得吴茱萸内酯、吴茱萸碱及吴茱萸次碱的混合标品,其中吴茱萸内酯的浓度为61.32 μg/mL,吴茱萸碱的浓度为26.64 μg/mL,吴茱萸次碱的浓度为14.85 μg/mL。三种标品混合溶液的色谱图见图1 A。
3.2 精密度试验
按照2.1 项下方法,分别用吴茱萸内酯、吴茱萸碱和吴茱萸次碱对照品溶液重复进样5 次,每次进样10 μL,吴茱萸内酯峰面积的RSD为0.75%,吴茱萸碱峰面积的RSD为0.81%,吴茱萸次碱峰面积的RSD为1.15%,实验表明仪器精密度良好。
3.3 重复性试验
精密称取同一蜜楝样品6 份,每份约0.5 g,均精密称定。按2.3 项下方法制备供试液,按2.1 项下条件测定,每份进样3 次,每次进样10 μL。吴茱萸内酯、吴茱萸碱和吴茱萸次碱峰面积的RSD分别为3.35%、1.17%和1.86%,说明本文实验方法对蜜楝三种成分的测定均有很好的重现性。
3.4 稳定性试验
按2.3 项下方法用某一份蜜楝样品制备供试液,供试液分别于提取后0、1、2、4、8、12、24、48 h 按照2.1 项下方法进样测定,吴茱萸内酯、吴茱萸碱和吴茱萸次碱峰面积的RSD分别为4.23%、1.42%和3.07%,说明蜜楝样品供试液中吴茱萸内酯、吴茱萸碱及吴茱萸次碱在48 h 内稳定。
3.5 加样回收率试验
称取同一蜜楝样品6 份,每份0.2 g,精密称定,向6 份样品中分别加入3.9 mg 吴茱萸内酯对照品;称取同一蜜楝样品6 份,每份0.5 g,精密称定,向6份供试样品中分别加入2.1 mg 吴茱萸碱对照品;称取同一蜜楝样品6 份,每份0.5 g,精密称定,向6 份样品中分别加入1.32 mg 吴茱萸次碱对照品,按2.3 项下方法制备供试液,按2.1 项下色谱条件测定,计算回收率,结果见表1。
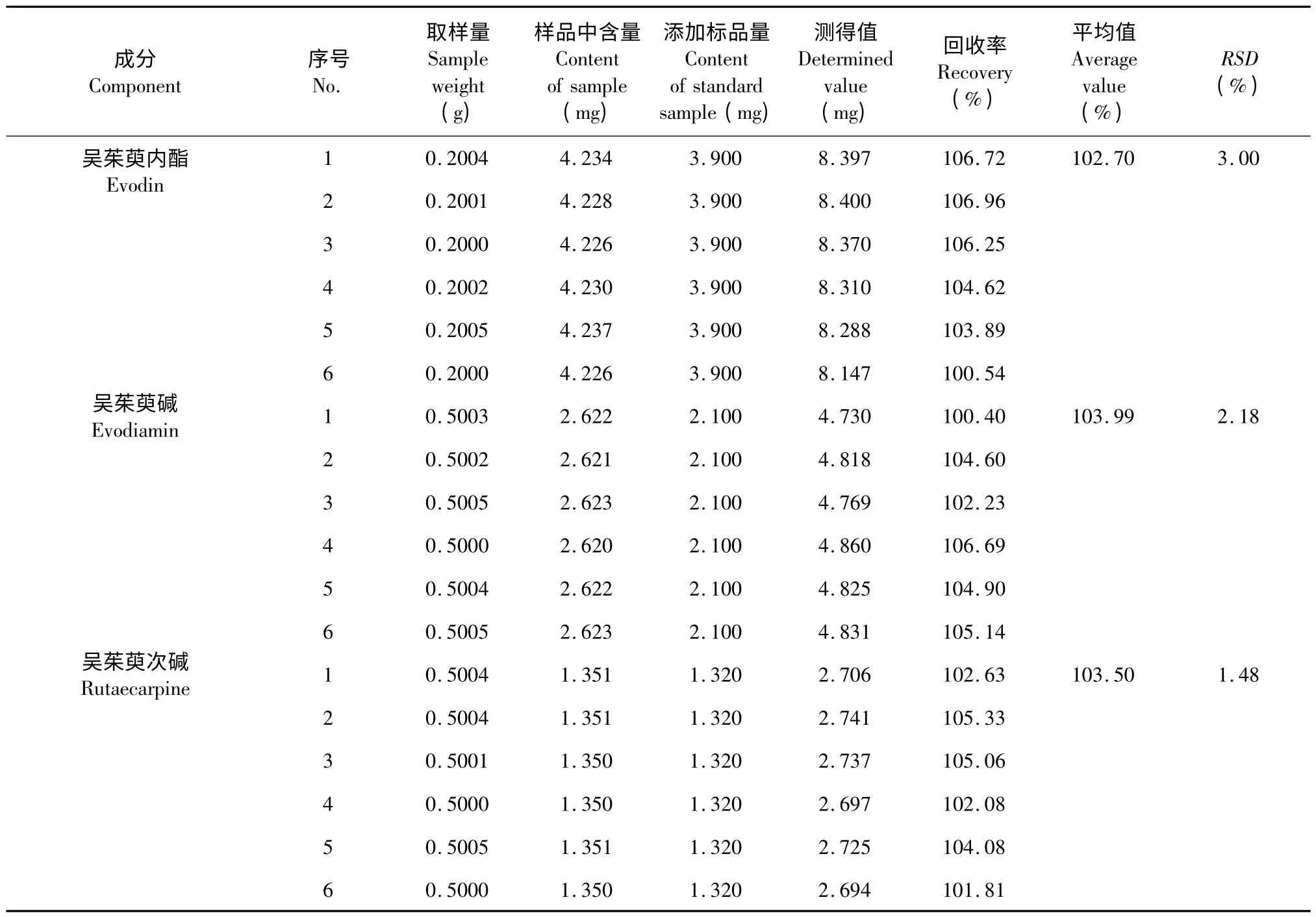
表1 吴茱萸内酯、吴茱萸碱、吴茱萸次碱加样回收率实验(n=6)Table 1 Spiked recovery of evodin,evodiamin and rutaecarpine (n=6)
3.6 样品含量测定
3.6.1 蜜楝花及果实中三种成分含量测定
称取不同发育阶段的蜜楝花及果实共7 个样品各3 份,每份0.5 g,精密称定。按照2.3 项下方法制备供试液,按照2.1 项色谱条件下测定,每份样品供试液进样3 次,每次进样10 μL。测得7 个发育时间段样品中吴茱萸内酯含量在4.63~27.39 mg/g 之间,吴茱萸碱含量在0.09~12.55 mg/g 之间,测得吴茱萸次碱含量在0.21~3.46 mg/g 之间。样品含量测定色谱图见图1 B,不同发育阶段吴茱萸内酯、吴茱萸碱及吴茱萸次碱含量和RSD见表2。
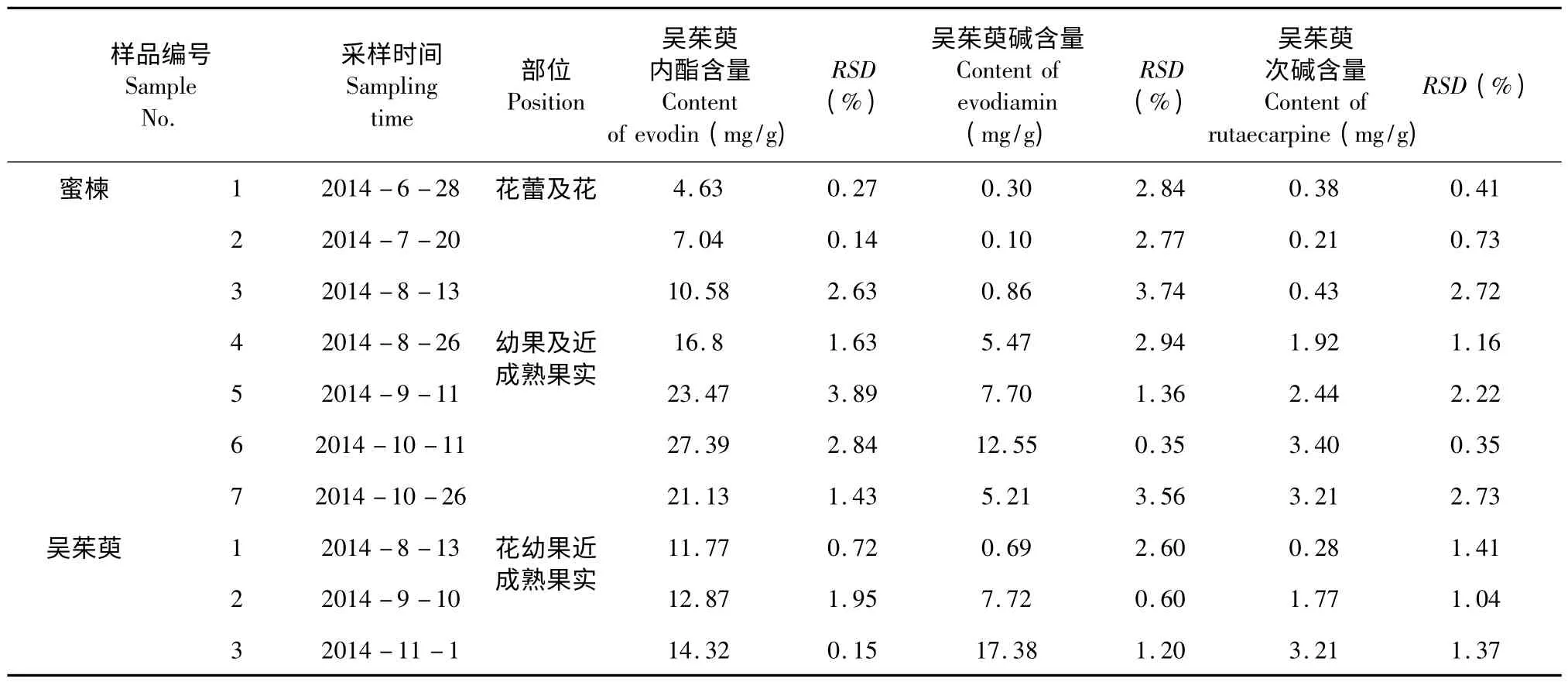
表2 蜜楝、吴茱萸不同生长阶段花与果实中吴茱萸内酯、吴茱萸碱、吴茱萸次碱含量测定结果(n=3)Table 2 Determination results of the content of evodin,evodiamin and rutaecarpine in different growth stages of E.lenticellata and E.rutaecarpa fruits and flowers (n=3)
3.6.2 吴茱萸花及果实中三种成分含量测定
称取吴茱萸花、幼果及果实三个发育阶段样品各3 份,每份0.5 g,精密称定。按照2.3 项下方法制备供试液,按照2.1 项色谱条件下测定,每份样品供试液进样3 次,每次进样10 μL。测得吴茱萸花、幼果和近成熟果样品中吴茱萸内酯含量在11.77~14.32 mg/g 之间,吴茱萸碱含量在0.69~17.38 mg/g 之间,测得吴茱萸次碱含量在0.28~3.21 mg/g 之间。蜜楝、吴茱萸不同发育阶段吴茱萸内酯、吴茱萸碱及吴茱萸次碱含量和RSD见表2。
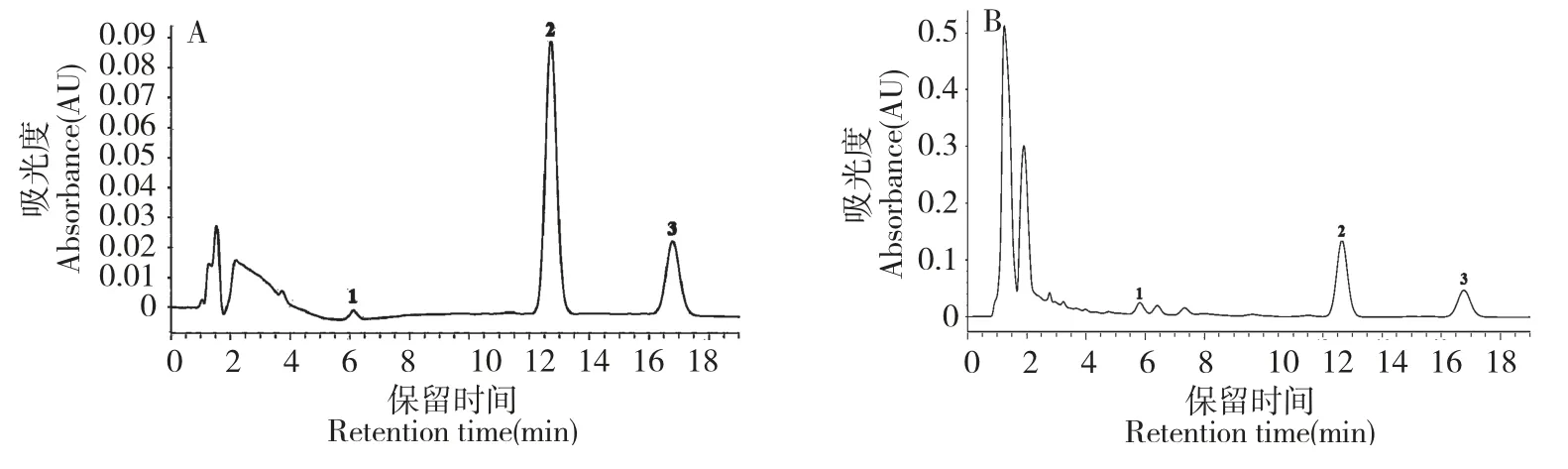
图1 混合对照品(A)及蜜楝果实样品(B)的HPLC 色谱图Fig.1 HPLC chromatograms of mixed standards (A)and sample of E.lenticellata fruit (B)
4 结论与讨论
HPLC 法测定不同植物中生物碱及内酯含量时所用流动相不尽相同,多为乙腈、四氢呋喃及水混合溶液,三种溶液的比例有一定的变化[11]。本实验用乙腈-四氢呋喃-水混合溶液作为流动相,对三种溶液的配比情况与吴茱萸内酯、吴茱萸碱及吴茱萸次碱色谱峰的变化进行了考察分析,当将流动相比例调至41∶1∶58 时,三种成分的峰形以及与相邻组分的分离度效果最好,基线平稳。故本实验使用的流动相最终确定为乙腈∶四氢呋喃∶水的比例为41∶1∶58。这可能是由于不同材料中所含成分不同而对生物碱及内酯成分的影响不同所致。
实验结果表明,随着发育时间的推移,蜜楝花和果实中吴茱萸生物碱、吴茱萸次碱和吴茱萸内酯的积累逐渐增加,在近成熟果实中三者的含量均达到最高,其中吴茱萸内酯含量最高(2.74%),吴茱萸碱次之(1.26%),吴茱萸次碱较低(0.35%),蜜楝果实中三种成分之间含量的差异与吴茱萸果实中三种成分含量分布的情况相同(表2)。当果实成熟果皮颜色变化时,三种成分的含量有所下降,这种情况与药农采摘蜜楝果实的时间基本相符。研究结果也表明,与吴茱萸相比,蜜楝花及果实中这三种成分的积累变化情况与吴茱萸的相似,相比之下蜜楝近成熟果实中吴茱萸内酯的含量较吴茱萸中的丰富,吴茱萸碱和吴茱萸次碱的含量较低于吴茱萸的含量。《中国药典》(2010 版)规定,吴茱萸药材中含吴茱萸碱和吴茱萸次碱的总量不得少于0.15%,含吴茱萸内酯(柠檬苦素)不得少于1.0%[12]。本研究结果表明蜜楝果实中所含吴茱萸碱和吴茱萸次碱的总量为1.57%,吴茱萸内酯含量为2.74%,远高于《中国药典》中对吴茱萸药材的基本要求。因此,蜜楝近成熟果实可以作为吴茱萸碱、吴茱萸次碱和吴茱萸内酯提取制备的一种植物资源,具有良好的开发利用价值。
1 The editorial Board of Flora of China of Chinese Academy of Sciences (中国科学院中国植物志编委会).Flora of China(中国植物志).Beijing:Science Press,1997.43(2),64-65.
2 Northwest Botanic Institute of Chinese Academy of Sciences(中国科学院西北植物研究所).Flora of Qinling (秦岭植物志).Beijing:Science Press,1981.1,134-135.
3 Nanjing University of Chinese Medicine (南京中医药大学).A Dictionary of Traditional Chinese medicine (中药大辞典).Shanghai:Shanghai Scientific and Technical Publishers,2006.1564-1567.
4 Zhu LH (朱丽红),Liu XD(刘小东),Tan YH(谭宇蕙),et al.Proliferation inhibited and apoptosis inducted effects of evodiamine on human hepatoma cell line HepG2.Chin Pharmacol Bull(中国药理学通报),2009,25:68-71.
5 Zhang QF(张秋方),Yang YY(杨奕樱).Current advances in the study on the pharmacologic action of evodiamine.J Guiyang Coll TCM(贵阳中医学院学报),2013,35:36-38.
6 Yan GY(闫冠韫),Wang LB(王立波),Cheng W(程伟).Research progress on the antineoplastic alkaloids drug of traditional Chinese medicine.Acta Chin Med Pharmacol(中医药学报),2013,41:101-102.
7 Zhang ZX(张志仙),Jiang ML (蒋美玲),Wang XH (王欣慧),et al.Progress on pharmacological effect of evodiamine.Prog Mod Biomed(现代生物医学进展),2014,21:4189-4191.
8 Zuo XL (左信丽).Research progress on the alkaloids in euodiae fructus.Chin J Mod Drug(中国现代药物应用),2015,9:265-267.
9 Zhao H (赵桦),Tian GH (田光辉),Gong HM (宫海明).GC-MS analysis of fatty acid compositions in fruits ofEvodia rutaecarpaBenth.andE.lenticellataHuang.Food Sci(食品科学),2009,30:162-165.
10 Fu J (付娟),Bian JJ (边静静),Zhao H (赵桦).In vitroantioxidant and antimicrobial activity of polysaccharides extracted from the fruits ofEvodia lenticellataHuang andEvodia rutaecarpa(Juss.)Beth.Food Sci(食品科学),2010,30(11):69-72.
11 Yu Q(余奇),Guo C(郭澄),Cheng ZN(程泽能).Current advances in the study on rutaecarpine.J Pharm Prac(药学实践杂志),2007,25:353-357.
12 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,205-206.
