香椿子石油醚提取物对大鼠糖尿病肾病的保护作用
2015-01-08李万忠王晓红韩玮娜刘冬梅
李万忠,王晓红,韩玮娜,刘冬梅
潍坊医学院药学院,潍坊 261053
糖尿病肾病(Diabetic nephropathy,DN)是多病因的代谢疾病,发病机制是国内外研究的重点和热点[1]。目前对DN 防治尚无有效方法,化学药虽对血糖、降压、降脂、抗凝等有较好控制,但毒副作用相对较大。基于此,寻找安全、有效、来源丰富的天然产物对于DN 治疗有重要意义。山东地区民间使用香椿子泡水或煎服,对DN 具有较好疗效。香椿子有降糖、抗凝血、抗氧化、保护神经细胞等作用[2-6],所以香椿子不失为一种有市场潜力的干预DN 物质来源。本文研究香椿子石油醚提取物对DN 大鼠肾脏的保护作用,可为DN 临床防治提供一定理论依据。
1 材料与仪器
1.1 药物
香椿子,购自济南圣科技术开发有限公司,经潍坊医学院生药学教研室许崇梅博士鉴定为楝科香椿属植物香椿Toona sinensis(A.Juss.)Roem.的果实;香椿子石油醚提取物由潍坊医学院药学专业实验室自制。
1.2 试剂
链脲佐菌素 STZ (Sigma 公司,批号031M1287V);检测试剂盒(南京建成生物工程研究所);抗体购自Sigma-Aldrich 公司与Santa Cruz 公司。
1.3 设备
酶标仪(Bio-Rad 公司);血糖仪(罗氏公司);全自动生化分析仪(日立公司):光学显微镜(Olympus公司);透射电镜(TEM,日立H-7650)。
1.4 动物
健康清洁级雄性Wister 大鼠,体重(200 ±20)g,合格证号为SCXK 鲁20130001,购于山东省鲁抗医药动物实验中心。
2 实验方法
2.1 造模、分组与给药
180~200 g 雄性Wistar 大鼠,适应性喂养1 周后,随机抽取10 只为正常组,普通饲料喂养;造模大鼠25 只喂以高脂高糖饲料(上海斯莱克实验动物有限公司提供),4 周后STZ 60 mg/kg 造模,血糖介于16.7~25.0 mmol/L 者继续喂养,尿蛋白超过20 μg/min,DN 模型成功建立;将DN 大鼠随机分为模型组9 只、PEE 干预组11 只;PEE 干预组5 mg/100 g·d 连续灌胃10 周,其余两组灌胃等量生理盐水。
2.2 标本收集
大鼠于末次给药后单笼收集24 h 尿液,离心,4℃保存。大鼠于末次给药后称体重,水合氯醛按体重腹腔注射,麻醉后心脏取血,离心,留取血清-20℃保存备用。心脏插管注入4 ℃生理盐水灌洗至肾脏色白,摘取双肾去掉包膜称重,留取肾脏电镜标本,其余部分多聚甲醛固定待用。
2.3 指标检测
2.3.1 血、尿指标
测定大鼠空腹血糖FBG、血肌酐Scr、尿肌酐Ucr、尿素氮BUN;试剂盒测定尿蛋白、HbAlc、血清T-AOC、SOD、MDA、GSH-PX、CAT 含量。
2.3.2 肾脏系数
肾脏系数=肾质量(mg)/体质量(g)
2.3.3 肾脏病理指标
取多聚甲醛固定样本,石蜡包埋,常规切片,进行HE、PAS、PASM、Masson 染色,光镜观察大鼠肾脏病理变化。
2.3.4 免疫组化检测
运用显微镜对每样本免疫组化(TGF-β1、CTGF、collagen IV)选取放大400 倍5 个视野拍照,Isolutions 软件对阳性结果定量分析,得出各组平均阳性强度。
2.3.5 肾脏电镜观察
取肾脏电镜标本,经固定染色后,在透射电镜下观察。
2.4 统计学方法
3 实验结果
3.1 香椿子石油醚提取物对DN 大鼠体重与血糖的影响
与正常组相比,模型组体重明显减轻(P<0.01);肾脏系数升高(P<0.01);血糖明显增加(P<0.01)。与模型组相比,PEE 干预组体重明显增加(P<0.01);肾脏系数降低(P<0.05);血糖明显降低(P<0.01),见表1。

表1 各组大鼠体重、肾脏指数及肾功相关参数Table 1 Body weight,index of renal hypertrophy and renal function-related parameters in different groups at the end of treatment

注:与正常组比较,aP <0.05,bP <0.01;与模型组比较,cP <0.05,dP <0.01。Note:compared with normal group,aP <0.05 andbP <0.01;compared with model group,cP <0.05 and dP <0.01.
3.2 香椿子石油醚提取物改善DN 大鼠的肾功能
与正常组相比,模型组大鼠的24 h 尿量、尿蛋白、HbAlc、BUN、Scr 显著上升(P<0.01);Ucr 明显降低(P<0.01)。与模型组相比,PEE 干预组的24 h 尿量、尿蛋白、HbAlc、BUN、Scr 大幅减少(P<0.01或P<0.05);Ucr 明显提升(P<0.01),见表1。
3.3 香椿子石油醚提取物对DN 大鼠氧化应激指标的影响
与正常组相比,模型组大鼠的T-AOC、SOD、GSH-Px、CAT 活性显著降低(P<0.01),MDA 水平明显升高(P<0.01)。与模型组相比,PEE 干预组的T-AOC、SOD、GSH-Px、CAT 活性增加P<0.01 或P<0.05),MDA 水平明显降低(P<0.05),见表2。
3.4 香椿子石油醚提取物改善STZ 糖尿病大鼠肾脏的病理损伤
HE、PAS、PASM、Masson 染色观察各处理组肾脏的病理变化,对PAS、PASM、Masson 染色进行定量分析计算肾小球硬化指数和肾小球纤维化面积百分比。正常组大鼠肾脏病理无明显变化;与正常组相比,模型组大鼠肾小球肥大,鲍曼囊变窄,毛细血管管腔变窄,系膜区细胞外基质沉积增加,糖原沉积明显增多,胶原沉积明显增多;PEE 干预组大鼠肾脏上述病理损伤较STZ 组得到明显改善(P<0.05),见图1。
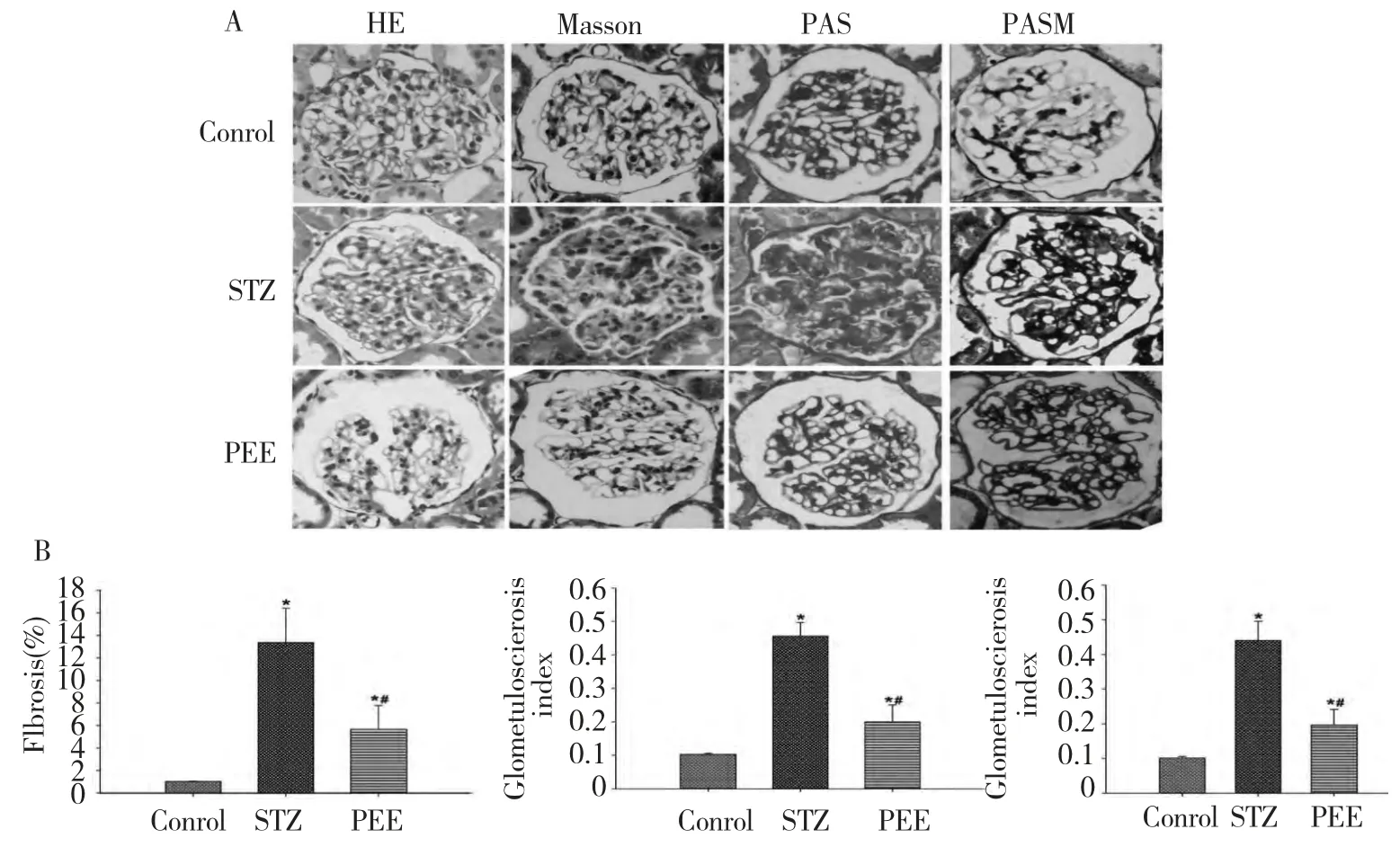
图1 不同处理组大鼠对肾脏病理变化的影响Fig.1 Histopathological changes in the kidneys of DN rats with PEE treatment

表2 不同处理组大鼠对抗氧化指标影响Table 2 Content of antioxidant indexes in experimental rats at the end of treatment

图2 各组大鼠肾脏透射电镜下结构变化(×7000)Fig.2 Structural changes were observed in the kidneys of DN rats by TEM (×7000)
3.5 肾脏病理电镜观察
透射电镜下正常组肾脏结构正常,肾小球GBM均匀无增厚,上皮足突分布均匀;模型组大鼠肾脏组织部分GBM 增厚明显,厚薄不均,呈驼峰状,部分足突、次级突起融合明显,部分血管内皮细胞增生、裂孔减少明显。干预组大鼠肾脏组织表现为节段性GBM 中等增厚,足突融合明显,有不同程度改善,见图2。
3.6 免疫组化检测各组大鼠肾组织TGF-β1、CTGF、collagen IV 表达
氧化应激可通过活化TGF-β1、CTGF、collagen IV 信号通路,诱导细胞因子分泌以及细胞外基质合成和沉积,导致肾小球硬化。空白组TGF-β1、CTGF、collagen IV 蛋白水平没有明显差异;与正常组相比,模型组肾脏组织内TGF-β1、CTGF、collagen IV 蛋白水平显著增高;与模型组DN 相比,PEE 干预组肾脏组织内TGF-β1、CTGF、collagen IV 蛋白水平明显降低(P<0.05),见图3。
4 结论与讨论
DN 发病机制复杂,迄今尚不清楚。氧化应激激活几乎所有糖尿病并发症相关病理通路,是DN发病机制的核心环节[7],目前认为氧化应激是重要的共同机制。氧化应激在DN 发生发展中主要表现为肾系膜细胞和上皮细胞氧自由基生成增多,导致细胞受到损伤。PEE 提高SOD、CAT、GSH-Px 活性及总抗氧化力,探讨氧化应激在DN 发病机制中作用,可为DN 防治提供理论依据。
采用先喂高脂饲料,诱发胰岛素抵抗,再行STZ注射,破坏胰岛组织,产生糖尿病模型,与临床2 型糖尿病发病相似;在此基础上,又饲喂高热量饮食,出现持续高血糖、蛋白尿等病理改变,成功建立大鼠DN 模型。
DN 大鼠早期病理改变为肾小球肥大、肾小球现高压、高灌注、高滤过、蛋白尿等表现。PEE 降低DN 大鼠24 h 尿量、尿蛋白、HbAlc、BUN、Scr 等,调整DN 大鼠糖代谢,减少尿蛋白排出[8],有一定改善DN 大鼠肾功能作用。
TGF-β1 是重要的致纤维化因子[9],CTGF 刺激成纤维细胞增殖、细胞外基质产生、纤维化,两者促进肾成纤维细胞胶原生成,在DN 发生发展中有重要作用。Col IV 是糖尿病肾病重要标志物之一[10],水平高低对反映糖尿病肾病发生、发展与转归有重要理论意义和应用价值。PEE 对DN 大鼠肾脏具有保护作用,为香椿子防治DN 提供初步试验依据,至于具体物质基础及作用机制有待进一步研究。

图3 免疫组化比较不同组大鼠肾脏TGF-β1、CTGF、collagen IV 表达Fig.3 Expression of TGF-β1,CTGF and collagen IV in the kidneys of DN rats with PEE treatment
1 Kitada M,Kanasaki K,Koya D.Clinical therapeutic strategies for early stage of diabetic kidney disease.World J Diabetes,2014,5:342-356.
2 Xing SS(邢莎莎),Chen C(陈超).Studies on hypoglycemic effects of total polyphenols from the seeds ofToona sinensis.Pharmacol Clin Chin Mater Med(中药药理与临床),2011,27(3):42-44.
3 Xing SS(邢莎莎),Chen C(陈超).Study on the antioxidation of polyphenols from the seeds ofToona sinensisJuss)Roemin vitro.J Anhui Agric Sci(安徽农业科学),2010,38:7285-7287.
4 Rao YQ(饶娅琦),Chen C(陈超),Zhao B(赵博).Blood anticoagulation effects ofToona sinensisseed.J Sichuan TCM(四川中医),2008,26(11):58-61.
5 Jin GL(金桂兰),Chen C(陈超).Antithrombotic effects ofToona sinensisseeds decoction.China Pharm(中国药房),2011,22:1364-1366.
6 Zhao Q(赵琼),Sun QY(孙黔云),Yang QX(杨庆雄).Protective effects of a polyphenol from the seed ofToona sinensison activation and injury of endothelial cell induced by complement.Chin Pharm Bull(中 国 药 理 学 通 报),2011,27:1041-1044.
7 Chen Y(陈洋),Fu T(付婷),Jiang AH(姜爱花).Relationship between oxidative stress and diabetic nephropathy.J Mil Surg Southwest China(西南军医),2012,14:278-280.
8 Singh VP,Bali A,Singh N,et al.Advanced glycation end productsand diabetic complications.Korean J Physiol Pharmacol,2014,18:1-14.
9 Huang S(黄姗),Cao WF(曹文富).The effect of JJFSN on the expression of TGF-β1 mRNA,Ⅳcollagen protein and HGF in the kidney of diabetic rats.J Fourth Mil Med Univ(第四军医大学学报),2009,30:1345.
10 Dronavalli S,Duka I,Bakris GL.The pathogenesis of diabetic nephropathy.Nat Clin Pract Endocrinol Metab,2008,4:444-452.
