组蛋白乙酰转移酶p300 对人乳腺癌细胞迁移的影响
2015-01-08王丹丹何红鹏张同存
王丹丹,何红鹏,张同存
(天津科技大学生物工程学院,天津 300457)
乳腺癌是女性最常见的恶性肿瘤之一,已成为全球范围内危害女性身体健康的头号杀手,其发病率在欧美及亚洲地区都逐渐呈现上升趋势,且发病年龄日趋年轻化[1-4].乳腺癌主要是由于乳腺导管上皮或小叶乳腺组织出现恶性改变而产生的[5],转移引起的并发症是患者死亡的主要原因[6],而肿瘤细胞的迁移能力又是肿瘤转移扩散的关键.
腺病毒E1A 结合蛋白p300(E1A binding protein p300,EP300)是具有多个结构域的大分子蛋白质,在生物进化中高度保守,因其相对分子质量接近3×105而被命名为p300[7].p300 作为特殊的转录辅因子,本身具有组蛋白乙酰转移酶活性,能通过多种机制参与许多基因的转录调控过程.p300 基因的改变导致许多人类癌症的形成[8].在结直肠癌和前列腺癌中,野生型p300 的过表达与癌细胞向血管转移和不良预后有关[9-11],表明p300 可能在某些癌症的发展进程中起促进作用.Yokomizo 等[12]评估了肝细胞型肝癌(HCC)患者中p300 过表达的预后值,发现p300过表达与血管侵袭增强、肝内转移和生存期缩短密切相关;另外,在培养的HCC 细胞中通过siRNA 沉默技术干扰掉p300 的表达后,发现随着上皮-间质转化相关蛋白Snail 和Twist 表达量的减少及E-cadherin表达的增加,细胞的侵袭迁移受到抑制,表明p300 在HCC 的侵袭转移中发挥着重要作用.研究显示[13],用小分子乙酰转移酶抑制剂C646 抑制p300/CBP 的活性,或通过siRNA 干扰p300/CBP 的表达后,前列腺癌细胞倾向于凋亡且侵袭和迁移能力明显下降,揭示出p300 抑制剂可作为未来癌症治疗的发展方向.Xiao 等[14]研究乳腺癌病人标本时发现p300 在乳腺癌细胞中的表达强于非乳腺癌细胞以及癌旁组织,此结果提示p300 的过表达与乳腺癌的发生、发展存在相关性.另外有研究报道p300 可募集MTA1 蛋白到乳腺癌增强子序列3(BCAS3),促进乳腺肿瘤细胞的癌性表型[15].目前p300 对乳腺癌细胞迁移的影响尚无报道.
非肌细胞肌球蛋白Ⅱ(Nonmuscle myosin Ⅱ,NMⅡ)是细胞骨架的组成成分,参与细胞极性的产生、迁移与黏附等过程,在肿瘤转移过程中具有重要作用.NMⅡ分子是由两条重链和两对轻链组成的六聚体.MYH9(myosin heavy chain 9)是NMⅡ重链的一种亚型.Betapudi 等[16]研究发现MYH9 对细胞的迁移发挥着关键作用,干扰其表达将抑制细胞的迁移.MYL9(myosin regulatory light chain 9)是肌球蛋白调节轻链的一个亚型,其表达上调与人乳腺癌细胞的侵袭迁移呈正相关[17-18].CYR61(cysteine-rich 61)与肿瘤发生相关的生长因子、趋化因子及基质金属蛋白酶等分子之间有相互作用,参与肿瘤细胞的迁移、侵袭、黏附、细胞外基质降解、新生血管生成等转移过程.所以,本研究选取上述3 个基因作为乳腺癌细胞迁移标志基因.
本研究在人乳腺癌细胞MDA-MB-231 中过表达p300,再用靶向p300 的siRNA 干扰掉p300,运用分子生物学方法检测了肿瘤迁移相关基因MYL9、CYR61 和MYH9 在mRNA 和蛋白水平的变化情况,探讨了p300 对乳腺癌细胞迁移的调控作用,为研究乳腺癌转移机制和防治乳腺癌转移提供了理论基础.
1 材料与方法
1.1 主要试剂
青链霉素、L-谷氨酸,Gibco 公司;胎牛血清,天津康源生物技术有限公司;p300 抗体、MYH9 抗体、GAPDH 单克隆抗体,Santa 公司;MYL9 抗体、CYR61 抗体,Abcam 公司;p300 siRNA 及阴性对照siRNA,广州锐博生物科技公司;M-MLV 逆转录酶、Turbo 转染试剂、Trizol 裂解液,Invitrogen 公司.
1.2 细胞株和细胞培养
人乳腺癌细胞 MDA-MB-231 为本实验室保藏.用RPMI-1640 培养基(Gibco 公司),添加10%,灭活胎牛血清、100,U/mL 青霉素和100,µg/mL 链霉素,于37,℃、5%,CO2培养箱中培养.细胞用0.25%,的胰酶消化传代.
1.3 质粒转染实验
以转染空载体(pCDNA3.1)的MDA-MB-231 细胞为对照组,转染p300 表达质粒的MDA-MB-231细胞为实验组,每组设3 个复孔.将MDA-MB-231细胞接种于6 孔板,接种密度为2×105个/孔,置37,℃、5%,CO2培养箱内培养24,h,待贴壁细胞达60%,~70%,融合时开始细胞转染实验.细胞转染过程参照TurbofectTM细胞转染试剂说明书进行.
1.4 小分子干扰RNA(siRNA)的合成
根据p300 基因在GenBank 中的序列设计3 组靶向p300 的siRNA 和2 组非靶向p300 的阴性对照,由广州锐博生物科技有限公司合成.经前期筛选,本实验使用p300-siRNA 设计序列中最高效的一组干扰序列.p300-siRNA 序列如下:Sense:5′-CGACUUACCAGAUGAAUUAdTdT-3′,Antisense:5′-UAAUUCAUCUGGUAAGUCGdTdT-3′,阴性对照siRNA 序列由公司设计并合成.
1.5 siRNA的转染过程
转染前1 天接种细胞于6 孔板,使转染时细胞密度达到50%,~80%,.siRNA 冻干粉5,nmoL 瞬时离心后加250,µL 冰上预冷的DEPC-H2O 配成20,µmol/L储存液,分装保存于-80,℃冰箱.用DEPC 水配制的PBS 稀释 riboFECTTMCP buffer(10×)制备 ribo FECTTMCP buffer(1×),并取出riboFECTTMCP Reagent,在漩涡振荡器充分振荡后,室温放置15,min.取 250,µL riboFECTTMCP buffer(1×),加入 5,µL siRNA 20,µmol/L 储存液,轻轻混匀,室温放置5,min.加入25,µL riboFECTTMCP Reagent,轻轻吹打混匀,室温放置15,min.最后将混合液加入1,720,µL 细胞培养基中,使 6 孔板中 siRNA 的终浓度为50,nmol/L,轻轻混匀.细胞培养48,h 后,收样检测.
1.6 细胞划痕实验
将MDA-MB-231 细胞接种于6 孔板,接种密度为2×105个/孔,置37,℃、5%,CO2培养箱内培养24,h.向各孔细胞中转染不同质粒,转染6,h 后换液,此时在每孔中央用10,µL 吸头划一宽度为300~500,µm 的无细胞划痕区.用PBS 充分洗去漂浮细胞,加入含1%,FBS 的RPMI-1640 培养基继续培养.每隔12,h 在倒置显微镜下观察每孔中划痕宽度变化情况,划痕愈合快慢代表细胞在培养板上迁移速率大小.
1.7 RT-PCR检测
收集处理组和阴性对照组的细胞,提取总RNA后逆转录成cDNA,以此为模板进行PCR 反应.在Invitrogen 公司合成以下引物:GAPDH 上下游引物5′-ATTCAACGGCACAGTCAAGG-3′,5′-GCAGAA GGGGCGGAGATGA-3′,产物大小213,bp.p300 上下游引物5′-GCAAACAATCGAGCGGAATAC-3′,5′-CGGATCATACTTGGGTCAGGT-3′,扩增产物大小218,bp .MYL9 上 下 游 引 物 5′-GAGCCCAAGC GCCTTCT-3′,5′-GTCAATGAAGCCATCACGGT-3′,扩增产物大小202,bp.CYR61 上下游引物5′-GTC GTCACCCTTCTCCACTT-3′,5′-CTTGGCGCAGAC CTTACAG-3′,扩增产物大小141,bp.MYH9 上下游引 物 5′-AGCGTTACTACTCAGGGCTCATC-3′,5′-TCATACTCCTGTAGGCGGTGTCT-3′,扩增产物大小177,bp.扩增产物进行2%,琼脂糖凝胶电泳,EB 染色10,min 后用BioRad 图像分析仪成像进行半定量分析,检测目的基因的表达水平.
1.8 免疫印迹(Western blot)检测
收集处理组及阴性对照组MDA-MB-231 细胞,弃上清液后,加入200,µL SDS 细胞裂解液,4,℃裂解20,min,用细胞刮刀收集蛋白于1.5,mL EP 中,煮沸5,min.取蛋白进行SDS-PAGE 电泳.电泳完毕,利用半干转膜仪将蛋白转移至NC 膜上,用质量分数为5%,的脱脂奶粉室温封闭1,h,一抗于4,℃下孵育过夜.然后用PBS 缓冲液(PBST)漂洗NC 膜3 次,每次5,min.洗完后于室温下二抗避光孵育1,h,PBST漂洗3 次,每次5,min.洗完后,用Odyssey 红外激光成像系统成像,以GAPDH 作对照.
2 结果与分析
2.1 过表达p300对乳腺癌细胞迁移的影响
为了探究p300 对乳腺癌细胞迁移的影响,首先使用MDA-MB-231 细胞做了体外划痕实验.细胞转染空载体pCDNA3.1 作为对照组,转染p300 表达质粒为处理组,每隔12,h 观察细胞的愈合情况,结果如图1 所示.与对照组相比,转染24,h 和48,h 后,明显看到过表达p300 的细胞划痕愈合的更快,表明p300能够促进乳腺癌细胞的迁移.
2.2 过表达p300对MDA-MB-231细胞迁移相关基因mRNA水平的影响
为了检测过表达p300 对乳腺癌细胞迁移相关基因转录水平的影响,运用RT-PCR 方法检测了MDAMB-231 细胞中MYL9、CYR61 和MYH9 的mRNA的变化情况.细胞转染空载体pCDNA3.1 作为对照组,转染p300 表达质粒为处理组.结果如图2 所示,第1 行检测了p300 的mRNA 水平,表明细胞转染效果理想且 p300 在细胞中成功表达,之后检测了MDA-MB-231 细胞中MYL9、CYR61 和MYH9 的mRNA 水平,与对照组相比,过表达p300 后这些迁移标志基因在mRNA 上均上调.

图1 细胞划痕实验检测过表达p300 后乳腺癌细胞迁移情况Fig.1 Effect of p300 overexpression on cell migration detected with wound-healing assay

图2 RT-PCR 法检测MDA-MB-231 细胞中迁移相关基因在mRNA水平的变化Fig.2 RT-PCR assay of the mRNA of metastasis-related genes in MDA-MB-231 cells
2.3 过表达p300 对乳腺癌细胞迁移相关基因蛋白质表达水平的影响
为了检测过表达p300 对乳腺癌细胞迁移相关基因蛋白表达水平的影响,运用Western blot 方法检测了MDA-MB-231 细胞中MYL9、CYR61 和MYH9的蛋白质的变化情况.细胞转染空载体pCDNA3.1作为对照组,转染p300 表达质粒为处理组.Western blot 分析表明(图3),与对照组相比,在MDA-MB-231 细胞中转染p300 后,其蛋白水平呈高表达;继续检测了细胞中MYL9、CYR61 和MYH9 的蛋白表达水平,结果表明过表达p300 后这些蛋白的表达明显增强.
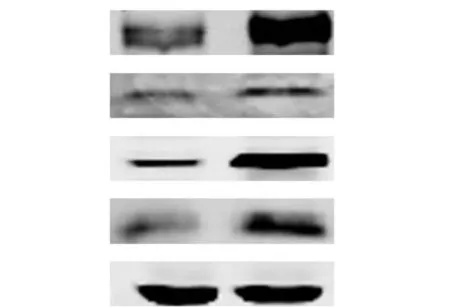
图3 Western blot 法检测MDA-MB-231 细胞中迁移相关基因在蛋白水平的变化Fig.3 Western blot analysis of the protein expression of metastasis-related genes in MDA-MB-231 cells
2.4 siRNA干扰p300表达对乳腺癌细胞迁移的影响
为了进一步验证p300 对乳腺癌细胞迁移的影响,运用siRNA 干扰技术下调p300 的表达,继续做了体外划痕实验.细胞转染阴性非靶向siRNA 作为对照组,转染p300-siRNA 作为处理组,同样每隔12,h 观察细胞的愈合情况,结果如图4 所示.细胞转染24,h 和48,h 后,干扰p300 表达的细胞划痕愈合明显比对照组慢,再次表明p300 对乳腺癌细胞的迁移有促进作用.
2.5 下调p300对MDA-MB-231细胞迁移相关基因mRNA和蛋白表达水平的影响
为了检测下调p300 对乳腺癌细胞迁移相关基因的影响,运用RT-PCR 和Western blot 方法从mRNA和蛋白表达水平上检测了MDA-MB-231 细胞中MYL9、CYR61 和MYH9 的变化情况.转染阴性对照siRNA 作为对照组,转染p300-siRNA 作为处理组,实验结果如图5 所示.由图5(a)可知,RT-PCR分析表明MDA-MB-231 细胞中p300 基因在mRNA水平呈高表达,RNA 干扰48,h 后p300 在mRNA水平的表达明显下调,说明p300-siRNA 能有效抑制p300,mRNA 的表达.转染p300-siRNA 下调p300的表达后,细胞迁移相关基因 MYL9、CYR61 和MYH9 的mRNA 与对照组相比有明显的降低.与RT-PCR 的结果一致,图5(b)的Western blot 分析表明p300 基因在蛋白水平呈高表达,RNA 干扰48,h后p300 表达下调,导致细胞迁移相关基因的表达也显著下调.

图4 细胞划痕实验检测下调p300 表达后乳腺癌细胞迁移情况Fig.4 Effect of p300 knock-down on cell migration detected with wound-healing assay


图5 干扰p300 表达对MDA-MB-231 细胞迁移标志基因的影响Fig.5 Effect of p300 interference on the migration of MDA-MB-231 cell
3 讨论
乳腺癌的病因学机制至今尚未完全阐明,对乳腺癌细胞转移的研究是一个热点,也是难点.细胞迁移是一种复杂的生物学行为,是整个转移过程的关键步骤,涉及众多的调节因子、信号通路以及分子机制.
p300 是组蛋白乙酰转移酶(HAT)家族中研究最多的酶蛋白之一,它除了能乙酰化组蛋白,还能乙酰化非组蛋白.p300 在已知的各种转录活化因子与转录复合物的相互作用中起重要作用,对有关启动子抑或激活抑或失活,通过不同机制影响细胞的生长、增殖、分化及癌症的发生和进展等.p300 的功能失调被认为可引发多种人原发性恶性肿瘤,但至今仍不十分清楚p300 是如何参与癌症发生的.本研究在MDAMB-231 细胞中转染p300 表达质粒,体外划痕实验观察到,外源表达p300 后细胞的迁移能力增强(图1).同时,细胞内迁移相关基因MYL9、CYR61 和MYH9 的mRNA 和蛋白表达水平增加(图2 和图3).以上实验结果表明p300 可能通过提高迁移相关基因的表达促进乳腺癌细胞的迁移,但其具体的促迁移机制还需后续的研究进一步阐明.
RNAi(RNA interfering,RNA 干扰)是指外源性或内源性的双链 RNA(double-silencing RNA,dsRNA)诱导与其同源的mRNA 特异性降解,引起转录后阶段的基因沉默,使细胞表现出特定基因缺失的表型.自1998 年Fire 等[19]发现RNA 干扰现象之后,RNAi 技术迅速被成功用于线虫、果蝇、植物和哺乳动物以及人的基因功能研究,并用于某些肿瘤、病毒感染性疾病治疗的研究中.siRNA 是通过与靶mRNA 的特异性结合,激活RNA 酶,促使mRNA 的降解[20].在siRNA 转染细胞48,h 后即可了解靶基因表达受抑制后的生物学现象.
本研究选用靶向干扰p300 最强的siRNA 序列,成功下调MDA-MB-231 细胞中p300 的表达,RTPCR 和Western blot 结果表明,肿瘤迁移相关基因MYL9、CYR61 和MYH9 的mRNA 和蛋白表达水平均下调(图5),反过来证明了乙酰转移酶p300 对这些肿瘤迁移基因表达非常重要,p300 通过调节肿瘤迁移基因的表达促进人乳腺癌细胞MDA-MB-231 的迁移.同时,本研究结果还提示利用siRNA 干扰p300 的表达,从而抑制乳腺癌细胞的迁移,达到减少乳腺癌转移的抗癌效果,在乳腺癌治疗中将有广阔的应用前景.
[1]Forouzanfar M H,Foreman K J,Delossantos A M,et al.Breast and cervical cancer in 187 countries between 1980 and 2010:A systematic analysis[J].Lancet,2011,378(9801):1461-1484.
[2]Ziegler R G,Anderson W F,Gail M H.Increasing breast cancer incidence in China:The numbers add up[J].Journal of the National Cancer Institute,2008,100(19):1339-1341.
[3]Keramatinia A,Mousavi-Jarrahi S H,Hiteh M,et al.Trends in incidence of breast cancer among women under 40 in Asia[J].Asian Pacific Journal of Cancer Prevention,2014,15(3):1387-1390.
[4]Kachuri L,De P,Ellison L F,et al.Cancer incidence,mortality and survival trends in Canada,1970-2007 [J].Chronic Diseases and Injuries in Canada,2013,33(2):69-80.
[5]Sariego J.Breast cancer in the young patient[J].The American Surgeon,2010,76(12):1397-1400.
[6]Kamby C.The Pattern of metastasis in human breast cancer:Methodological aspects and infuluence of prognostic factors[J].Cancer Treatment Reviews,1990,17(1):37-61.
[7]Eckner R,Ewen M E,Newsome D,et al.Molecular cloning and functional analysis of the adenovirus E1Aassociated 300-kD protein(p300)reveals a protein with properties of a transcriptional adaptor[J].Genes &Development,1994,8(8):869-884.
[8]Gayther S A,Batley S J,Linger,et al.Mutations truncating the EP300 acetylase in human cancers[J].Nature Genetics,2000,24(3):300-303.
[9]Ishihama K,Yamakawa M,Semba S,et al.Expression of HDAC1 and CBP/p300 in human colorectal carcinomas[J].Journal of Clinical Pathology,2007,60(11):1205-1210.
[10]Heemers H V,Debes J D,Tindall D J.The role of the transcriptional coactivator p300 in prostate cancer progression[J].Advances in Experimental Medicine and Biology,2008,617:535-540.
[11]Peña C,García J M,García V,et al.The expression levels of the transcriptional regulators p300 and CtBP modulate the correlations between SNAIL,ZEB1,E-cadherin and vitamin D receptor in human colon carcinomas[J].International Journal of Cancer,2006,119(9):2098-2104.
[12]Yokomizo C,Yamaguchi K,Itoh Y,et al.High expression of p300 in HCC predicts shortened overall survival in association with enhanced epithelial mesenchymal transition of HCC cells[J].Cancer Letters,2011,310(2):140-147.
[13]Santer F R,Höschele P P S,Oh S J,et al.Inhibition of the acetyltransferases p300 and CBP reveals a targetable function for p300 in the survival and invasion pathways of prostate cancer cell lines[J].Molecular Cancer Therapeutics,2011,10(9):1644-1655.
[14]Xiao Xiangsheng,Cai Muyan,Chen Jiewei,et al.High expression of p300 in human breast cancer correlates with tumor recurrence and predicts adverse prognosis[J].Chinese Journal of Cancer Research,2011,23(3):201-207.
[15]Gururaj A E,Singh R R,Rayala S K,et al.MTA1,a transcriptional activator of breast cancer amplified sequence 3[J].Proceedings of the National Academy of Sciences,2006,103(17):6670-6675.
[16]Betapudi V,Licate L S,Egelhoff T T.Distinct roles of nonmuscle myosinⅡisoforms in the regulation of MDAMB-231 breast cancer cell spreading and migration[J].Cancer Research,2006,66(9):4725-4733.
[17]Medjkane S,Perez-Sanchez C,Gaggioli C,et al.Myocardin-related transcription factors and SRF are required for cytoskeletal dynamics and experimental metastasis[J].Nature Cell Biology,2009,11(3):257-268.
[18]Luo Xuegang,Zhang Chunling,Zhao Wenwen,et al.Histone methyltransferase SMYD3 promotes MRTF-Amediated transactivation of MYL9 and migration of MCF-7 breast cancer cells[J].Cancer Letters,2014,344(1):129-137.
[19]Fire A,Xu S,Montgomery M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[20]Hannon G J.RNA interference[J].Nature,2002,418(6894):244-251.
