Rho 信号通路抑制剂Y27632 抑制TGF-β 诱导的MCF-7 细胞上皮间质转化
2015-01-08庄春雨宋铁峰张同存
王 楠,庄春雨,宋铁峰,袁 颖,张 蕊,张同存
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
上皮间质转化(epithelial-to-mesenchymal transition,EMT)可以使细胞失去其上皮细胞的节点黏附性并获得间质细胞的表型和特征.在EMT 过程中,上皮细胞连接蛋白(如E-cadherin)的表达量降低,间质细胞标志蛋白(如vimentin,N-cadherin)的表达升高[1].在癌症中,EMT 使肿瘤细胞变得更有迁移能力和侵袭能力[2],乳腺癌中95%,的癌细胞来源于上皮,许多研究表明在乳腺癌的发生过程中EMT 起到十分重要的作用[3].
转化生长因子-β(transforming growth factor-β,TGF-β)是一种多功能的细胞因子,高表达TGF-β 的乳腺癌病人死亡率高[4],在乳腺癌的后期,TGF-β 促进癌症发生过程,促进乳腺癌细胞迁移和侵袭以及EMT 的发生[5].TGF-β 促使EMT 的发生涉及多个信号通路,研究最多的是TGF-β 可以通过Smad 信号通路发挥作用,除了TGF-β/Smad 通路,TGF-β可以激活转化生长因子——活化激酶1(TGF-activated kinase,TAK1),从而激活下游的一系列信号通路,如磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinases,PI3K)、c-Jun 氨基末端激酶(c-Jun N-terminal kinases,JNK)及细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路[6].GTPase Rho 信号通路在细胞骨架的重新排列过程中具有重要作用,与细胞的迁移能力密切相关,但是Rho 通路是否参与TGF-β诱导的乳腺癌细胞MCF-7 上皮间质转化过程尚不明确.本文通过在MCF-7 细胞中加入TGF-β 构建EMT 模型,研究TGF-β 对MCF-7 细胞迁移的影响,并加入Rho 通路抑制剂Y27632 进一步研究Rho 信号通路在这一过程中的作用.
1 材料与方法
1.1 细胞株和细胞培养
人乳腺癌细胞MCF-7 为本实验室保藏,在DMEM/F-12 培养基中加入体积分数为10%,的胎牛血清,1%,青霉素-链霉素溶液(100×),于37,℃、5%CO2,培养箱培养.用0.25%,的胰酶隔天进行消化传代.
1.2 主要试剂
D-MEM/F-12 培养基,Gibco 公司;胎牛血清,天津康源生物技术有限公司;Human TGF-β1,Peprotech公司;Y-27632 dihydrochloride、N-钙黏连蛋白(Ncadherin)抗体、波形蛋白(vimentin)抗体,Sigma 公司;IRDye®800,CW 山羊抗鼠抗体、IRDye®680 山羊抗兔抗体,LI-COR 公司;M-MLV 逆转录酶、Trizol裂解液,上海英俊生物技术有限公司;随机引物B0043,上海生工生物工程有限公司;dNTP,Solarbio公司;Bestar®SybGreen qPCR Mastermix,DBI®Bioscience 公司.
1.3 细胞加药处理
将2×105,mL-1的MCF-7 细胞1,mL 接种于6 孔板中,分为3 组:对照组,无血清D-MEM/F12 处理细胞48,h;TGF-β 处理组,加TGF-β(终浓度5,nmol/L)于无血清的D-MEM/F12 中,处理细胞48,h;抑制剂处理组,先用含Y27632(终浓度10,µmol/L)的DMEM/F-12 处理MCF-7 细胞30,min 后加入终浓度为5,nmol/L 的TGF-β 处理MCF-7 细胞48,h.收集上述细胞进行后续实验.
1.4 细胞划痕实验
2×105,mL-1的MCF-7 细胞1,mL 接种于6 孔板,24,h 后用10,µL 枪头在细胞间按“十”字型划出痕迹,同时加药处理,24,h 后在倒置显微镜下进行观察拍照.
1.5 RNA的提取
用 0.5,mL Trizol 裂解液在冰上裂解细胞20,min,重复吹悬使细胞充分裂解,加入0.1,mL 的氯仿,剧烈振荡15,s,静置2~5,min,然后于4,℃、12,000,r/min 离心15,min.取上层水相到另一EP 管中,加入等体积的异丙醇,混匀,-20,℃放置30,min.12,000,r/min 离心15,min,弃掉上清液,加入75%,乙醇1,mL,洗涤RNA,离心弃上清液,干燥RNA,加入20,µL DEPC 溶解,放于-80,℃保存.
1.6 RNA 逆转录及实时定量荧光PCR(real-time PCR)
将提取的RNA 用M-MLV 逆转录方法进行逆转录,逆转录体系为 40,µL.RNA 20,µL、随机引物(B0043)5,µL、10,mol/L dNTPs 2,µL 65,℃水浴5,min;然后加入 5×buffer 8,µL、0.1,mol/L DTT 4,µL、RNAse inhibitor 1,µL,37,℃水浴2,min;M-MLVRT 1,µL 室温放置10,min;37,℃反应1.5,h,70,℃保持10,min 终止反应.
用Bestar®SybGreen qPCR Mastermix 进行realtime PCR.扩增程序:95,℃ 2,min;95,℃ 10,s,60,℃30,s,72,℃ 30,s,40 个循环.溶解曲线:95,℃ 1,min,55,℃ 1,min,95,℃ 10,s.目的基因引物:GAPDH 上游5′-TCAACGGCACAGTCAAGG-3′,GAPDH 下游5′-AGAAGGGGCGGAGATGA-3′;N-cadherin 上游5′-CAACTTGCCAGAAAACTCCAGG-3′,N-cadherin 下游5′-ATGAAACCGGGCTATCTGCTC-3′;vimentin 上游5′-GAACGCCAGATGCGTGAAATG-3′,vimentin下 游 5′-CCAGAGGGAGTGAATCCAGATTA-3′ ;MYL9 上 游5′-GAAGAAACAGGCCAGGAGA-3′,MYL9 下游5′-GTGTAGGGAAGGGGACTGAGAGG-3′;CYR61 上游 5′-TTAGTCGTCACCCTTCTC-3′,CYR61 下游5′-TCCCCGTTTTGGTAGATTC-3′.
1.7 免疫印迹实验(Western blot)
收集各组细胞,PBS 洗1 次,SDS 细胞裂解液冰上裂解细胞,100,℃变性10,min,12%,SDS-PAGE 电泳,电转法将蛋白转至NC 膜.5%,的脱脂奶粉室温封闭1,h 后,分别用GAPDH 抗体(1∶500)、N-钙黏连蛋白抗体(1∶200)、波形蛋白抗体(1∶200)4,℃孵育过夜,PBS 洗3 次,每次10,min,IRDye®800,CW 山羊抗鼠抗体(1∶5,000)、IRDye®680 山羊抗兔抗体(1∶5,000)室温孵育 2,h 后,PBS 洗 3 次,每次10,min,Odyssey 成像系统进行扫膜成像.并用ImagJ进行灰度分析.
1.8 统计学分析
所有实验数据均用SPSS 13.0 统计软件计算,实验数据均以“平均值±标准差”表示.用t 检验对数据进行分析,*表示统计学上有显著性差异(P<0.05),**表示统计学上有极显著性差异(P<0.01).
2 结果与分析
2.1 TGF-β 诱导MCF-7细胞发生EMT
TGF-β 是公认的能引起细胞发生EMT 的重要因子.在DMEM/F12(无血清)培养基中加入TGF-β(终质量浓度5,ng/mL)处理细胞48,h 后,提取总RNA,用real-time PCR 的方法检测间质细胞标志基因N-钙黏连蛋白(N-cadherin)、波形蛋白(vimentin)mRNA水平的变化,结果如图1 所示.在经过TGF-β 处理后N-cadherin、vimentin 的表达量升高.

图1 TGF-β 上调间质标志基因mRNA水平的表达Fig.1 TGF-β upregulates the mRNA expression of mesenchymal markers
利用Western blot 检测这两种标志基因蛋白水平的变化,结果如图2 所示.TGF-β 诱导N-cadherin 和vimentin 蛋白水平上调,说明在MCF-7 细胞中加入TGF-β 可以促使细胞发生EMT 过程,EMT 模型构建成功.


图2 TGF-β 上调间质标志基因蛋白水平的表达Fig.2 TGF-β upregulates the protein expression of mesenchymal markers
2.2 TGF-β 促进MCF-7细胞迁移
为进一步证明TGF-β 功能上是否影响MCF-7细胞迁移,利用划痕实验检测了细胞的迁移能力,结果如图3 所示.加入TGF-β 的MCF-7 细胞的愈合程度高于没有处理的MCF-7 细胞的愈合程度,证明TGF-β 促使MCF-7 细胞的迁移.

图3 TGF-β 对MCF-7细胞迁移能力的影响Fig.3 Effect of TGF-β on MCF-7 cell migration
据文献[7-8]报道细胞外基质蛋白CYR61 与细胞骨架蛋白MYL9 和细胞迁移有直接的关系,本文进一步利用real-time PCR 的方法检测迁移标志基因CYR61、MYL9,mRNA 水平的变化,结果如图4所示.TGF-β 可以促进CYR61、MYL9,mRNA 表达的升高,进一步证明了TGF-β可以促进MCF-7细胞的迁移能力.
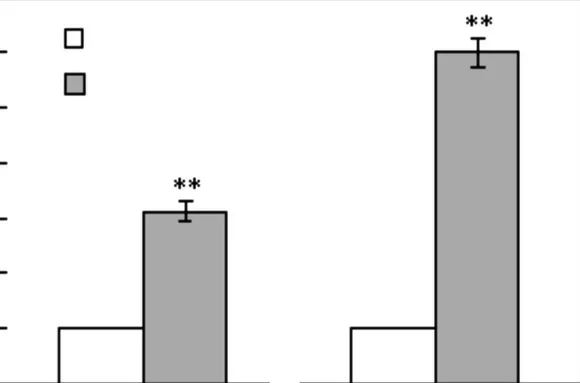
图4 TGF-β 促进迁移标志基因表达升高Fig.4 TGF-β upregulates the expression of migration markers
2.3 抑制Rho信号通路抑制TGF-β 诱导MCF-7细胞发生的EMT
GTPase Rho 信号通路在细胞骨架的重新排列的过程中具有重要作用,与细胞的迁移能力密切相关,然而Rho 信号通路是否参与TGF-β 诱导的EMT 过程尚不清楚.因此,首先用 Rho 通路的抑制剂Y27632 处理MCF-7 细胞0.5,h 后,再加入TGF-β 处理48,h,real-time PCR 方法检测间质细胞标志基因N-cadherin、vimnetin mRNA 水平的变化,结果如图5所示.TGF-β 处理组细胞高表达 N-cadherin 和vimentin,而抑制剂处理组与TGF-β 处理组相比,Ncadherin 和vimentin 的表达降低.

图5 Y27632 抑制TGF-β 诱导的MCF-7 细胞间质标志基因mRNA水平的表达Fig.5 Y27632 inhibits the mRNA expression of mesenchymal markers induced by TGF-β in MCF-7 cells
利用Western blot 检测这两种基因蛋白水平的变化,如图6 所示.结果与mRNA 水平的变化一致,说明在MCF-7 细胞中,抑制Rho 信号通路可以逆转由TGF-β 引起的EMT 的过程.

图6 Y27632 抑制TGF-β 诱导的MCF-7 细胞间质标志基因蛋白水平的表达Fig.6 Y27632 inhibits the protein expression of mesenchymal markers induced by TGF-β in MCF-7 cells
2.4 抑制Rho 信号通路可以抑制由TGF-β 引起的细胞迁移
既然抑制Rho 信号通路可以抑制由TGF-β 引起的EMT 的过程,进一步研究Y27632 是否可以抑制由TGF-β 诱导的MCF-7 细胞的迁移.如图7 所示,证实抑制剂处理组愈合程度低于TGF-β 处理组,证明Y27632 可以抑制由TGF-β 引起的MCF-7 细胞迁移.

图7 Y27632抑制TGF-β 引起的迁移Fig.7 Y27632 inhibits MCF-7 cell migration induced by TGF-β
图8 所示迁移标志基因 CYR61、MYL9 的表达变化情况也证实TGF-β 可以通过激活Rho 通路促进MCF-7 细胞迁移.

图8 Y27632抑制TGF-β 引起的迁移标志基因表达Fig.8 Y27632 inhibits the expression of migration markers induced by TGF-β
3 讨论
EMT 过程可以使细胞上皮性的细胞(包括正常上皮和肿瘤上皮)表现出了间质细胞的特性和表征,从而迁移能力增强.EMT 可以促进多种肿瘤细胞的迁移,如肝癌、结肠癌、膀胱癌和恶性黑色素瘤等[9].本文选用人乳腺癌细胞MCF-7,在MCF-7 细胞中加入TGF-β,成功的使MCF-7 细胞发生了 EMT 的过程,间质细胞特征标志基因 N-cadherin、vimentin mRNA 和蛋白水平表达都上升,并且通过划痕实验证明TGF-β 可以使MCF-7 细胞的迁移能力增加,通过real-time PCR 实验证明迁移标志基因上调,与文献报道一致[10].
TGF-β 引起EMT 的过程是一个非常复杂的过程,许多研究表明Smad 经典通路和多条非Smad 通路共同参与这个过程.Smad 蛋白在TGF-β 诱导EMT 发生的过程中起着非常重要的作用,不同Smad亚型发挥作用不同,肝细胞中Smad3 促进EMT、Smad2 抑制EMT;在肾近曲小管上皮细胞Smad3 和Smad2 都促进EMT[11].除了TGF-β/Smad 通路,TGF-β 还可以激活 TAK1,进而激活下游的信号通路,TAK1 可以使MKK3/6 磷酸化,从而激活JNK 和p38[11];TGF-β 诱导的Mek/Erk MAPK 信号能诱导TGF-β1 表达,从而TGF-β 反应扩大[6].但是作为与细胞迁移密切相关的信号通路Rho 通路的作用现研究的很少,已有报道表明,Rho 通路的抑制剂Y27632可以使乳腺癌细胞MDA-MB-231 细胞和SUM1315细胞的迁移能力下降[12],Jo 等[13]证实MCF-7 细胞中Rho 通路抑制剂Y-27632 可以抑制由尿激酶型纤溶酶原激活剂(urokinase-type plasmionogen activator,uPA)过表达引起 MCF-7 细胞的迁移能力的增加.Yang 等[14]证实在 MCF-7 细胞中单独加入Y27632,MCF-7 细胞的迁移能力下降,EMT 的特征标志基因的表达没有明显的变化.本实验通过加在MCF-7 细胞中加入TGF-β 促使其发生EMT 的同时加入Rho 信号通路的抑制剂Y27632,证明Y27632可以抑制TGF-β 引起的MCF-7 发生的EMT 过程,间质细胞标志基因N-cadherin、vimentin 表达下降;并且可以抑制MCF-7 细胞由于TGF-β 引起的迁移能力的增加,迁移标志基因CYR61、MYL9 表达下降,细胞划痕愈合程度降低.这些结果说明在MCF-7细胞中Rho 信号通路抑制剂Y27632 能够抑制TGFβ 引起的EMT 的过程.研究[15]报道在人视网膜色素上皮细胞中,TGF-β 通过Smad3 诱导RhoA 特异性鸟嘌呤交换因子NET1(neuroepithelial cell transforming 1)的表达,进而激活RhoA;在多种上皮细胞和成角质细胞中,TGF-β 可以快速激活RhoA[16-17].因此在MCF-7 细胞中,TGF-β 可能通过激活RhoA 活化Rho 通路,进而促进EMT 的发生,但是其具体机制还需要进一步的研究.
[1]Nouhi Z,Chughtai N,Hartley S,et al.Defining the role of prolactin as an invasion suppressor hormone in breast cancer cells[J].Cancer Research,2006,66(3):1824-1832.
[2]De Krijger I,Mekenkamp L J M,Punt C J A,et al.MicroRNAs in colorectal cancer metastasis[J].Journal of Pathology,2011,224(4):438-447.
[3]刘君君,陈小松,沈坤炜.乳腺癌上皮间质转化与耐药关系的研究进展[J].肿瘤,2012,32(11):945-948.
[4]Ivanovic V,Demajo M,Krtolica K,et al.Elevated plasma TGF-β1 levels correlate with decreased survival of metastatic breast cancer patients[J].Clinica Chimica Acta,2006,371(1/2):191-193.
[5]Zarzynska J M.Two faces of TGF-beta1 in breast cancer[J].Mediators of Inflammation,2014,10:1155-1171.
[6]来延奇,林森森,孙立,等.TGF-β 对EMT 的诱导及EMT 抑制剂研究进展[J].现代肿瘤医学,2012,20(8):1746-1749.
[7]Luo Xuegang,Zhang Chunling,Zhao Wenwen,et al.Histone methyltransferase SMYD3 promotes MRTF-Amediated transactivation of MYL9 and migration of MCF-7 breast cancer cells[J].Cancer Letters,2014,344(1):129-137.
[8]Emre Y,Imhof B A.Matricellular protein CCN1/CYR61:A new player in inflammation and leukocyte trafficking[J].Seminars in Immunopathyology,2014,36(2):253-259.
[9]辛灵艳,范理宏.TGF-β 对肺癌细胞EMT 的调节及EMT 抑制剂的研究进展[J].现代肿瘤医学,2014,22(3):690-693.
[10]Yu Jingshuang,Xie Furong,Bao Xin,et al.miR-300 inhibits epithelial to mesenchymal transition and metastasis by targeting Twist in human epithelial cancer[J].Molecular Cancer,2014,13:121.
[11]吴腾云,张威,曹冬梅.TGF-β 诱导上皮间充质转化的信号通路研究[J].国际病理科学与临床杂志,2011,31(1):81-86.
[12]Liu Sijin,Robert H G,Scepansky E M,et al.Inhibition of rho-associated kinase signaling prevents breast cancer metastasis to human bone[J].Cancer Research,2009,69(22):8742-8751.
[13]Jo M,Thomas K S,Somlyo A V,et al.Cooperativity between the Ras-ERK and Rho-Rho kinase pathways in urokinase-type plasminogen activator-stimulated cell migration[J].The Journal of Biological Chemistry,2002,277(14):12479-12485.
[14]Yang S,Kim H M.ROCK inhibition activates MCF-7 cells[J].PloS One,2014,9(2):8848-8857.
[15]Lee J,Moon H J,Lee M,et al.Smad3 regulates Rho signaling via NET1 in the transforming growth factorbeta-induced epithelial-mesenchymal transition of human retinal pigment epithelial cells[J].The Journal of Biological Chemistry,2010,285(34):26618-26627.
[16]Bhowmick N A,Ghiassi M,Bakin A,et al.Transforming growth factor-beta1 mediates epithelial to mesenchymal transdifferentiation through a RhoA-dependent mechanism[J].Molecular Biology of the Cell,2001,12(1):27-36.
[17]Fleming Y M,Ferguson G J,Spender L C,et al.T GFbeta-mediated activation of RhoA signalling is required for efficient(V12)HaRas and(V600,E)BRAF transformation[J].Oncogene,2009,28(7):983-993.
