慢性间歇性缺氧状态舌下神经核5-HT及5-HT 2A受体的变化*
2015-01-08张敏娟焦成严降雨李静殷敏程雷
张敏娟焦成严降雨李静殷敏程雷
慢性间歇性缺氧状态舌下神经核5-HT及5-HT 2A受体的变化*
张敏娟1焦成1严降雨1李静1殷敏1程雷1
目的观察慢性间歇性缺氧(chronic intermittent hypoxia,CIH)大鼠舌下运动神经元细胞的形态变化,及其相应神经递质5-HT及5-HT 2A受体和C-fos表达量的变化。方法将12只雄性Sprague Dawley(SD)大鼠(8周龄,体重180~200 g)随机均分为CIH组和常氧对照组。CIH组低氧条件为舱内氧浓度在5%-21%之间循环,对照组氧浓度维持在21%。5周后观察舌下运动神经元细胞的形态改变、舌下神经核神经递质5-HT及5-HT 2A受体和C-fos的表达量。结果尼氏染色显示CIH组尼氏小体崩解,细胞质着色变浅。免疫组化显示CIH组5-HT、5-HT 2A受体和C-fos的表达量均高于对照组(P<0.05)。结论CIH导致5-HT及其结合位点5-HT 2A受体表达上调,使得舌下神经核对颏舌肌支配加强,颏舌肌活性增高,从而在清醒状态下维持咽腔开放。
阻塞性睡眠呼吸暂停;慢性间歇性缺氧;5-HT;5-HT 2A受体
阻塞性睡眠呼吸暂停(Obstructive Sleep Apnea,OSA)是以夜间反复发生上气道狭窄或塌陷为特征,导致上气道通气量减少或呼吸暂停、血氧饱和度下降和睡眠片段化[1-3]。在觉醒状态下,通过磁共振成像技术以及纤维喉镜检查结合Müller检查法发现,与正常人相比OSA患者的腭咽、舌咽横截面积相对较小,狭窄平面主要位于软腭后区以及舌后区[4,5]。由于咽部主要由肌肉和结缔组织组成,缺少足够的骨性结构支撑,这部分气道的开放主要依赖咽部扩张肌的收缩,尤其是颏舌肌。颏舌肌是上气道中最大的也是最主要的扩张肌,对OSA患者维持上气道开放起着重要作用[4]。
有研究证实在清醒状态下,OSA患者与健康正常人相比产生更高的上气道扩张肌活性[3,6,7]。Saboisky等[8]比较了OSAHS患者与正常人觉醒时颏舌肌的肌电活动,发现OSAHS患者的颏舌肌运动单位的动作电位区域较正常人大,维持时间也更久,得出OSAHS患者在觉醒状态时的确存在增大的颏舌肌肌肉活性,而且指出舌下神经核对颏舌肌的神经支配可能发生了改变。在睡眠呼吸暂停患者中,颏舌肌电活性的增高被认为是上气道解剖性狭窄状态的代偿机制,用来维持上气道的开放[1,9]。而在睡眠时颏舌肌活性的的丧失是OSA患者上气道塌陷进展过程中的主要因素[1,10]。那么为什么OSA患者在清醒状态下上气道肌肉的活动性会升高,答案还不是很明确。如果颏舌肌的活性下降,那么将导致咽腔狭窄,咽腔狭窄会导致上呼吸道狭窄,则最终会导致OSA。解剖学显示颏舌肌主要由舌下神经核发出的传出纤维舌下神经(hypoglossal nerve)支配,舌下神经运动核的兴奋会使颏舌肌收缩而开放咽腔。同时有研究证实5-HT能兴奋舌下运动神经核[11,12],增强舌下运动神经核对颏舌肌的支配而使颏舌肌活动性增加,5-HT对舌下神经核的支配具有状态依赖性,觉醒时活性最高,非快动眼睡眠期活性居中,在快动眼睡眠期活性最小甚至缺失[13,14]。慢性间歇性低氧(CIH)是OSA的主要病理生理特征[15]。在CIH动物模型中,动物出现了OSA患者典型症状以及动脉高血压、代谢紊乱、警觉性下降和认知功能损害。在本次实验中,我们检测在CIH后,清醒大鼠舌下神经运动核兴奋性神经递质5-HT及其相关物质变化,探讨代偿性上呼吸道扩张肌活性增加的可能中枢神经肌肉机制。
材料和方法
1 动物和造模
12只清洁级健康成年雄性 Sprague Dawley(SD)大鼠(8周龄,体重180~200g),由江苏省动物实验中心提供,采用随机数字法均分为间歇性低氧组(CIH组)和常氧对照组(Control组)。每天8:30至16:30将CIH组实验动物置于低氧舱中饲养, 循环交替给予氮气和压缩空气,同时用测氧仪检测舱内氧体积分数变化。每一循环120s:前60s给予氮气,使舱内氧体积分数逐渐降至5%,接着60s给予压缩空气,使舱内氧体积分数逐渐恢复至21%,保证舱内氧浓度在5%~21%之间循环。对照组在常压、大气环境培养舱中饲养,舱内氧体积分数维持在21%。实验结束将动物取出,送入常规饲养箱中,自由进食、水,生活环境及饲养条件相同。每天实验8小时,持续35天。本实验方案由南京医科大学实验动物伦理委员会批准。
2 实验取材和标本保存
造模结束后,两组动物在规定时间点以2%戊巴比妥钠(4mg/100g)麻醉后固定于手术木板上,置于解剖盘中,暴露胸腔并游离出心脏,灌流针经左心室插入升主动脉,剪开右心房,先用生理盐水(37℃)快速灌注5min(60ml)左右以移除血液,直到肝脏发白(防止残留的血液导致非特异性染色)。然后用4%多聚甲醛(pH7.4)(4℃)400ml-500ml灌注固定,直到动物的肝脏发硬,尾巴僵直,完成灌注。动物放置4度冰箱保存2小时,然后取脑干延髓部,继续保存在4%多聚甲醛中4度冰箱过夜(不要超过24h),第二天转移至20%蔗糖脱水至沉底,再转移至30%蔗糖脱水至沉底,然后做病理实验。
3 病理实验
3.1 尼氏染色
4 %多聚甲醛固定24小时的脑干在自动脱水机脱水后,行石蜡包埋(将脑干横断面朝下放入蜡模中,使之与模具底平齐)。然后行常规石蜡切片,将脑干切为 4μm厚的横断面。根据 Paxinos and Watson图谱选取舌下神经核所在的横断面。将切好的片子按顺序标记好,放入60℃烘箱中烘烤2小时,以防脱片。尼氏染色前再在60℃烘箱中烘片30min,立即将切片放入二甲苯Ⅰ、Ⅱ脱蜡各10min,然后放入无水乙醇、95%酒精Ⅰ、95%酒精Ⅱ、80%酒精、70%酒精中各5min,再放入蒸馏水中5min。切片放入硫堇染色液30min,用蒸馏水漂去浮色。切片再放入70%酒精30s,再置于无水乙醇Ⅰ、Ⅱ各3-5 min,再次将切片放入二甲苯Ⅰ、Ⅱ中各3-5 min,然后使用中性树胶封片。最后在显微镜下观察,留片。
3.2 免疫组织化学
脑干经蔗糖脱水沉底后,-80℃速冻,在冰冻切片机中将脑干切成30μm厚的横断面,根据Paxinos and Watson图谱,以脑干背侧“闩”为界,向上、向下分别连续切取30μm厚的脑片各6张(A-P Level:距离前囟为-4.50mm至-4.86mm),每一只大鼠共留取脑片12张,按顺序标记好。1、4、7、10号脑片用于c-fos免疫组织化学,2、5、8、11号脑片用于5-HT 2A受体免疫组化,剩余的3、6、9、12号脑片用于5-HT免疫组化。为减少实验误差,CIH组和对照组配对同时染色。严格按照SP法进行染色。一抗4℃下孵育24h,用相同稀释比的PBS替代一抗作阴性对照,DAB溶液显色,镜下观察阳性物质呈深棕色。最后采用IPP图像分析系统分析其平均光密度值(平均光密度值=累积光密度/面积),阳性细胞免疫反应性的强弱采用相对值累积光密度(integrated option density,IOD)表示。
4 统计学处理
采用SPSS18.0统计软件进行统计分析,结果均以均数±标准差(x¯±s)表示,两组间比较采用独立样本t-test。P<0.05为差异有统计学意义。
结果
1 对照组和CIH组舌下神经核尼氏染色结果比较(图1)
CIH组舌下运动神经元与对照组相比,神经元出现尼氏体崩解,细胞质淡染。
2 5-HT免疫组化结果比较(图2)
CIH组舌下神经核腹侧5-HT阳性末端数量为:337±71,背侧为:214±53,对照组舌下神经核腹侧5-HT阳性末端数量为:160±47,背侧为:104± 23。慢性间歇性低氧组腹侧、背侧5-HT阳性末端数量分别与对照组相比均显著升高(P<0.05),CIH组和对照组各自腹侧与背侧相比,腹侧高于背侧,差异有统计学意义(P<0.05)。
3 5-HT 2A受体免疫组化结果比较(图3)
慢性间歇性低氧组舌下神经核腹侧5-HT 2A受体平均光密度与对照组相比显著升高(P<0.05),CIH组背侧5-HT 2A受体平均光密度与对照组相比差异无统计学意义(P>0.05)。
4 C-fos免疫组化结果(图4)
CIH组舌下神经核腹侧、背侧C-fos表达量均高于对照组,差异均有统计学意义(P<0.05)。
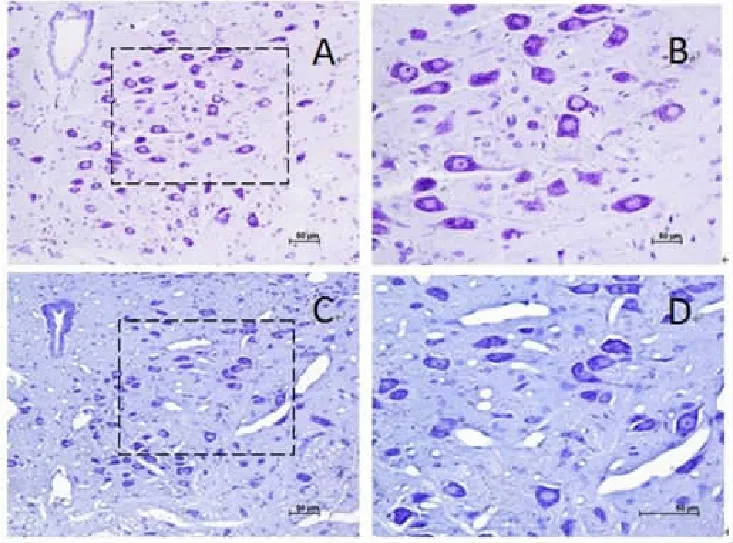
图 舌下神经核尼氏染色结果的比较

图2 5-HT免疫组化结果

图3 5-HT 2A受体免疫组化结果比较
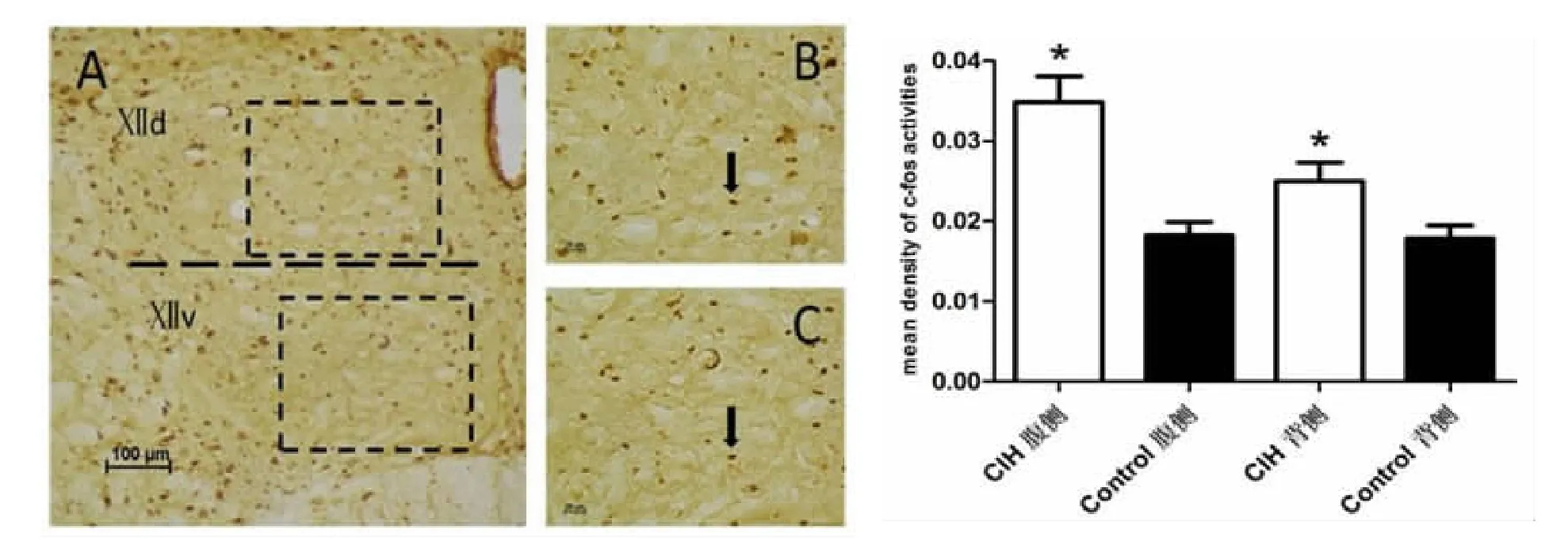
图4 C-fos免疫组化染色结果
讨论
实验结果显示,与健康动物相比慢性间歇性低氧动物舌下运动神经元内出现尼氏体崩解,细胞质淡染现象。免疫组化研究结果发现,与健康对照组动物比较,在CIH动物中,作用于舌下神经核的5-HT阳性末端及其5-HT 2A受体以及C-fos表达均增高。
尼氏体主要由平行排列的粗面内质网和核糖体组成,主要功能是合成蛋白质,供神经活动时所需,轴突端的蛋白质大都来自胞体的尼氏体。神经元在兴奋传导过程中,不断消耗某些蛋白质物质,尼氏体可合成新的蛋白质以补充这种消耗。尼氏体崩解,胞质淡染,提示慢性间歇性低氧导致舌下运动神经元损伤,可能导致舌下运动神经元活性下降,致使舌下神经对颏舌肌的支配减弱,进而咽腔进一步狭窄,缺氧加重,形成恶性循环。在实验中我们还发现CIH组动物舌下运动神经元C-fos的表达量高于对照组,差异有统计学意义。间歇低氧后C-fos被激活,参与调节细胞、组织对损伤刺激的信号传导及应答[16],目前C-fos基因的表达情况已作为受损神经细胞活性及反应性的标记物之一[17]。这间接地反映慢性间歇性低氧大鼠舌下运动神经元细胞活性增强。这与尼氏染色得出的结果相反。猜测这可能与低氧程度、低氧持续时间有关,可能是机体在一定程度缺氧条件下,部分细胞受到损伤,细胞功能下降,但还未完全损伤的细胞代偿性功能加强,活性增高。
舌下神经核是由支配舌肌的运动神经元胞体集合而成背、腹方向的两大纵列细胞柱,可分为背侧组和腹侧组。背侧组发出的轴突经舌下神经的外侧支而支配缩舌肌;腹侧组发出的轴突经舌下神经内侧支而支配伸舌肌,主要为颏舌肌。有研究发现OSA患者睡眠时颏舌肌活动下降较正常人更明显,而在觉醒时OSA患者颏舌肌活性明显高于正常人。研究证实5-羟色胺能神经通过与舌下神经元的5-HT受体结合,增强上呼吸道扩张肌收缩功能。当5-羟色胺能神经元激活时可引起颏舌肌收缩,上呼吸道扩张,而当5-羟色胺能神经元受抑制时,上呼吸道扩张度减小。在睡眠过程中5-羟色胺能神经元功能减弱,5-HT传递减少,对舌下神经元的驱动减少,从而舌下神经向颏舌肌发放电活动减少,最终导致颏舌肌收缩降低,进而引起上气道阻塞。在我们的研究中发现慢性间歇性低氧大鼠腹侧舌下运动神经元的5-HT阳性末端表达量显著高于正常对照组大鼠腹侧表达量,差异有统计学意义;同时CIH组大鼠背侧舌下运动神经元的5-HT阳性末端表达量也高于正常对照组大鼠其背侧表达量。提示慢性间歇性低氧导致5-HT能细胞对舌下神经运动核的腹侧、背侧核团兴奋性支配增强了。与此同时,CIH组大鼠舌下神经核腹侧神经元细胞表面5-HT 2A受体表达明显高于对照组,差异有统计学意义,CIH组大鼠而背侧舌下神经元细胞表面5-HT 2A受体表达与对照组无显著性差异。说明CIH组大鼠通过5-HT作用于兴奋性受体-5-HT 2A受体,使得舌下神经核腹侧神经元细胞兴奋性增高,舌下神经对颏舌肌发放的电活性增高,颏舌肌活性增强,进而引起上气道开放。这可能是一种机体为适应上气道解剖性狭窄的代偿机制。
总的来说,本研究提示慢性间歇性缺氧致使5-HT能神经元对舌下神经核的支配加强,从而导致OSA患者在觉醒状态下上气道颏舌肌活性较正常人高,以此适应上气道的解剖性狭窄。
1 Remmers JE,DegrootWJ,Sauerland EK,etal. Pathogenesis of upper airway occlusion during sleep.J Appl Physiol Respir Environ Exerc Physiol,1978,44(6): 931-938.
2 White DP.The pathogenesis of obstructive sleep apnea: advances in the past 100 years.Am J Respir Cell Mol Biol,2006,34(1):1-6.
3 Suratt PM,Mctier RF,Wilhoit SC.Upper airway muscle activation is augmented in patients with obstructive sleep apnea compared with that in normal subjects.Am Rev Respir Dis,1988,137(4):889-894.
4 高雪梅,黄席珍.阻塞性睡眠呼吸暂停综合征患者上气道大小的磁共振研究.北京医科大学学报,1999,31(5): 450-453.
5 叶京英,韩德民.阻塞性睡眠呼吸暂停综合征患者上气道的形态.中华耳鼻咽喉科杂志,2000,35(4):278-281.
6 Mezzanotte WS,Tangel DJ,White DP.Waking genioglossal electromyogram in sleep apnea patients versus normal controls (a neuromuscular compensatory mechanism).J Clin Invest,1992,89(5):1571-1579.
7 Hendricks JC,Petrof BJ,Panckeri K,et al.Upper airway dilating muscle hyperactivity during non-rapid eye movement sleep in English bulldogs.Am Rev Respir Dis, 1993,148(1):185-194.
8 Saboisky JP,Butler JE,Mckenzie DK,et al.Neural drive to human genioglossus in obstructive sleep apnoea.J Physiol,2007,585(Pt 1):135-146.
9 Schwab RJ,Gefter WB,Hoffman EA,et al.Dynamic upper airway imaging during awake respiration in normal subjects and patients with sleep disordered breathing.Am Rev Respir Dis,1993,148(5):1385-1400.
10 Mezzanotte WS,Tangel DJ,White DP.Influence of sleep onset on upper-airway muscle activity in apnea patients versus normal controls.Am J Respir Crit Care Med,1996, 153(6 Pt 1):1880-1887.
11 Jacobs BL,Azmitia EC.Structure and function of the brain serotonin system.Physiol Rev,1992,72(1):165-229.
12 Bayliss DA,Viana F,Talley EM,et al.Neuromodulation of hypoglossal motoneurons:cellular and developmental mechanisms.Respir Physiol,1997,110(2-3):139-150.
13 Aston-Jones G,Bloom FE.Activity of norepinephrinecontaining locus coeruleus neurons in behaving rats anticipates fluctuations in the sleep-waking cycle.J Neurosci,1981,1(8):876-886.
14 Trulson ME,Trulson VM.Activity of nucleus raphe pallidus neurons across the sleep-waking cycle in freely moving cats.Brain Res,1982,237(1):232-237.
15 DematteisM,Godin-RibuotD,Arnaud C,etal. Cardiovascular consequences of sleep -disordered breathing:contribution of animal models to understanding the human disease.ILAR J,2009,50(3):262-281.
16 Itoh H,Yagi M,Fushida S,et al.Activation of immediate early gene,c-fos,and c-jun in the rat small intestine after ischemia/reperfusion.Transplantation,2000,69(4): 598-604.
17 王政伟,尹彦玲,赵春平,等.脑血管痉挛后血管平滑肌细胞中c-fos基因表达及意义.中华神经外科疾病研究杂志,2002,1(2):173-175.
(收稿:2014-04-25 修回:2014-08-15)
The changes on density of serotonin terminals and receptors in hypoglossal motor nucleus under chronic intermittent hypoxia
ZHANG Minjuan,JIAO Cheng,YAN Jiangyu,LI Jing,YIN Min,CHENG Lei
Department of Otorhinolaryngology,The First Affiliated Hospital of Nanjing Medical University,Nanjing,Jiangsu, 210029,China
ObjectiveTo study CIH-induced damage on neurochemical markers of 5-HT,5-HT receptors and c-fos protein of hypoglossal nucleus in rat and the morphological changes of motoneurons of the hypoglossal.MethodsAdult male Sprague-Dawley (SD)rats(n=12)were randomly and meanly divided into two groups(the CIH group and the control group).The rats of CIH group were fed in low oxygen cabins(60s/N2,the fraction of oxygen volume reduced to 5%under hypoxia;and 60s/air alternately,the fraction of oxygen volume increased to 21%;between 8:30~16:30 each day)for 35 days.The control group was fed in atmospheric environment cabins.We study the morphology of hypoglossal nucleus by Nissal stain and the expression of c-fos protein,5-HT and receptors were detected by immunohistochemical method.ResultsNeurons in the hypoglossal nucleus of the CIH group became swollen,and Nissal bodies had collapsed and were stained lightly.The relative quantity of c-fos protein and neurochemical markers of 5-HT and receptors in CIH groups were significantly higher than that of the control group(P<0.05).ConclusionCIH-induced excessive expression of neurochemical markers of 5-HT and receptors in hypoglossal nucleus result in hypoglossal nerves activity raised and then led to genioglossus electroactive?increased.It is may play an important role in maintaining open pharyngeal in OSA patients.
Obstructive sleep apnea;Chronic intermittent hypoxia;5-HT;5-HT 2A
10.16542/j.cnki.issn.1007-4856.2015.02.003
江苏高校优势学科建设工程(JX10231801);江苏省人民医院创新团队(IRT-016)
1 南京医科大学第一附属医院 江苏省人民医院耳鼻咽喉科(南京,210029)
殷敏,副教授. Email:simisodo@hotmail.com
