7型猪链球菌免疫相关性蛋白乳酸脱氢酶的筛选与分析
2015-01-07高明明王淑杰刘永刚姜成刚涂亚斌蔡雪辉
高明明,王淑杰,刘永刚,姜成刚,王 刚,涂亚斌,蔡雪辉
(中国农业科学院 哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨150001)
7型猪链球菌免疫相关性蛋白乳酸脱氢酶的筛选与分析
高明明,王淑杰,刘永刚,姜成刚,王 刚,涂亚斌,蔡雪辉
(中国农业科学院 哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨150001)
【目的】 快速高效筛选7型猪链球菌免疫原性蛋白,以作为猪链球菌疫苗的候选分子。【方法】 以7型猪链球菌分离株WH07为样品,应用免疫蛋白质组学技术建立了WH07株全菌蛋白的双向电泳体系,并利用蛋白质免疫杂交技术筛选免疫原性蛋白。【结果】 获得了分辨率及重复性良好的双向电泳(2-DE)图谱,且得到3个具有免疫反应性的蛋白质点,经质谱鉴定其归属于1个蛋白,即乳酸脱氢酶(LDH)。生物信息学预测表明,该蛋白分子质量为 35 420 ku,理论等电点为5.05,具有2个跨膜区,分别位于第10~28位和第110~129位,并根据预测分析结果成功模拟了蛋白质的三级结构。【结论】 从猪链球菌WH07菌株中筛选并鉴定了1个具有免疫原性的蛋白,即乳酸脱氢酶,并模拟了其三级结构。
猪链球菌;免疫相关蛋白;双向电泳;质谱鉴定;蛋白结构预测
猪链球菌为革兰氏阳性球菌,是一种重要的人畜共患病病原菌,可引起关节炎、脑膜炎、败血症等[1]。我国曾于1998年和2005年暴发了2次较大规模的猪及人感染猪链球菌事件,累计报告感染人数达204例,其中死亡38例,可见猪链球菌的感染不仅会对养猪业造成巨大的损失,同时也会对公共卫生尤其是相关从业人员的生命安全造成严重威胁[2-4]。猪链球菌根据菌体荚膜抗原特性的不同,可分为35个血清型[5],分别为1~34型及1/2型,其中2型流行最广,但在近几年的流行病学调查中发现,7型猪链球菌也是经常分离到的血清型之一,其所占的比例有增加趋势,在某些地区甚至超过了2型[6-7],特别是近几年湖北省境内就已有7型感染增多的报道[8]。基于上述现象,对猪链球菌7型蛋白特性的研究也就显得非常必要。目前,市场上有商品化的猪链球菌灭活疫苗,但由于其对同种血清型菌株的免疫保护较好,对不同种血清型菌株的交叉保护较差,所以猪链球菌新型疫苗的研制成为该领域研究的热点。荚膜多糖在毒力机制方面占有重要地位,但却由于其缺乏免疫原性,而不能用于制作疫苗[9]。一些针对溶菌酶释放蛋白(MRP)、溶血素(SLY)等蛋白制作的亚单位疫苗已经生产,但研究发现缺失这些蛋白的菌株仍可以感染9~11日龄小猪[10]。因此,急需筛选鉴定出具有很好免疫原性的通用型亚单位疫苗候选抗原,并对这些蛋白的免疫机理进行研究,进而为开发新型、有效的猪链球菌疫苗奠定基础。
1 材料与方法
1.1 试验材料
猪链球菌(Streptococcussuis)7型毒株WH07,由中国农业科学院哈尔滨兽医研究所动物疫病诊断及技术服务中心保存;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;13 cm IPG胶条 (pH 4~7和pH 3~10)、IPG Buffer (pH 4~7和pH 3~10)、3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐(CHAPS)、二硫苏糖醇(DTT)、尿素、硫脲、碘乙酰胺(IAA)、2D Quant 试剂盒、2D Clean-up 试剂盒、考马斯亮蓝R-250,均购自美国GE healthcare公司;等电聚焦系统Ettan IPGphor Ⅲ、胶条槽Ettan IPGphor Manifold、标准垂直电泳系统 SE 600 Ruby及扫描仪Image Scanner,均为美国安玛西亚公司产品;2只清洁级雄性新西兰白兔(4月龄),由哈尔滨兽医研究所实验动物中心提供。
1.2 兔多抗血清的制备及其效价测定
用体积分数0.5%的福尔马林于37 ℃灭活WH07细菌菌体24 h,灭活后与等体积佐剂乳化,多点注射免疫新西兰白兔,免疫剂量为400 μg,每2周1次,共免疫3次,于第3次免疫后3 d进行耳缘静脉采血,间接ELISA法检测血清抗体效价。效价达到要求后进行心脏采血,收集血清,分装后于-20 ℃冷冻保存。免疫前采血,分离血清作为阴性对照。
1.3 细菌培养与蛋白样品的制备
将WH07菌液划线接种于含体积分数6%羊血的THB固体培养基中,37 ℃培养12 h,挑取单菌落接种于THB液体培养基,37 ℃摇床培养12 h,按1∶100体积比接种至400 mL THB液体培养液中,37 ℃摇床培养3~4 h,直至OD600值为0.8~1.0。将培养物于4 ℃、10 000 r/min离心30 min,收集菌体沉淀,并用预冷的去离子水洗涤3次,将所得沉淀100 ℃水浴加热10 min,加裂解液(7 mol/L 尿素、2 mol/L 硫脲、质量分数4% CHAPS、质量分数2% IPG Buffer、10 g/L DTT)冰浴超声10 min,加入 2.5 μg RNase A和100 U DNase,室温放置1 h,4 ℃、10 000 r/min离心30 min,收集上清后分装,于-80 ℃保存备用。
1.4 蛋白纯化与定量
用2D Clean-up 试剂盒对提取的全菌蛋白进行纯化和去除杂质处理,用2D Quant 试剂盒对处理过的全菌蛋白进行定量,确定其浓度。
1.5 双向电泳
使用13 cm pH 4~7的IPG胶条,取600 μg已定量样品,用水化液(7 mol/L尿素、2 mol/L硫脲、10 g/L DTT、质量分数2% CHAPS、体积分数2% IPG Buffer)补足至总体积为250 μL (上样前加体积分数0.5% IPG 缓冲液和10 g/L DTT),30 V条件下水化12 h 后,7 000 V电压聚焦2 h,完成第一向IEF。等电聚焦后,胶条在平衡液Ⅰ(0.05 mol/LTris-Cl pH 8.8,6 mol/L尿素,300 g/L甘油,20 g/L SDS,0.02 g/L溴酚蓝,10 g/L DTT)中平衡15 min,再在平衡液Ⅱ (10 g/L DTT换成40 g/L碘乙酰胺,其余组分同平衡液Ⅰ)中平衡15 min。将平衡后的IPG胶条转移到12.5% SDS-PAGE凝胶上,用1%低熔点琼脂糖封顶。凝胶先10 mA恒流进样1 h,再改为40 mA恒流直到溴酚蓝前沿到达凝胶底部,完成第二向SDS-PAGE。凝胶用考马斯亮蓝R-250染色过夜,后用质量分数10%冰醋酸脱色至背景清楚,Image Scanner进行图像扫描。
1.6 Western blot检测
双向电泳时采用2根胶条(为同一样品上样)同时进行。2块胶中1块用考马斯亮蓝 R250 加热染色,1块用于Western blot分析。Western blot检测步骤为:采用半干法将2-DE胶中的蛋白质转移到醋酸纤维素(NC)膜上,转移条件为15 V,35 min;转移后的NC膜用质量分数5%脱脂乳4 ℃封闭过夜。以猪链球菌WH07兔多抗血清(1∶100)为一抗,以1∶5 000辣根过氧化物酶标记的山羊抗兔IgG (HRP-IgG)为二抗,通过DAB显色液进行显色。
1.7 质谱鉴定分析
参照Western blot结果进行分析,将NC膜上出现免疫反应的点与另一块同时染色的2-DE胶上的蛋白斑点相对应,将对应的2-DE胶上的蛋白斑点用枪头取出放在水中保存,送北京蛋白质组研究中心进行质谱鉴定分析。
1.8 蛋白的基因鉴定
参照NCBI提供的猪链球菌全基因序列,对质谱鉴定出蛋白的基因序列设计引物: 5′-TGAGGATCCGGTCAAGAATTGGGTATC-3′和5′-CGC-GTCGACTTAGTTTTTTACA,引物中加入BamHⅠ和SalⅠ酶切位点(下划线部分),以WH07株基因组DNA为模板进行PCR扩增,预扩增长度为891 bp。
1.9 蛋白结构和特性的生物信息学分析
利用蛋白分析专家系统服务器 ExPASy Proteomics Server(http://ca.expasy.org/)所提供的蛋白质在线分析工具中的protparam(http://ca.expasy.org/tools/protparam.Html),预测分析氨基酸序列的分子质量、等电点、不稳定性指数等物理化学特性;利用TMHMM (http://genome.cbs.dtu.dk/service/TMHMM-2.0)预测氨基酸序列的跨膜区;利用PredictProtein (http://www.expasy.org)、SWISS-MODEL在线软件,点击“tertiary structures”,将LDH理论氨基酸序列输入相应对话框,提交运行;将所得数据提交RasMol软件,对LDH的空间结构进行模拟。
2 结果与分析
2.1 7型猪链球菌菌株全菌蛋白2D凝胶及免疫印迹图谱
将WH07全菌蛋白进行固相pH梯度等电聚焦和SDS-PAGE电泳,经考马斯亮蓝R250染色后进行扫描,获得电泳图谱。将同样方法处理的样品用2根胶条同时进行双向电泳,其中1块胶体经Western blot检测后,获得对应的转膜图谱如图1所示。
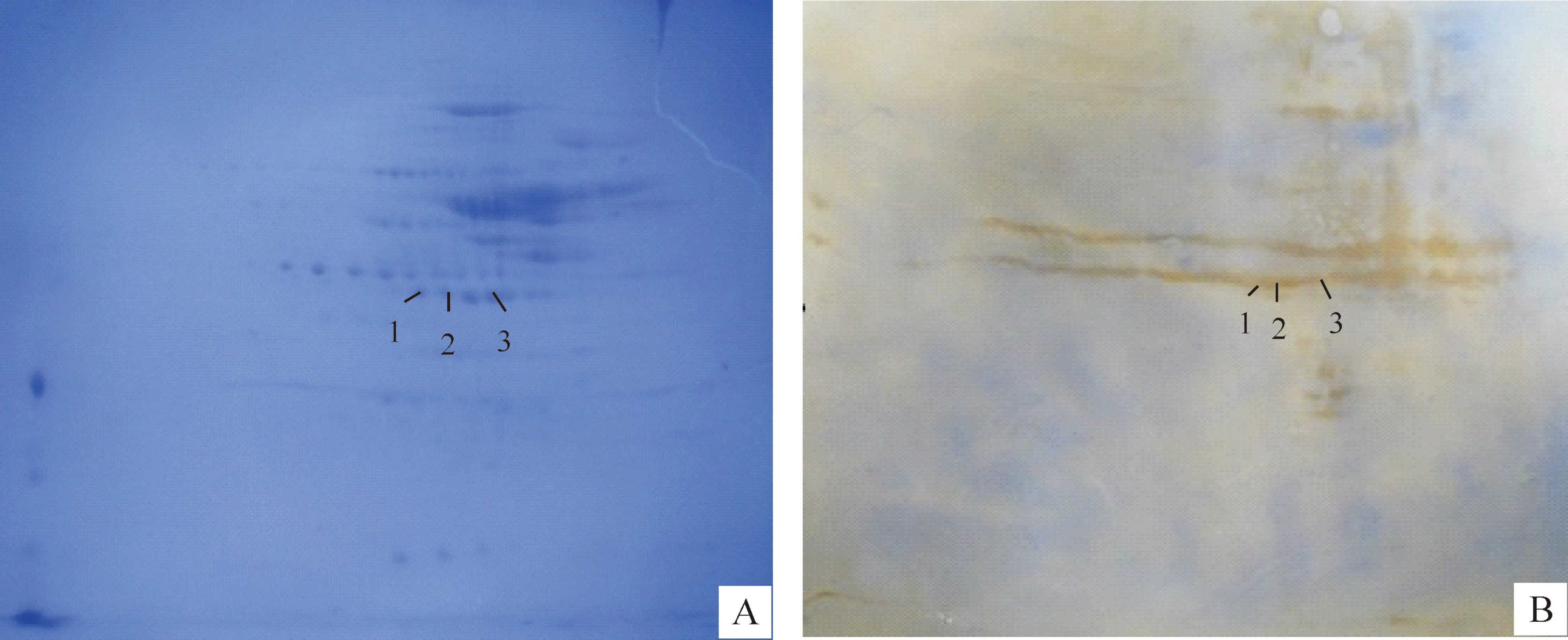
图1 7型猪链球菌WH07菌株全菌蛋白的蛋白质图谱(A)和免疫杂交图谱(B)图中蛋白质点1~3被选定进行质谱鉴定
2.2 蛋白质的质谱鉴定
将考马斯亮蓝染色胶与Western blot显色的膜图形进行比对,从考染胶上切取样品进行质谱分析,首先获得多肽的PMF(肽质量指纹图谱),然后选择其中强度大、峰形好的肽离子,送入高能撞池中碰碎(CID),对获得的碎片离子再进行TOF(飞行时间)分析。图2为选取蛋白质点的质谱图(PMF),图3为分子质量为1 704.9 ku的肽离子经CID碰碎后碎片的MS/MS质谱图。搜索蛋白质数据库,鉴定该蛋白为乳酸脱氢酶 (表1)。

图2 蛋白质的MALDI-TOF质谱(PMF)图
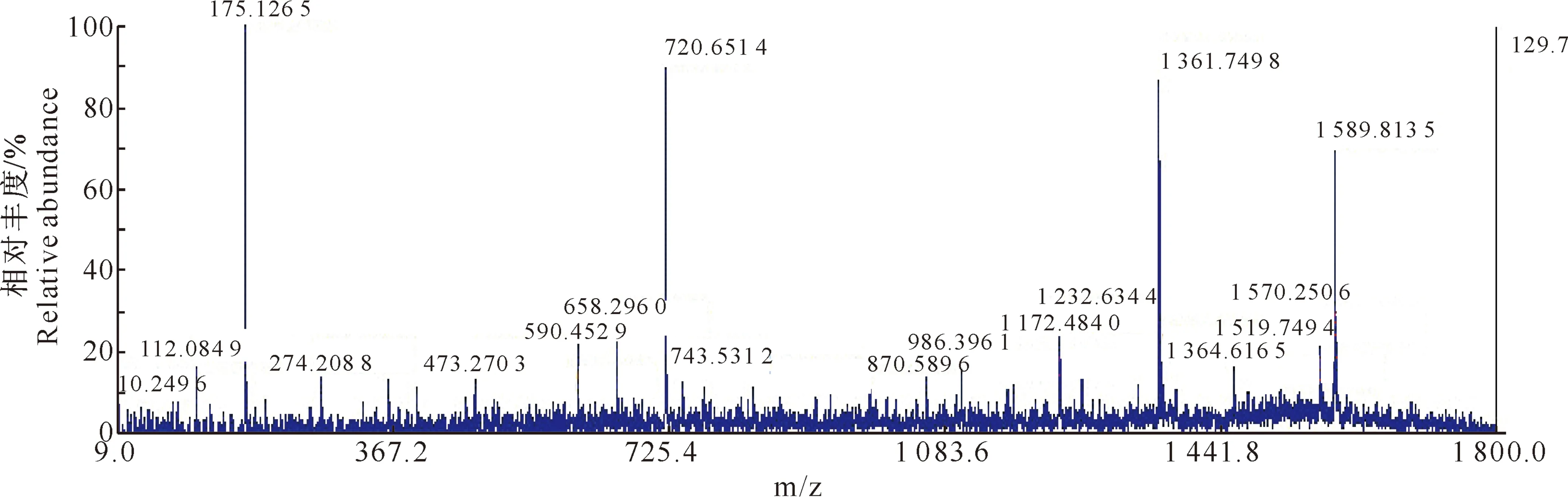
图3 分子质量1 704.9 ku肽离子CID 碰碎后碎片的MS/MS质谱图Fig.3 MS/MS spectrum of 1 704.9 ku peptide ion after CID crash

表1 候选蛋白点的质谱鉴定Table 1 Identification of selected spots by MS analysis
2.3 LDH基因的克隆鉴定
根据质谱鉴定结果,将从猪链球菌05ZYH33全基因序列中得到的乳酸脱氢酶的编码基因命名为LDH基因。设计引物并以WH07株基因组DNA为模板进行PCR扩增,结果(图4)显示扩增产物与预计大小相符,表明扩增获得了全长的LDH基因。将其克隆于表达质粒,构建pET30a-LDH重组质粒,双酶切鉴定结果(图5)和测序结果均正确。
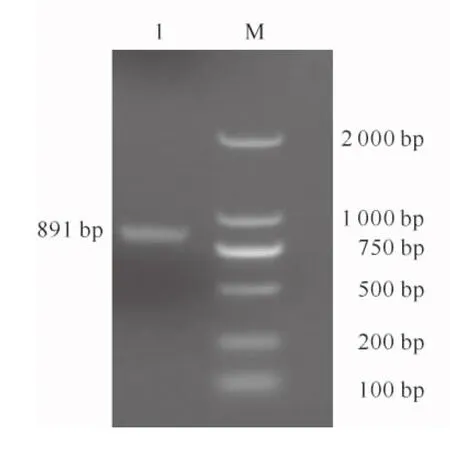
图4 LDH基因的PCR扩增1.LDH扩增产物;M.DL2000 MarkerFig.4 Amplification fragment of LDH gene by PCR1.Amplified products of LDH;M.DL2000 Marker
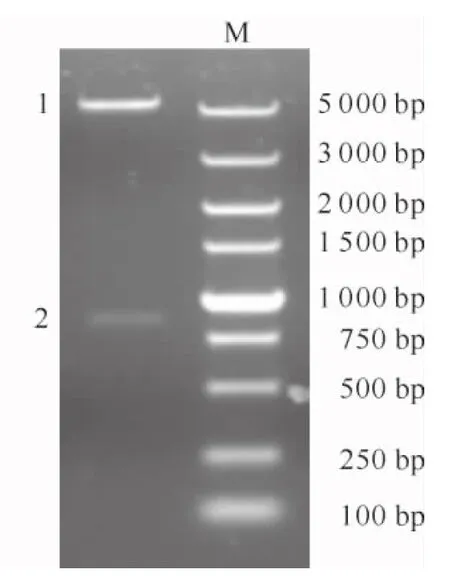
图5 pET30a-LDH的双酶切鉴定 1.pET30a载体;2.LDH基因;M.DL2000 MarkerFig.5 Double digestion identification of pET30a-LDH1.pET30a vector;2.LDH gene;M.DL2000 Marker
2.4 LDH的理化性质
LDH基因序列编码327个氨基酸,分子质量为35 420 ku,理论等电点为5.05,消光系数为34 380,总平均疏水性为-0.056;在哺乳动物体外的半衰期为30 h,在酵母、大肠埃希菌中的半衰期分别大于20和10 h;在溶液中的不稳定指数为25.69,低于阈值40,在水溶液中性质稳定。
2.5 LDH的跨膜结构预测
由图6可知,LDH蛋白质序列的长度为327个氨基酸,具有2个跨膜区,分别位于第10~28位和第110~129位。TMHMM预测结果显示,该蛋白为跨膜蛋白。
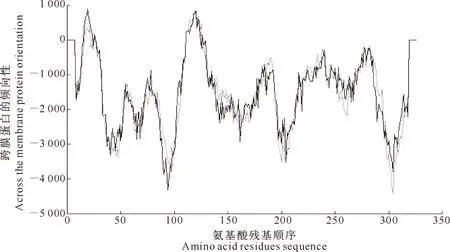
图6 LDH的跨膜区域预测
Fig.6 Prediction of trans-membrane domain of LDH
2.6 LDH的二级预测及三级结构模拟
LDH的二级结构预测结果如图7所示,其中α螺旋占41.9%,β折叠占14.4%,不规则卷曲占43.7%。

图7 LDH的二级结构预测
应用Internet/SW ISSMODEL/EXPASY/swiss2spdbv37 sp5网址分析模拟重组蛋白乳酸脱氢酶的三级结构,结果如图8所示。
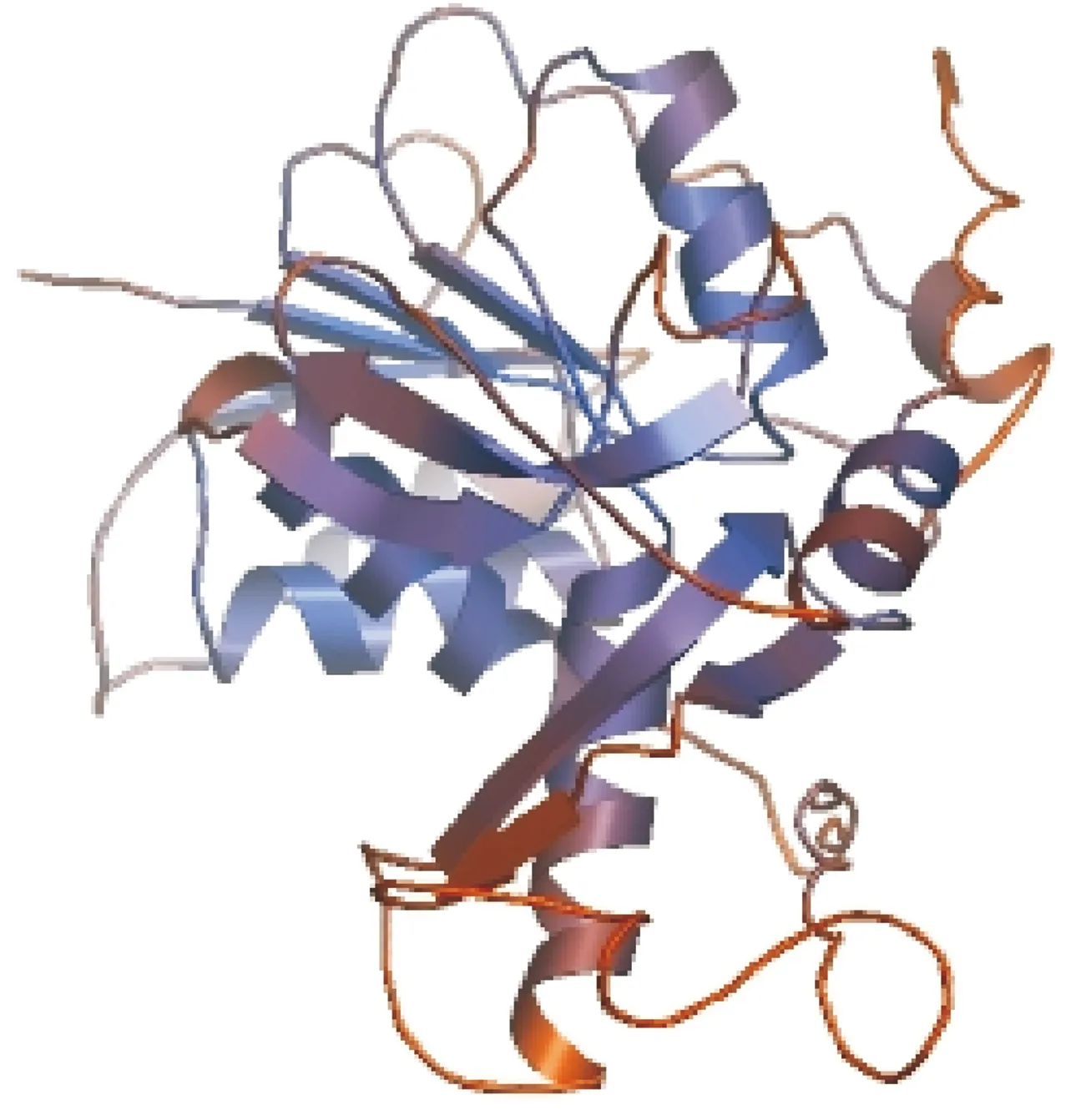
图8 乳酸脱氢酶的三级结构模拟
Fig.8 Prediction of tertiary structure of LDH
3 讨 论
传统生物学方法筛选免疫原性蛋白较为困难,不但耗时长,不能实现高通量筛选,而且可能存在假阳性反应。而免疫蛋白质组学方法则是将双向电泳分辨率高和质谱直接鉴定蛋白质的优势相结合,在蛋白胶上选取有免疫反应的蛋白质点进行质谱鉴定,可快速、高效、筛选并鉴定免疫原性蛋白[11]。本研究采用蛋白质组学方法成功从猪链球菌WH07菌株中筛选并鉴定了1个具有免疫原性的蛋白即乳酸脱氢酶。
乳酸脱氢酶(LDH)是一种糖酵解酶,能催化乳酸脱氢生成丙酮酸,共有5种同工酶形式,其氨基酸序列存在差异,虽然能催化相同的化学反应,但电泳迁移率和分子结构却有所不同[12]。LDH广泛存在于动物、植物及多种微生物中,目前关于LDH 的深入研究报道多集中在代谢途径中的作用方面[13],对其具有的免疫原性研究尚未见报道。
为进一步为7型猪链球菌病的防治筛选新的具有免疫原性的蛋白提供有价值的信息,本研究通过生物信息学方法对LDH进行了初步分析,表明LDH基因序列编码327个氨基酸,分子质量为 35 420 ku,理论等电点为5.05,在哺乳动物体外的半衰期为30 h,在酵母、大肠埃希菌中的半衰期分别大于20和10 h,在溶液中的不稳定指数为25.69(低于阈值40),在水溶液中性质稳定。一般来说,由于有机体内部的亲水性残基位于表面,因此蛋白质的亲水部位与蛋白质的抗原位点有密切的关系[14]。无规则卷曲区域除了决定蛋白质的功能外,也与抗原表位有关[15]。经分析,LDH二级结构中α螺旋(H)占41.9%,β折叠(E)占14.4%,不规则卷曲(C)占43.7%。该序列中α螺旋和无规则卷曲的比例为85.6%,提示该蛋白有很好的可塑性,可能与其功能有关[16]。LDH的三级结构模拟提供了该蛋白的立体构象信息,对于进一步研究其结构与功能的关系具有重要意义。
[1] 王 华,赵云玲,王君玮,等.猪链球菌病流行病学及其疫苗研究现状 [J].动物医学进展,2006,27(9):27-31.
Wang H,Zhao Y L,Wang J W,et al.Epidemiological status and vaccine research ofStreptococcussuis[J].Progress in Veterinary Medicine,2006,27(9):27-31.(in Chinese)
[2] Dekker C N T,Bouma A,Daemen A J J M,et al.Homologous whole bacterin vaccination is not able to reduceStreptococcussuisserotype 9 strain 7997 transmission among pigs or colonization [J].Vaccine,2012,30:1379-1387.
[3] 李 鹏,何永聚,冯书章.猪链球菌2 型新毒力相关基因的研究进展 [J].中国生物制品学杂志,2011,24(3):362-365.
Li P,He Y J,Feng S Z.Progress of new virulence genes inStreptococcussuistype 2 [J].Chinese Journal of Biologicals,2011,24(3):362-365.(in Chinese)
[4] Zhu H D,Huang D Y,Zhang W,et al.The novel virulence-related gene stp ofStreptococcussuisserotype 9 strain contributes to a significant reduction in mouse mortality [J].Microbial Pathogenesis,2011,51:442-453.
[5] Higgins R,Gottschalk M,Boudreau M,et al.Description of six new capsular types (29-34) ofStreptococcussuis[J].J Vet Diagn Invest,1995,7(3):405-406.
[6] 杨 珍,王楷宬,范伟兴,等.表观健康猪群携带猪链球菌情况流行病学调查 [J].中国人兽共患病学报,2009,25(10):977-979.
Yang Z,Wang K C,Fan W X,et al.Epidemiological apparently healthy pigs carryingStreptococcussuissituation [J].Chinese Journal of Zoonoses,2009,25(10):977-979.(in Chinese)
[7] Yu H,Jing H,Chen Z,et al.HumanStreptococcussuisoutbre-ak,Sichuan,China [J].Emerg Infect Dis,2006,12(6):914-920.
[8] Li J Q,Xia J,Tan C.Evaluation of the immunogenicity and the protective efficacy of a novel identified immunogenic protein,SsPepO,ofStreptococcussuisserotype 2 [J].Vaccine,2011,29:6514-6519.
[9] 耿红冉,郑玉玲,姜永强.2型猪链球菌疫苗候选分子的研究进展 [J].现代医学生物进展,2009,9(14):24-28.
Geng H R,Zheng Y L,Jiang Y Q.The research progress of vaccine candidate molecules forStreptococcussuistype 2 [J].The Progress of Modern Medical,2009,9(14):24-28.(in Chinese)
[10] Zhang W,Lu C P.Immunoproteomics of extracellular proteins of Chinese virulent strains ofStreptococcussuistype 2 [J].Proteomics,2007,7:4468-4476.
[11] Du H M,Huang W,Xie H F,et al.The genetically modified suilysin,rSLY P353L,provides a candidate vaccine that suppresses proinflammatory response and reduces fatality following infection withStreptococcussuis[J].Vaccine,2013,31:4209-4215.
[12] Kao S M,Miller E D,Su L.A leucine zipper motif in the cytoplasmic domain of gp41 is required for HIV21 replication and pathogenesis [J].Virology,2001,289:208-217.
[13] 王海燕,刘 铭,王化军,等.乳酸生产中的微生物代谢过程 [J].过程工程学报,2006(3):512-516.
Wang H Y,Liu M,Wang H J,et al.The microbial metabolic engineering of lactic acid production [J].The Chinese Journal of Proces Engineering,2006(3):512-516.(in Chinese)
[14] Mann M,Hendrickson R C,Pandey A.Analysis of proteins and proteomes by mass spectrometry [J].Annu Rev Biochem,2001,70:437-473.
[15] 杨丽红,张再超,孟庆玲,等.单核细胞增生李斯特菌新疆野毒株XS5 SigmaB操纵子的克隆、序列分析及其编码蛋白结构 预测 [J].中国农学通报,2012,28(32):72-77.
Yang L H,Zhang Z C,Meng Q L,et al.Monocytes hyperplasia of listeria in Xinjiang wild strains XS5 SigmaB cloning and sequence analysis of operon and its coding protein structure prediction [J].Chinese Agricultural Science Bulletin,2012,28(32):72-77.(in Chinese)
[16] Claverys J P,Prudhomme M,Martin B.Induction of competence regulons as a general response to stress in gram-positive bacteria [J].Annu Rev Microbiol,2006,60:451-475.
Screening and analysis of immune related proteins ofStreptococcussuisserotype 7
GAO Ming-ming,WANG Shu-jie,LIU Yong-gang,JIANG Cheng-gang, WANG Gang,TU Ya-bin,CAI Xue-hui
(1StateKeyLaboratoryofVeterinaryBiotechnology,HarbinVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Harbin,Heilongjiang150001,China)
【Objective】 This study aimed to identify the immune-associated proteins ofStreptococcussuisserotype 7 asS.suisvaccine candidates.【Method】 The two-dimensional gel electrophoresis (2-DE) forS.suisproteome separation was established forS.suisWH07 strain and the immune-related proteins were identified by western blot.【Result】 Three proteins were recognized byS.suispositive serum and identified as L-lactate dehydrogenase (LDH) by mass spectrometry analysis.The molecular mass of the predicted protein was 35 420 ku,its pI was 5.05,and there were two trans-membrane regions at 10-28 and 110-129,respectively.The tertiary structure of the protein was also successfully simulated according to the forecast analysis.【Conclusion】 This study screened and identified one immune-related protein from strain WH07 and simulated its tertiary structure.
Streptococcussuis;immune related protion;two-dimensional gel electrophoresis;immunity mass spectrum;structure prediction
时间:2015-09-09 15:41
10.13207/j.cnki.jnwafu.2015.10.001
2014-03-17
国家科技重大专项(2012ZX10004214);国家自然科学基金项目(31060281)
高明明(1987-),女,黑龙江明水人,硕士,主要从事动物生理学与生物化学研究。E-mail:gaoming5678@126.com
蔡雪辉(1966-),男,黑龙江明水人,研究员,主要从事动物病毒分子免疫学研究。E-mail:aci139@sina.com
S852.61+1
A
1671-9387(2015)10-0001-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150909.1541.002.html
