趋化因子CCL-19在慢性鼻-鼻窦炎患者鼻黏膜中的表达及意义*
2015-01-07张光伟陈始明王水斌2张雷波邹游孔勇刚许昱陶泽璋
张光伟陈始明王水斌,2张雷波邹游孔勇刚许昱陶泽璋
·实验研究·
趋化因子CCL-19在慢性鼻-鼻窦炎患者鼻黏膜中的表达及意义*
张光伟1陈始明1王水斌1,2张雷波1邹游1孔勇刚1许昱1陶泽璋1
目的观察趋化因子CCL-19在慢性鼻-鼻窦炎患者鼻黏膜中的表达及其病理意义。方法不伴鼻息肉的慢性鼻-鼻窦炎患者36例,伴有鼻息肉的慢性鼻-鼻窦炎患者5例,健康对照者12例,分别取鼻腔黏膜或息肉组织标本,Western blot法检测CCL-19蛋白表达活性,比较其在病变鼻黏膜、息肉组织和正常鼻黏膜中的表达差异,探讨其病理意义。结果鼻息肉组织和不伴鼻息肉的慢性鼻-鼻窦炎鼻黏膜组织CCL-19蛋白表达水平均较正常鼻黏膜明显上调,差异有统计学意义(P<0.05),水肿型病变黏膜组织尤为显著(P<0.05);嗜酸性粒细胞性慢性鼻窦炎CCL-19蛋白表达水平又明显高于非嗜酸性粒细胞性者(P<0.05)。结论水肿型慢性鼻窦炎和嗜酸性粒细胞性慢性鼻窦炎病变黏膜CCL-19表达明显上调,提示CCL-19表达活性可能与慢性鼻-鼻窦炎病变组织的嗜酸性粒细胞浸润和组织水肿密切相关。
趋化因子;慢性鼻-鼻窦炎;鼻息肉;病理意义
慢性鼻-鼻窦炎(chronic rhinosinusitis,CRS)是耳鼻咽喉头颈外科常见病和多发病,以鼻腔及鼻窦黏膜的慢性炎症为特征,也可能是某些全身性疾病的鼻部表现,如阿司匹林耐受不良、内源性哮喘、囊性纤维变性、Young综合征、Kartagener综合征等[1,2]。国际上常将CRS分为伴有鼻息肉(CRSwNP)和不伴有鼻息肉(CRSsNP)的慢性鼻-鼻窦炎两大类,前者以Th2升高为主,而后者以Th1升高为主[3,4]。据统计,CRSwNP在欧洲人群中的发病率为1%~4%[5]。CRSwNP以组织水肿和重塑为特征,表现为上皮增生和杯状细胞化生或者鳞状上皮化生,基底膜增厚,间质水肿和炎症细胞浸润。根据组织重塑的程度可以将CRS进一步分为腺体型,纤维炎症型及水肿型,或者根据嗜酸性粒细胞浸润的程度进一步可以分为嗜酸性粒细胞型和非嗜酸性粒细胞型[6,7]。CRS病因及发病机制至今尚不十分清晰。目前CRS被公认为是一种多致病因素导致的实体疾病,其发病学说包括中鼻道微环境紊乱、变态反应、阿司匹林耐受不良、遗传等。包括趋化因子和细胞因子在内的多种炎症介质在促进和维持炎症浸润,最终导致组织重塑,发展成CRS[8-10]。趋化因子(chemokines)主要分为CCL、CXCL、CX3L和XCL四种类型;其中CCL又称β趋化因子亚家族,是趋化因子中家族成员最多的亚型;现已发现28种,依次为CCL1~CCL28[11,12]。CCL趋化因子主要作用于单核细胞和淋巴细胞,还可以影响其他细胞,如促进嗜酸性粒细胞的迁移和趋化[13-16]。CCL-19是趋化因子的一种,研究证实其具有多重效应:能够趋化包括树突状细胞(DC)、T细胞、B细胞、NK细胞、巨噬细胞在内的多种细胞。CCL-19通过与受体CCR7相互作用发挥生物学效应,促进DC细胞与T细胞接触并呈递抗原从而激发有效免疫反应。然而,CCL-19是否在国人CRS中表达及其在国人CRS中的作用尚未见相关报道。在此基础上,本研究主要探讨趋化因子CCL-19在不同类型慢性鼻-鼻窦炎和正常人鼻黏膜组织中的表达差异,探讨CCL-19在慢性鼻-鼻窦炎中的作用及其意义。
资料与方法
1 临床资料
标本均来自2013年6月~2013年10月武汉大学人民医院耳鼻咽喉头颈外科鼻内镜手术患者。收集CRSwNP组织标本36例,其中男20例,女16例,平均年龄(36.08±17.26)岁。其中5例伴有变应性鼻炎或者支气管哮喘病史。CRSsNP组织标本5例,男3例,女2例,平均年龄(34.20±21.58)岁。正常对照组12例,其中男8例,女4例;平均年龄(24.08±7.26)岁。所有纳入CRS患者的诊断均符合中华耳鼻咽喉头颈外科学会推荐的诊断标准(2012年,昆明)[17]。以上病例均排除自身免疫性疾病、阿司匹林三联征以及原发性纤毛运动功能障碍和囊性纤维化。术前2周均未应用鼻内或者口服皮质类固醇激素。术中取CRSwNP患者息肉组织、CRSsNP患者钩突黏膜组织以及鼻中隔偏曲患者下鼻甲后端黏膜组织(作为正常对照组)。标本取材后立即用生理盐水清洗其表面黏液和血渍。标本一分为二:一份液氮保存备用行蛋白印迹实验,另一份4%多聚甲醛固定24h后行常规石蜡包埋。所有患者在入组前均同意参与本实验并签署知情同意书。
2 方法
2.1 石蜡切片染色
每个石蜡标本连续切片3张,厚4μm,分别进行Masson三色染色、苏木精-伊红染色(HE)以及过碘酸-雪夫(periodic acid-Schiff,PAS)染色。染色步骤按照说明书进行。根据组织染色结果进行CRS组织形态学分析。每个样本随机选取10个高倍视野计算嗜酸粒细胞占总炎性细胞的百分比,如平均值>10%认为是嗜酸粒细胞性CRS,否则为非嗜酸粒细胞性CRS。
2.2 Western blot法检测CCL-19蛋白的表达
将组织剪成细小的碎片,按每20mg组织加入150~250μl裂解液的比例加入裂解液,匀浆器匀浆直至完全裂解,裂解后的样品4℃12000g离心15分钟,取上清;根据BCA法测定样品蛋白浓度;配制12%的分离胶以及制备浓缩胶;每孔上样量为25μg蛋白,浓缩胶75V 40分钟,分离胶120V 55分钟;转膜200mA 1小时;封闭:5%脱脂奶粉4℃过夜;一抗:根据说明书CCL-19 1:1000(兔抗人Abcam公司)、β-actin 1:1000稀释抗体(兔抗人Fermentas公司),膜室温孵育2小时;二抗:孵育一抗的膜用TBST洗涤3次,每次5分钟;1:1000稀释HRP标记的二抗(羊抗兔碧云天公司),与膜37℃孵育1h;用TBST洗涤3次,每次5分钟;ECL化学发光检测。
3 统计处理
采用SPSS 17.0进行统计学分析。计数资料用例数表示,组间比较采用卡方检验。计量资料依据是否服从正态分布,用均数±标准差(+s)表示,组间比较采用方差分析。设定P<0.05为有统计学意义。
结果
1 临床病例特征
正常对照组、慢性鼻窦炎不伴鼻息肉及慢性鼻窦炎伴鼻息肉患者的临床资料分析:各组年龄、性别差异无统计学意义,具有可比性(卡方值χ2= 0.463,P>0.05)。(表1)。

表1 三组研究对象的临床特征
2 石蜡切片HE、Masson、PAS染色镜下观察结果
HE染色使嗜酸性粒细胞胞浆呈现红色;Masson可使胶原纤维呈现蓝色;PAS可使黏液腺细胞胞浆呈现红色。CRS按照组织形态学特点分为三型:①水肿型,有较多的嗜酸性粒细胞;②腺体型,黏液腺体明显增生肥大;③纤维炎症型,胶原纤维显著增生,其间伴有数量不等的炎症细胞。本研究通过三种不同的染色方法对CRS进行病理分析。结果如图1所示:水肿型有22例,纤维炎症型11例,腺体型8例。按照嗜酸性粒细胞多少进一步分为嗜酸性粒细胞型14例,非嗜酸性粒细胞27例。

图1 石蜡切片HE、PAS、Masson染色:水肿型22例,纤维炎症型11例,腺体型8例。按照嗜酸性粒细胞多少分为嗜酸性粒细胞型14例,非嗜酸性粒细胞27例,放大倍数:200倍。
3 Westernblot检测CCL-19蛋白的表达情况
3.1 依据有无息肉形成,将CRS分为CRSsNP和CRSwNP。本研究中CRSsNP 5例,CRSwNP 36例。如图2所示,各组中CCL-19蛋白的光密度值依次为正常对照组(+s=0.292±0.085、n=2)、慢性鼻窦炎不伴鼻息肉组(+s=0.483±0.090、n=5)、慢性鼻窦炎伴鼻息肉组(+s=0.682±0.078、n=36)。和正常对照组相比,CCL-19蛋白表达水平在CRSsNP(P= 0.001,P<0.05)和CRSwNP(P=0.029,P<0.05)均显著上调,差异具有统计学意义;CRSwNP组较CRSsNP组表达升高(P=0.037,P<0.05),差异具有统计学意义。
3.2 依据组织病理特点,将CRS分为水肿型,纤维炎症型,腺体型。图3所示:各组中CCL-19蛋白的光密度值依次为正常对照组(+s=0.292±0.085、n= 12)、腺体型(+s=0.350±0.064、n=8)、纤维炎症型(x¯ +s=0.586±0.102、n=11)、水肿型(+s=0.746±0.089、n=22)。相比于正常对照组,CCL-19蛋白在纤维炎症型和水肿型CRS中的表达水平均明显增加,差异均具有统计学意义(P值分别为0.042、0.003,P<0.05);CCL-19蛋白在腺体型CRS表达上调,但是没有统计学差异(P=0.320,P<0.05)。
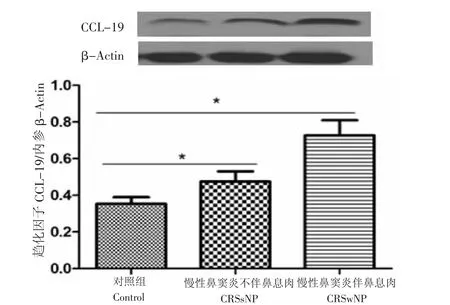
图2 CCL-19在对照组、CRSsNP和CRSwNP中的表达:和正常对照组相比,CCL-19蛋白表达水平在CRSsNP和CRSwNP均显著上调,差异具有统计学意义,*P<0.05。
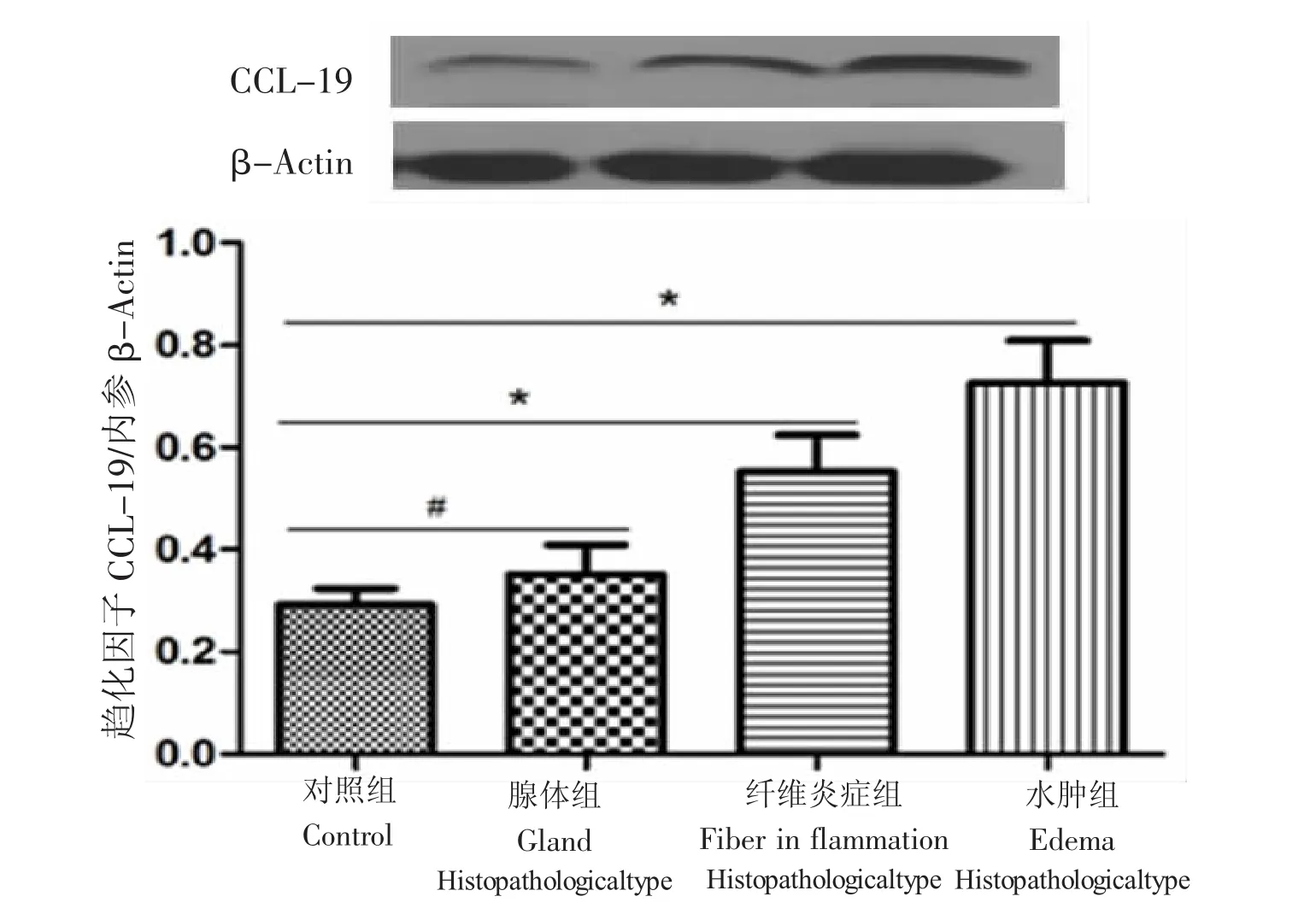
图3 CCL-19在对照组、腺体型、纤维炎症型及水肿型CRS中的表达。相比于正常对照组,CCL-19蛋白在纤维炎症型和水肿型CRS中的表达水平均明显增加,差异具有统计学意义;CCL-19蛋白在腺体型CRS表达上调,但是差异无统计学意义。*P<0.05,#P>0.05。
3.3 依据嗜酸粒细胞占总炎症细胞比例将CRS分为嗜酸粒细胞CRS和非嗜酸粒细胞CRS[15]。本研究中嗜酸粒细胞CRS 14例,非嗜酸粒细胞CRS 27例。如图4所示:各组中CCL-19蛋白的光密度值为正常对照组(+s=0.292±0.085、n=12)、非嗜酸性粒细胞组(+s=0.4858±0.072、n=27)、嗜酸性粒细胞组(+s=0.708±0.069、n=14)。和正常对照组相比,CCL-19蛋白表达水平在嗜酸粒细胞CRS和非嗜酸粒细胞CRS显著上调(P值分别为0.001,0.010),而且在嗜酸粒细胞CRS中上调更为明显,差异具有统计学意义(P<0.05);嗜酸粒细胞CRS组较非嗜酸粒细胞CRS组显著上调(P=0.036,P<0.05),差异具有统计学意义。

图4 CCL-19在对照组、非嗜酸性粒细胞CRS及嗜酸性粒细胞CRS中的表达。CCL-19蛋白表达水平在嗜酸粒细胞CRS和非嗜酸粒细胞CRS显著上调,而且在嗜酸粒细胞CRS中上调更为明显,差异具有统计学意义,*P<0.05。
讨论
CRS鼻腔和鼻窦黏膜慢性持续性炎症病变,其发病机制可能是细菌、病毒及真菌感染、窦口鼻道复合体阻塞、黏膜纤毛功能障碍、变态反应、全身及其他因素单独作用或相互作用的结果。但其确切发病机制并不十分清楚。CRS可以分为CRSsNP和CRSwNP两大类,这两种类型CRS具有不同的免疫病理特征。CRSsNP以Th1细胞为主,具有较多的中性粒细胞和IFN-γ。而CRSwNP以Th2细胞为主,伴有较多的肥大细胞和嗜酸性粒细胞浸润。Th2分泌的细胞因子IL-4、IL-5及IL-13等在CRSwNP形成过程中发挥了重要作用[18-21]。IL-4主要是介导肥大细胞脱颗粒,促进组织水肿。IL-5是影响嗜酸性粒细胞浸润和活化等生物学活性的关键因素之一,拮抗IL-5的生物学效应成为探索鼻息肉药物治疗的方向。但是阻断IL-5等Th2细胞因子并不能完全抑制CRSwNP的病理过程,这提示Th2不是CRSwNP发病的唯一机制,其它因素也和CRSwNP的发生和发展有密切关系。
趋化因子CCL-19是由69个氨基酸构成的分子量约为7.8kDa的蛋白,其别名又可称为PARC、MIP-4、AMAC-1及DCCK-1。淋巴结、脾脏、扁桃体的T细胞区的间质细胞,以及淋巴管内皮细胞等均可以表达CCL-19[22-23]。CCL-19可以参与众多细胞的趋化,包括初始T细胞、记忆T细胞、Th2细胞及成熟的DC细胞等,在炎症和免疫等疾病中发挥了重要作用。既往研究表明Th2细胞因子IL-4、IL-10、IL-13均可参与调控CLL19的表达调控[24]。
在欧美人群鼻息肉组织中发现:在mRNA水平CCL-19在CRSwNP鼻息肉组织及CRSsNP钩突组织中的表达较正常对照组表达明显升高[25]。在此基础上,通过蛋白印迹及免疫荧光实验(其结果另文发表)我们对CCL-19在国人慢性鼻鼻窦炎中的作用进行了进一步的研究:将鼻息肉组织按照病理特征分型以及按照嗜酸性粒细胞的浸润程度不同分组比较发现:CCL-19蛋白表达水平在伴鼻息肉和不伴有鼻息肉的慢性鼻窦炎组织中均较正常鼻黏膜组织中明显上调。就不同类型的鼻息肉黏膜组织比较,CCL-19蛋白表达水平在纤维炎症型和水肿型鼻窦黏膜组织中均高于正常鼻黏膜组织,以水肿型上调最为显著。在嗜酸性粒细胞慢性鼻窦炎中其表达明显高于非嗜酸性粒细胞鼻窦炎黏膜组织。该结果证实CCL-19与国人慢性鼻鼻窦黏膜组织的水肿及嗜酸性粒细胞浸润密切相关。
Takamura等[26]研究发现CCL19有重要的拮抗过敏的作用。CCL19基因敲除的小鼠过敏症状较野生型小鼠严重,Th2细胞反应增强。而当给予质粒编码的CCL19 SerDNA基因治疗后变应性反应明显受到抑制,CCL19可能通过促进IL-10的产生,或者有助于树突状细胞作用的局限化,或者诱导成熟树突细胞的凋亡等机制发挥免疫抑制作用。那么本研究结果CCL-19在鼻息肉组织中明显高表达是如何形成的呢?我们推测其原因有两个方面:其一是由于水肿及嗜酸性粒细胞浸润后引起了CCL-19的反应性增高,这种增高理论上是一种保护性的,但是由于局部多种炎症刺激的作用导致这种保护性升高尚不足以使水肿及嗜酸性粒细胞浸润消退,也不足以阻止息肉的发生、发展。其二是慢性鼻鼻窦炎特别是鼻息肉的发生发展是由多个因素共同作用的结果,CCL-19的高表达有可能是其中某些因素直接作用的结果。但其结果是一样的:这种增高尚不足以阻止息肉的发生、发展。
总之,本研究发现CCL-19在国人CRSwNP和CRSsNP组织中表达均显著升高,在嗜酸性粒细胞CRS组织中表达更为显著,证实CCL-19的升高与CRS的发病密切相关。通过对不同组织类型的CRSwNP分组发现CCL-19在水肿型CRS组织中表达升高尤其明显,因此推测CCL-19的增加与CRS中嗜酸性粒细胞浸润和组织水肿密切相关。由于本研究为非大样本研究,且研究指标也有局限,因此CCL-19与CRS发病的确切机制及其潜在的靶向治疗价值有待深入研究。
1 Settipane G A.Epidemiology of nasal polyps.Allergy and Asthma Proceedings.OceanSide Publications,Inc,1996, 17(5):231-236.
2 顾之燕.阿司匹林耐受不良:鼻炎,鼻窦炎,鼻息肉和支气管哮喘.临床耳鼻咽喉科杂志,2000,14(8):381-383.
3 Fokkens W J,Lund V J,Mullol J,et al.EPOS 2012: European position paper on rhinosinusitis and nasal polyps2012.Asummaryforotorhinolaryngologists. Rhinology,2012,50(1):1-12.
4 Polzehl D,Moeller P,Riechelmann H,et al.Distinct features of chronic rhinosinusitis with and without nasal polyps.Allergy,2006,61(11):1275-1279.
5 Pearlman A N,Chandra R K,Conley D B,et al. Epidemiology of nasal polyps.Nasal Polyposis.Springer Berlin Heidelberg,2010:9-15.
6 Couto LGF,Fernades AM,Brandao DF,et al.Histological aspectsofrhinosinusalpolyps.RevistaBrasileirade Otorrinolaringologia,2008,74(2):207-212.
7 Hu Y,Cao PP,Liang GT,et al.Diagnostic significance of bloodeosinophilcountineosinophilicchronic rhinosinusitis with nasal polyps in Chinese adults.The Laryngoscope,2012,122(3):498-503.
8 Charo IF,Ransohoff RM.The many roles of chemokines and chemokine receptors in inflammation.New England Journal of Medicine,2006,354(6):610-621.
9 宋忠义,张玲,李建东,等.淋巴细胞过度活化及细胞因子与鼻息肉的免疫发病机制研究.临床耳鼻咽喉头颈外科杂志,2009,23(5):201-204.
10 闫舒,李娜,杨艳华,等.鼻息肉的组织病理学特征及其发病机制.山东大学耳鼻喉眼学报,2008,22(1):52-54.
11 Pease J E,Williams T J.Chemokines and their receptors inallergicdisease.Journalofallergyandclinical immunology,2006,118(2):305-318.
12 Zlotnik A,Yoshie O.Chemokines:a new classification system and their role in immunity.Immunity,2000,12(2): 121-127.
13 林志斌,李添应,陈彦球,等.鼻息肉患者总IgE与嗜酸粒细胞阳离子蛋白分析.中华临床免疫和变态反应杂志,2007,1(1):31-33.
14 陈嵘,史剑波,许庚,等.鼻息肉组织T淋巴细胞IFN-γ,IL-4的表达[J].中国病理生理杂志,2003,19(12): 1623-1626.
15 王挥戈,林歆胜,沈志忠,等.树突状细胞在鼻息肉组织中的浸润及其意义.中华临床医师杂志(电子版),2009, 3(3):13-17.
16 Lebre MC,Burwell T,Vieira PL,et al.Differential expression of inflammatory chemokines by Th1-and Th2-cell promoting dendritic cells:a role for different mature dendritic cell populations in attracting appropriate effector cells to peripheral sites of inflammation.Immunology and cell biology,2005,83(5):525-535.
17 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组,中华医学会耳鼻咽喉头颈外科学分会鼻科学组.慢性鼻-鼻窦炎诊断和治疗指南(2012年,昆明).中华耳鼻咽喉头颈外科杂志,2013,48(2):92-94.
18 Lezcano Meza D,Dávila Dávila B,Vega Miranda A,et al. Interleukin(IL)4 and to a lesser extent either IL 13 or interferon gamma regulate the production of eotaxin 2/ CCL24 in nasal polyps.Allergy,2003,58(10):1011-1017.
19 任秀敏,何强,蒋新霞.白介素-4,白介素-5在鼻息肉及鼻息肉病组织中的表达.河北医药,2009,31(22): 3036-3038.
20 李云秋,冯永,王继华.鼻息肉中核因子κB亚单位P50活性与IL-4,γ-IFN因子表达的关系.山东大学耳鼻喉眼学报,2008,22(1):48-51.
21 Gevaert P,Lang-Loidolt D,Lackner A,et al.Nasal IL-5 levels determine the response to anti IL-5 treatment in patients with nasal polyps.Journal of allergy and clinical immunology,2006,118(5):1133-1141.
22 Mburu Y K,Wang J,Wood M A,et al.CCR7 mediates inflammation-associated tumor progression.Immunologic research,2006,36(1-3):61-72.
23 杨银龙,欧周罗,邵志敏.CCL19/21-CCR7生物学轴与肿瘤转移.国际肿瘤学杂志,2006,33(8):564-567.
24 Oo Y H,Adams D H.The role of chemokines in the recruitmentoflymphocytestotheliver.Journalof autoimmunity,2010,34(1):45-54.
25 C.J.Ocampo,A.Kato,J.Norton,R.C.Kern,D.B. Conley,et al.Elevated Expression of mRNA for CCL2, CCL19,CCR7 and CXCR3 in Chronic Rhinosinusitis with Nasal Polyposis.J Allergy Clin Immunol,2012,129(2): 410-20.
26 Takamura K,Fukuyama S,Nagatake T,et al.Regulatory role of lymphoid chemokine CCL19 and CCL21 in the control of allergic rhinitis.The Journal of Immunology, 2007,179(9):5897-5906.
(收稿:2014-10-24修回:2014-11-19)
Expressive level and its pathological implications of chemokines CCL-19 in tissue samples of nasal mucosa and polyps among cases with chronic rhinosinusitis
ZHANG Guangwei,CHEN Shiming,WANG Shuibin,ZHANG Leibo,ZOU You,KONG Yonggang, XU Yu,TAO Zezhang
Department of Otolaryngology-Head&Neck Surgery,Renmin Hospital of Wuhan University, Hubei,430060,China
ObjectiveTo investigate the expressive level and its pathological implications of chemokines CCL-19 in tissue samples of nasal mucosa and polyps among cases with chronic rhinosinusitis(CRS).MethodsIncluded in this study were 36 cases of CRS but without nasal polyps,12 cases of CRS but with nasal polyps,and 12 healthy persons as control.Tissue samples were taken from their nasal mucosa or polyps respectively.Then,Western bloting procedures were taken to detect the expressive level of CCL-19 in all tissue samples to compare the differences in its expressive activity in different kinds tissue and to explore its pathological implications in various kinds of condition.ResultsThe expressive level of CCL-19 was significantly elevated in the tissues of nasal mucosa and polyps among cases with chronic rhinosinusitis,no matter CRS patients with or without nasal polyps when compared with normal nasal mucosa(P<0.05).Its expressive activity was particularly up-regulated in the tissue samples coming from edematous type of lesion(P<0.05).Furthermore,the expression of CCL-19 was significantly higher in the type of CRS with eosinophils infiltration than that in the type of condition with no eosinophils infiltration(P<0.05).ConclusionsThe expressive leevel of CCL-19 is highly up-regulated in the pathological tissue of CRS,either wirh edematous type of lesion or the type of lesion with eosinophils infiltration. Therefore,it may be suggested that the expressive activity of CCL-19 is closely associated with eosinophil infiltration and tissue edema development in the pathological process of chronic rhinosinusitis.
Chemotactic factor;Chronic rhinosinusitis;Nasal polyps;Pathological implications
10.3969/j.issn.1007-4856.2015.01.001
2012卫生部卫生公益性行业科研专项:《耳鼻重大疾病的早期发现、规范诊治和防控体系研究及推广应用》(201202005);国家自然科学基金(81070766);湖北省自然科学基金(2012FFB04312)。
1 武汉大学人民医院耳鼻咽喉头颈外科(湖北武汉,430060)
2 湖北省宜昌市夷陵区医院眼耳鼻咽喉科
陶泽璋,主任医师.E-mail:taozezhang@163.com
