土生拉乌尔菌Y20产乳糖氧化酶发酵条件优化
2015-01-06赵素洁孙宇强
宁 崇, 郑 艳, 赵素洁, 孙宇强
(沈阳农业大学 食品学院,辽宁 沈阳 110086)
土生拉乌尔菌Y20产乳糖氧化酶发酵条件优化
宁 崇, 郑 艳*, 赵素洁, 孙宇强
(沈阳农业大学 食品学院,辽宁 沈阳 110086)
以选育的土生拉乌尔菌(Y20)为生产菌株,在单因素和响应面分析的基础上考察了不同发酵条件对乳糖氧化酶活性的影响。方差分析结果表明,发酵条件对乳糖氧化酶活性影响次序:初始pH>发酵时间>接种体积分数>发酵温度。响应面分析优化的最适发酵条件:发酵时间25 h,发酵温度28℃,初始pH 7.2,接种体积分数2%。最优发酵条件下乳糖氧化酶的实际酶活可达78.36 U/g,与预测的酶活78.85 U/g接近。
土生拉乌尔菌Y20;乳糖氧化酶;响应面分析;优化
乳糖酸是一种新型的多羟基有机酸[1],因其具有多种生理功能而被广泛应用于食品、医药和精细化工行业[2-3]。目前,欧美等国家乳糖酸的生产主要采用化学合成法[4]。但该方法在氧化过程中伴有多种副产物的生成,致使产品分离纯化比较困难,生产成本相对较高,因此乳糖酸一直未能成为大众的化工商品,限制了其应用范围。酶法生产乳糖酸始于1998年,主要采用两步法。所用酶主要有纤维二糖酶、葡萄糖氧化酶、葡萄糖果糖氧化还原酶等,该法由于所用酶的底物专一性、稳定性等原因始终难以和化学合成法抗衡。
2001年Xu等发现的一种新的碳水化合物氧化酶——乳糖氧化酶[5],该酶对乳糖氧化为乳糖酸具有较高的特异性[6]。乳糖氧化酶可以将单糖、二糖、多糖氧化,并将电子直接传递给氧气,生成过氧化氢,再通过催化反应将过氧化氢还原为水[7],在食品中是安全的。这种酶含有FAD,与已经报道的葡萄糖氧化酶、己糖氧化酶或吡喃糖氧化酶不同,对寡聚糖和长碳链的聚合糖类有很高的活性,乳糖氧化酶对乳糖的亲和性也很高[8]。
以选育的土生拉乌尔菌(Y20)为出发菌株,通过单因素及响应面分析设计试验对乳糖氧化酶的发酵条件进行初步研究[9-11],以期为该酶的发酵生产提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种 土生拉乌尔菌 Raoultella terrigena(Y20):沈阳农业大学食品学院生物技术实验室选育。
1.1.2 培养基配方 固体培养基:乳糖 10 g、蛋白胨10 g、NH4NO32 g、NaCl 2 g、KH2PO41 g、K2HPO41 g、MgSO40.5 g、琼脂15 g、蒸馏水1 000 mL;pH 7.2~7.4。
液体培养基:同固体培养基,不加琼脂。
1.2 方法
1.2.1 培养方法 将土生拉乌尔菌(Y20)在固体培养基上活化后,接种于液体培养基中,于28℃下培养24 h[12]。
1.2.2 发酵条件对菌株(Y20)产乳糖氧化酶能力的影响
1)发酵时间对菌株(Y20)产乳糖氧化酶能力的影响:将菌株以1%接种体积分数接种在乳糖氧化酶发酵培养基中,其他条件相同的情况下培养12、24、36、48、60 h,测定其酶活性。
2)发酵温度对菌株(Y20)产乳糖氧化酶能力的影响:将菌株以1%的接种体积分数接种在乳糖氧化酶发酵培养基中,在其他条件相同的情况下于24、26、28、30、32℃培养24 h,测定其酶活性。
3)起始pH值对菌株(Y20)产乳糖氧化酶能力的影响:将菌株以1%的接种体积分数接种在产乳糖氧化酶发酵培养基中,其他条件相同的情况下分别调节pH为5.0、6.0、7.0、8.0、9.0,培养24 h,测定酶活性。
4)接种体积分数对菌株(Y20)产乳糖氧化酶能力的影响:将菌株以1%、2%、3%、4%、5%的不同接种体积分数接种于产乳糖氧化酶发酵培养基,在其他条件相同的情况下,测定其酶活性。
1.2.3 分析方法
1)乳糖氧化酶活性的测定:乳糖氧化酶可以氧化乳糖为乳糖酸,乳糖酸在酸性条件下可分解为葡萄糖酸和半乳糖,葡萄糖酸在酸性条件下发生内酯化,形成的内酯与羟胺碱反应,生成异羟肟酸。异羟肟酸与FeCl3能生成有色络合物,从而可通过分光光度法定量分析葡萄糖酸的含量[13]。乳糖氧化酶活性由D-葡萄糖酸的量来检验,一个酶活单位定义为:每分钟细胞产生1 μmol葡萄糖酸的量。
含0.4 mol/L的乳糖、0.2 mol/L磷酸氢二钠、0.1 mol/L、pH 6.0的柠檬酸缓冲液0.5 mL及细胞悬液0.5 mL的混合液1.0 mL,在40℃下反应10 min后,加入50 μL、1 mol/L NaOH以终止反应。向混合物中加入50 μL、1mol/L HCl,中和NaOH。反应混合物加0.5mL、2 mol/L HCl,煮沸40 min,以水解乳糖酸为D-葡萄糖酸和D-半乳糖。在10 mL具塞试管中加入0.5 mL待测样,再加入0.5 mL去离子水,混合均匀后,沸水浴中加热20 min,冷却至室温。然后顺序加入2 mL盐酸羟胺和NaOH混合试剂、1 mL、4 mol/L HCl和1 mL FeCl3试剂,混合均匀,这时反应混合物的pH为1.2±0.2。放置10 min后比色(波长505 nm),以空白管(用0.5 mL去离子水替代样品溶液,其余试剂用量与前相同)校零,读取各管的吸光度OD505值,测定工作在10 min内完成[14]。
2)蛋白质质量浓度测定:采用紫外分光光度法,以牛血清蛋白标准品做蛋白质标准曲线,见图1。将牛血清蛋白配置成质量浓度为0、0.25、0.5、0.75、1.00、1.25 mg/mL的溶液,在280 nm处测定吸光度值。以牛血清蛋白的质量浓度c为横坐标,280 nm处的吸光度值做标准曲线。A=0.909 9c+0.005 2。相关系数:R=0.999 2。其中,A为牛血清蛋白在280 nm处的吸光度值;c为牛血清蛋白的质量浓度。

图1 牛血清蛋白标准曲线Fig.1 Bovine serum protein standard curve
2 结果与分析
2.1 发酵条件对菌株(Y20)产乳糖氧化酶能力的影响
2.1.1 发酵时间对菌株(Y20)产乳糖氧化酶能力的影响 改变发酵培养条件中的发酵时间,其他条件不变,考察发酵时间对菌株产乳糖氧化酶能力的影响,结果见图2。在发酵12~24 h时,随着时间的推移,酶活逐渐增长;在发酵24~60 h时,随着时间的推移,酶活性缓慢降低;在发酵24 h时达到峰值,乳糖氧化酶活性为70.24 U/g。
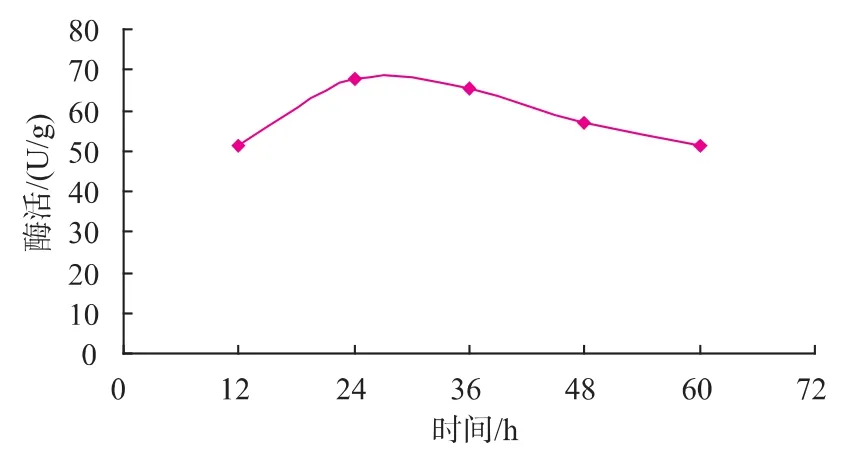
图2 发酵时间对产乳糖氧化酶能力的影响Fig.2 Effect of fermentation time on lactose oxidase
2.1.2 发酵温度对菌株(Y20)产乳糖氧化酶能力的影响 改变发酵培养条件中的发酵温度,其他条件不变,考察发酵温度对菌株产乳糖氧化酶能力的影响,结果见图3。发酵温度在24~28℃时,随着温度的提高,酶活逐渐升高;发酵温度在28~32℃时,随着温度的提高,酶活逐渐降低;在发酵温度28℃时达到峰值,酶活为73.19 U/g。
2.1.3 起始pH值对菌株(Y20)产乳糖氧化酶能力的影响 酸碱度对微生物的生长代谢有着重要影响,不同的微生物对酸碱有不同的适应性。确定了发酵液初始pH之后,在整个发酵过程中不再人为改变发酵液pH值的情况下,考察发酵过程中发酵液pH的变化对菌株(Y20)产乳糖氧化酶能力的影响。

图3 发酵温度对产乳糖氧化酶能力的影响Fig.3 Impact of fermentation temperature on lactose oxidase
不同的初始pH值不仅可以影响营养物质的可给性,同时也会影响代谢过程中酶的催化活性,进而影响到乳糖氧化酶活性。作者以2%的接种体积分数接种至不同pH值的发酵培养基中,发酵24 h,测定乳糖氧化酶活性。由图4可知,在发酵液初始pH值为7.0时,乳糖氧化酶活性最高,因此确定该菌株的发酵初始pH值为7.0。

图4 起始pH对产乳糖氧化酶能力的影响Fig.4 Effect of beginning of pH valve on lactose oxidase
2.1.4 接种体积分数对菌株(Y20)产乳糖氧化酶能力的影响 接种体积分数的大小直接影响乳糖氧化酶活性,合适的接种体积分数不仅可以提高产物的合成速率,也有利于减少染菌机会。改变发酵培养条件中的接种体积分数,其他条件不变,考察接种体积分数对菌株产乳糖氧化酶能力的影响,结果见图5。接种体积分数为2%时,发酵液中乳糖氧化酶活性最高;随着接种体积分数的增加,乳糖氧化酶活性开始下降,这主要是由于过高的接种体积分数使得菌体细胞的数量增殖过快,营养消耗过多,进而影响到代谢产物的生成量。
2.2 响应面法优化土生拉乌尔菌(Y20)产乳糖氧化酶的发酵条件
2.2.1 响应面设计及结果 为优化土生拉乌尔菌(Y20)产乳糖氧化酶发酵条件,采用经典的四因素三水平Box-Behnken试验设计[15],在单因素试验基础上,对发酵时间(A)、发酵温度(B)、初始pH(C)、接种量(D)进行优化,具体方案及结果见表1-2。

图5 接种体积分数对产乳糖氧化酶能力的影响Fig.5 Impact of amount of inoculation on lactose oxidase
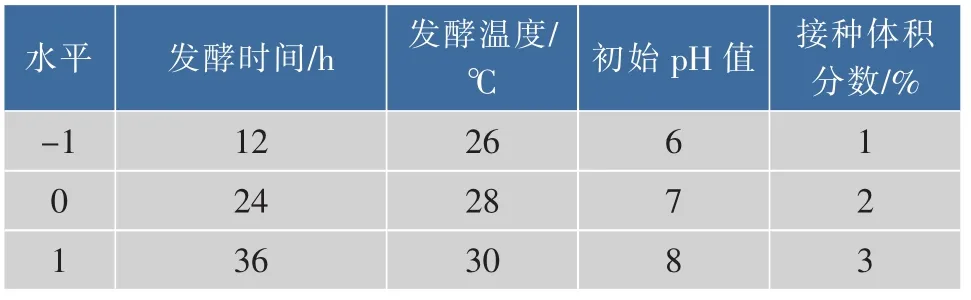
表1 响应面试验因素水平表Table 1 Factors and levels in response surface design
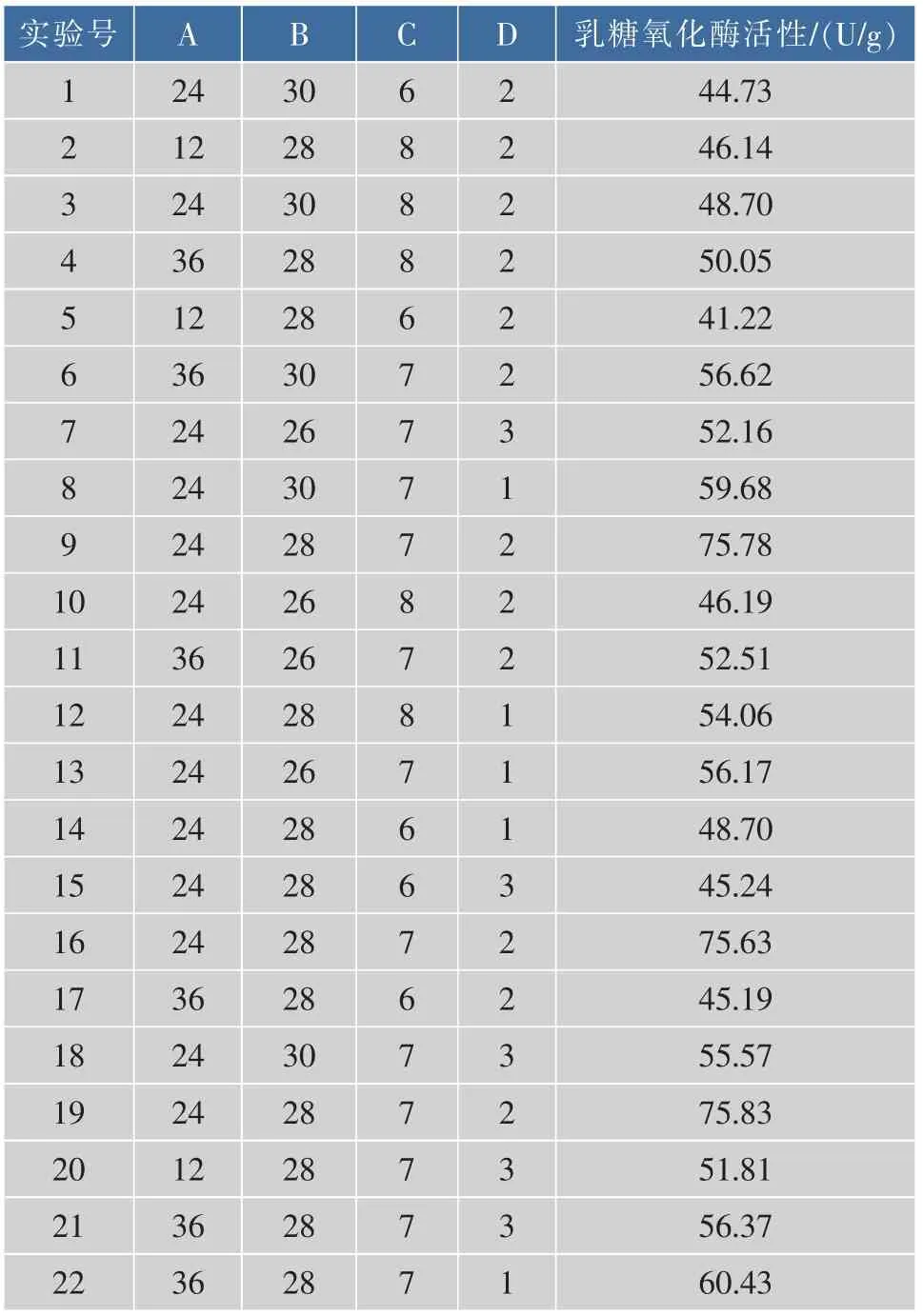
表2 Box-Behnken Design实验设计与实验响应结果Table 2 Box-Behnken design and response result values
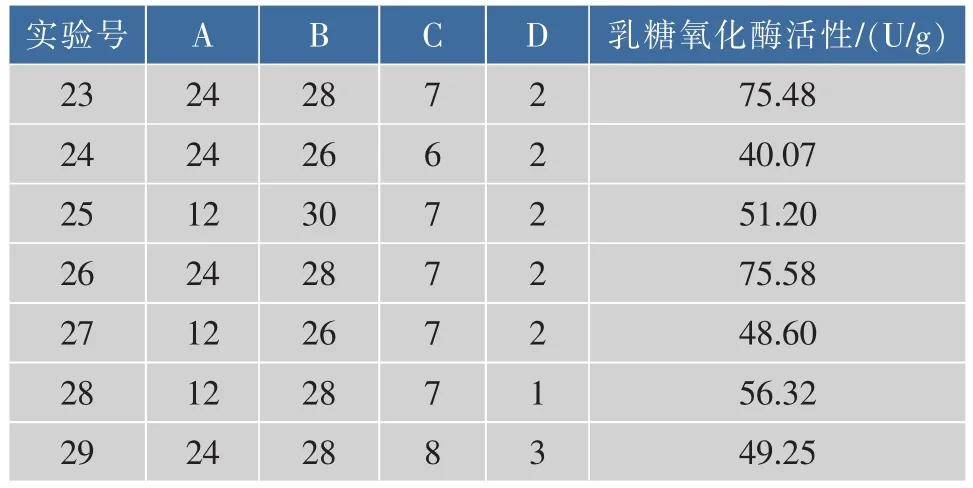
续表2
2.2.2 模型评价 利用Design-Exper7.0软件对表2试验数据进行二次多项式逐步回归拟合,得到的数学模型为:
Y=75.66+2.16A+1.73B+2.44C-2.08D+0.38AB-0.01AC+0.11AD-0.54BC-0.03BD-0.34CD-11.48A2-12.01B2-18.59C2-7.82D2
模型方差分析结果和各项系数显著性检验结果列于表3。
从表3可以看出,土生拉乌尔菌产乳糖氧化酶活性影响的大小顺序为:初始pH>发酵时间>接种体积分数>发酵温度。
模型中的F=4 931.83,P<0.05,说明本实验采取的二次模型是极显著的。PA、PB、PC、PAB、PBC、PCD、PA2、PB2、PC2、PD2均小于0.05,说明取发酵时间、发酵温度、初始pH及其4个因素的二次项都具有显著的影响。决定因素R2=0.999 8,也说明模型能够很好地反应响应值的变化,拟合度好。
根据回归方程,用Design-Expert7.0软件做出响应面,考察拟合响应曲面的形状。通过Design-Expert7.0软件优化功能再次优化,结果见图6—11。分别显示了发酵时间与发酵温度、发酵时间与初始pH、发酵时间与接种体积分数、发酵温度与初始pH、发酵温度与接种体积分数、初始pH与接种体积分数之间的相互作用对乳糖氧化酶活性的影响。
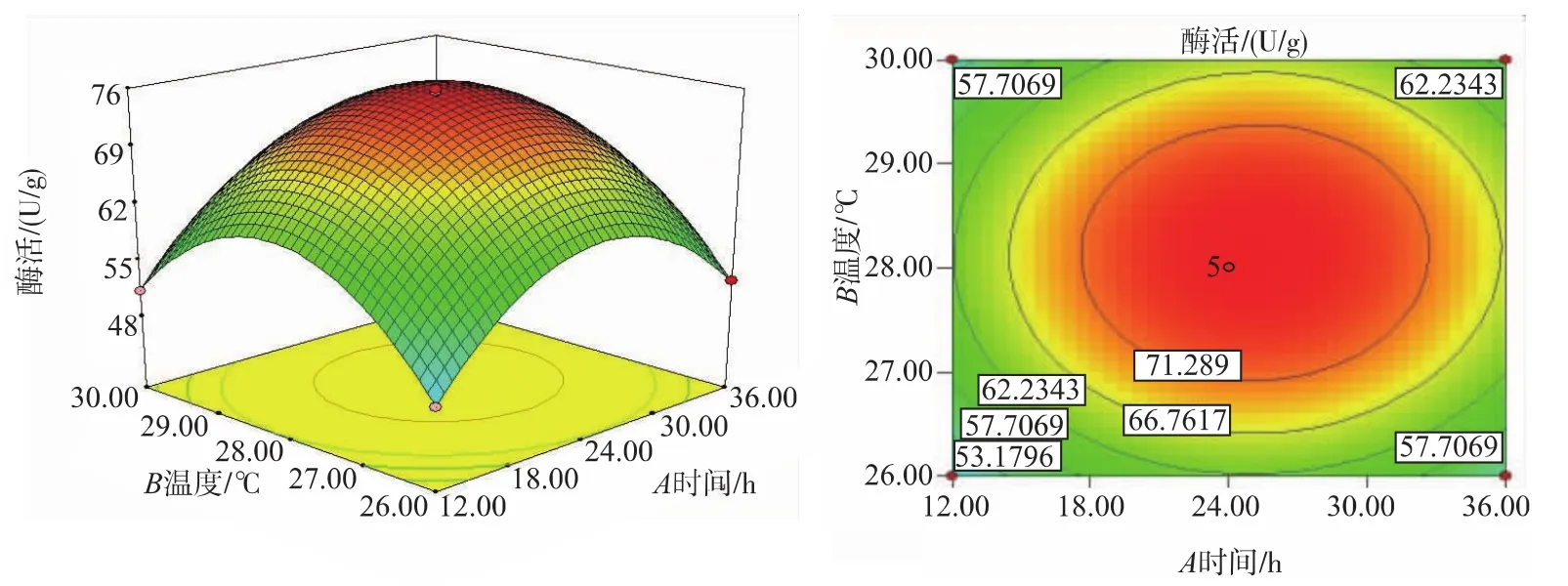
图6 Y=f(A,B)的响应面和等高线图Fig.6 Respond figic and contour plot for Y=f(A,B)
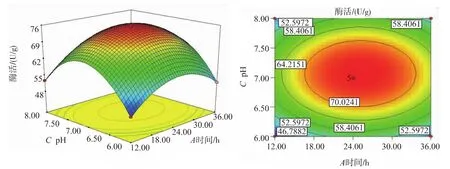
图7 Y=f(A,C)的响应面和等高线图Fig.7 Respond figic and contour plot for Y=f(A,C)
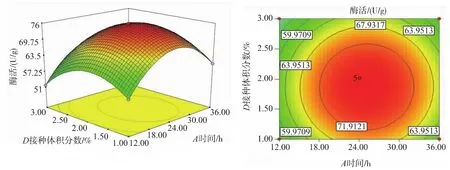
图8 Y=f(A,D)的响应面和等高线图Fig.8 Respond figic and contour plot for Y=f(A,D)

图9 Y=f(B,C)的响应面和等高线图Fig.9 Respond figic and contour plot for Y=f(B,C)

图10 Y=f(B,D)的响应面和等高线图Fig.10 Respond figic and contour plot for Y=f(B,D)

图11 Y=f(C,D)的响应面和等高线图Fig.11 Respond figic and contour plot for Y=f(C,D)
由图6—11可以直观地看出各因素对响应值的影响及其变化趋势,可以找出最佳参数。在所选的范围内存在极值,而且回归模型确实存在最大值。乳糖氧化酶活性随着考察因素的逐渐增大而升高;当继续增加超过实验取得的各因素的中心值时,乳糖氧化酶活性随着考察因素的增加而降低。图6说明,发酵时间与发酵温度、发酵温度与初始pH、初始pH与接种体积分数之间有显著影响;发酵时间与初始pH、发酵时间与接种体积分数、发酵温度与接种体积分数之间影响不够显著,正如方差结果所示。
通过最优化分析,最佳的发酵时间为24.93 h,最佳发酵温度为28.13℃,最适初始pH为7.16,最佳接种体积分数1.88%,预测乳糖氧化酶活性为78.36 U/g。但考虑实际操作的局限性,设定发酵时间为25 h,发酵温度28℃,初始pH为7.2,接种体积分数为2%。
2.2.3 验证响应面优化土生拉乌尔菌(Y20)产乳糖氧化酶最佳发酵条件 在最优发酵条件下进行乳糖氧化酶发酵验证实验,实际酶活为78.36 U/g,与预测的酶活78.85 U/g接近。
3 结语
酶法生产乳糖酸始于1998年,乳糖在纤维二糖酶、葡萄糖氧化酶、葡萄糖果糖氧化还原酶等酶的催化下,通过二步法转化为乳糖酸。此法由于所用酶的底物专一性、稳定性等原因,始终难以和化学合成法及电转化法相抗衡。乳糖氧化酶和乳糖脱氢酶是最近几年来发现的两种能够直接将乳糖转化为乳糖酸的氧化还原酶类。虽然这两种酶均具有底物专一性强,转化率高的特点,但是由于乳糖脱氢酶是一种膜结合蛋白,分离纯化过程极其复杂,且该酶容易失活,因而使其在酶法生产乳糖酸中失去竞争优势。乳糖氧化酶最初是在真菌中发现的一种以FAD为辅助因子的,能够将乳糖直接氧化成乳糖酸的一种氧化还原酶。该酶对乳糖具有较高的亲和性,且稳定性较高。关于产酶的微生物菌种及产酶条件的研究鲜少见报道。
作者考察了发酵时间、发酵温度、初始pH、接种体积分数四个因素对土生拉乌尔菌(Y20)产乳糖氧化酶的影响程度。模型拟合度较好,可对土生拉乌尔菌(Y20)产乳糖氧化酶的影响因素起动态分析和最优结果预测的作用。通过Design-Expert7.0软件优化功能确证了本次实验考察因素的最优工艺参数,即最佳的发酵条件为:发酵时间25 h,发酵温度28℃,初始pH 7.2,接种体积分数2%,为土生拉乌尔菌(Y20)产乳糖氧化酶氧化乳糖提供一定的条件。
[1]DHARIWAL A,MAVROV V,SCHROEDE I.Production of lactobionic acid with process integrated electrochemical enzyme regeneration and optimization of process variables using response surface methods(RSM)[J].Journal of Molecular Catalysis B:Enzymatic,2006,42(1/2):64-69.
[2]Charloux C,Paul M,Loisance D,et al.,Inhibition of hydroxyl radical production by lactobionate,adenine,and tempol[J].Free Radical Bio Med,1995,19:699-704.
[3]Gerling K G,Wilke D.Washing or detergent composition containing lactobionic acid or lactobionic acid salts[P].US Patent 5069808,1991-12-03.
[4]KUUSISTOA J,TOKAREVA A V,MURZINA E V.From renewable raw materials to high value-added fine chemicals:catalytic hydrogenation and oxidation of D-lactose[J].Catalysis Today,2007,121(1/2):92-99.
[5]Feng Xu,Elizbeth J Golightly,Claus C Fuglsang,et al.A novel carbohydrate:acceptor oxidoreductase from Microdochium nivale [J].Eur J Biochem,2001,268(4):1136-1142.
[6]Ahmad S K,Brinch D S,Friis E P,et al.Toxicological studies on lactose oxidase from Microduchium nivale expressed in Fusdrium venenatum[J].Regulatory Toxicology and Pharmacology,2004,39(3):256-270.
[7]Lin S F,Hu H M,Inukai T.Production of novel oligosaccharide oxidase by wheat bran solid-state fermentation[J].Biotechnol Adv,1993,11(3):417-427.
[8]白会钗,缪铭,江波,等.乳糖酸的研究进展[J].食品工业科技,2012(2):430-436. BAI Huichai,MIAO Ming,JIANG Bo,et al.Review on research progress of lactobionic acid[J].Science and Technology of Food Industry,2012(2):430-436.(in Chinese)
[9]Zhou X,Zheng Y,Ye H M,et al.Fermentation medium optimization of thermophilic proteinase by response surface methodology [J].Journal of Biomathematics,2007,22(1):113-118.
[10]Kalil S J,Maugeri F,Rodrigues M I.Response surface analysis and simulation as a tool for bioprocess design and optimization[J]. Process Biochemistry,2000,35(6):539-550.
[11]Ramkrishna S,Swaminatathan T.Response surface modeling and optimization to elucidate and analyze the effects of inoculum sage and size on surfactin production[J].Biochemical Engineering Journal,2004,21(2):141-148.
[12]郑艳,李超.乳糖酸生产菌株的筛选与鉴定[J].食品工业科技,2012,34(4):189-192. ZHENG Yan,LI Chao.Screening and identifying lactobionic acid producing bacteria strain[J].Science and Technology of Food Industry,2012,34(4):189-192.(in Chinese)
Optimum Fermentation Condition of Production Lactose Oxidase by Raoultella terrigena Y20
NING Chong, ZHENG Yan*, ZHAO Sujie, SUN Yuqiang
(College of Food Science,Shenyang Agricultural University,Shenyang 110866,China)
The effects of fermentation conditions on lactose oxidase activity producing by Raoultella terrigena Y20,which was screened by our lab,were studied by single factor experiment and response surface methodology.The results showed that the four independent variables as initial pH value,fermentation time,inoculation amount and fermention temperature had significant and sequence effects on the lactose oxidase activity.The optimal fermention conditions were as follows,inoculum amount of 2%,initial pH at 7.2,fermented 25 h,temperature at 28℃.Under the optimal conditions,the lactose oxidase activity was 74.96 U/g,which was almost consistent with predicted value of 78.87 U/g.
Raoultella terrigena Y20,lactose oxidase,response surface methodology,optimum
TQ920.6
A
1673—1689(2015)08—0879—07
2014-04-23
辽宁自然科学基金项目(201202190)。
*通信作者:郑 艳(1973—),女,辽宁丹东人,农学博士,副教授,主要从事食品生物技术、发酵工程和酶工程方面的研究。E-mail:zhengyan0403@163.com
