ERK 1/2和p-ERK 1/2在胆管癌组织中的表达及临床意义
2015-01-06林永利赵海鹰刘金钢杨福全
林永利 赵海鹰 刘金钢 杨福全 田 忠
中国医科大学附属盛京医院普通外科,辽宁沈阳110004
ERK 1/2和p-ERK 1/2在胆管癌组织中的表达及临床意义
林永利 赵海鹰 刘金钢 杨福全 田 忠
中国医科大学附属盛京医院普通外科,辽宁沈阳110004
目的检测细胞外信号调节激酶1/2(ERK1/2)和其磷酸化状态(p-ERK1/2)在胆管癌组织中的蛋白表达及临床意义。方法收集肝外胆管癌组织标本74例,正常胆囊结石胆囊管组织标本25例,应用SP免疫组化法检测ERK1/2和p-ERK1/2蛋白的表达情况;采用卡方检验分析ERK1/2和p-ERK1/2表达水平与临床指标关系;应用Kaplan-Meier法绘制生存曲线,单因素分析采用Kaplan-Meier模型,多因素分析采用COX比例风险模型。结果胆管癌组织中ERK1/2和p-ERK1/2蛋白表达阳性率分别为32.4%(24/74)和60.8%(45/74),均明显高于正常肝外胆管组织[16.0%(4/25)、24.0%(6/25)],差异均有统计学意义(P<0.05)。p-ERK1/2蛋白表达与淋巴结转移和肿瘤分化程度密切相关(P<0.05);p-ERK1/2阴性表达的肝外胆管癌患者总体生存期明显长于p-ERK1/2表达阳性的患者(P=0.034)。单因素分析发现,p-ERK1/2的表达、淋巴结有无转移、临床分期和肿瘤的分化程度均与患者预后相关(P<0.05),多因素分析证实p-ERK1/2的表达是影响预后的独立风险因素(P<0.05)。结论胆管癌组织存在ERK1/2和p-ERK1/2高表达;p-ERK1/2的表达与临床分期可作为胆管癌的预后因子。
ERK1/2;p-ERK1/2;胆管癌;病理;免疫组织化学
胆管癌是一类严重威胁人类健康的消化道恶性肿瘤,占全部胃肠道肿瘤的3%,我国的发病率以每年递增5%的速度上升,是消化道肿瘤中上升速度最快的肿瘤,近年来其发病率和病死率在全球范围内有快速上升的趋势,临床中胆管癌的重要性在逐步提升[1-2]。手术治疗虽是目前最为有效的治疗手段,但术后1、2、3年生存率分别为42.6%、30.0%、22.5%,中位生存时间为10个月[3],研究胆管癌发生机制可以提高临床医生对胆管癌的认识,帮助改进诊断治疗的方法、寻找有效的预防措施,从而进一步改善胆管癌的预后。细胞外信号调节激酶1/2(extracellular regulated kinase 1/2,ERK1/2)和p-ERK1/2作为丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族的主要成员[4],是近几年的研究热点,但其在胆管癌中的研究国内少有报道,因此探讨胆管癌中ERK1/2、p-ERK1/2的表达及临床意义具有重要的应用前景。
1 材料与方法
1.1 材料
收集2005年1月~2009年10月中国医科大学盛京医院病理科经病理明确诊断的肝外胆管癌手术切除组织标本74例,其中男45例,女29例,年龄29~79岁,平均50.9岁,其中有淋巴结转移者44例,无淋巴结转移者30例。临床分期按1997年国际抗癌联盟(UICC)TNM分期,所有患者术前均末接受化疗、放疗及其他抗肿瘤治疗。另取25例胆囊结石胆囊切除术后的胆囊管残端作为对照,经病理检测确认为正常组织,其中男15例,女10例,年龄18~68岁,平均53.2岁。肝外胆管癌与对照患者在性别、年龄等方面差异无统计学意义(P>0.05),具有可比性。
1.2 免疫组化染色方法
采用免疫组化SP法检测74例标本中ERK1/2和p-ERK1/2在肝外胆管癌组织中的表达。鼠抗人ERK1/2和p-ERK1/2单克隆抗体购自NeoMarker公司,兔抗人表皮生长因子受体-2(HER-2)多克隆抗体购自武汉博士德公司;SP试剂盒、DAB显色剂均购自北京中杉金桥公司。采用链霉菌抗生物素蛋白-过氧化酶免疫组化法(Streptavidin-Peroxidase,SP),将标本制成4μm的连续切片,60℃烤片2 h。经常规二甲苯脱蜡,梯度酒精脱苯,水化后,进行S-P免疫组织化学染色,ERK1/2和p-ERK1/2的一抗稀释度1∶100,二抗的稀释度1∶200。采用PBS液代替一抗作为阴性对照,北京中杉金桥公司提供的阳性片作为阳性对照。
1.3 结果判定标准
染色结果由两位有经验且对患者病情不了解的病理科医生观察,镜下细胞质内出现棕黄色或黄色颗粒的为ERK1/2阳性表达;镜下细胞质或细胞核出现棕黄色或黄色颗粒的为p-ERK1/2阳性表达。随机高倍镜下选择5个视野(400×),每个视野计数200个细胞,共1000个,计算每张切片阳性细胞百分率。ERK1/2阳性分级标准:先按阳性细胞所占百分比打分,无阳性细胞数为0分,阳性细胞数<10%为1分,10%~50%为2分,>50%为3分;再按镜下细胞着色强度:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比与细胞着色强度的乘积: 0~3分阴性(-),4~6分弱阳性(+),7~9分强阳性(++),参考Cooper[5]等的报道。p-ERK1/2阳性分级标准:先按阳性细胞所占百分比打分,无阳性细胞数为0分,阳性细胞数<1%为1分,1%~<10%为2分,10%~50%为3分,>50%为4分;再按细胞的着色强度打分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分,参考Zhong等[6]的报道:阳性细胞百分比与细胞的着色强度乘积:0~3分阴性(-),4~6分弱阳性(+),7~9分中度阳性(++),10~12分强阳性(+++)。
1.4 随访
随访截至2010年9月1日,生存时间定义为术后到患者死亡的时间。对中途失访的患者,终止时间以最后一次的访问时间为准。电话随访跟踪,失访16例(21.62%),死亡50例(67.57%)。
1.5 统计学方法
用SPSS 13.0统计软件包处理数据,计量资料数据用均数±标准差()表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验;应用Kaplan-Meier法绘制生存曲线,单因素分析采用Kaplan-Meier模型,多因素分析采用COX比例风险模型。以P<0.05为差异有统计学意义。
2 结果
2.1 在胆管癌组织中ERK1/2和p-ERK1/2的表达情况
实验组中,ERK1/2和p-ERK1/2阳性表达率分别为32.4%(24/74)和60.8%(45/74)(图1,封三);对照组中,ERK1/2和p-ERK1/2阳性表达率分别为16.0%(4/25)和24.0%(6/25);与对照组比较,实验组ERK1/2和p-ERK1/2阳性表达率均显著增高(均P<0.05)。
2.2 ERK1/2和p-ERK1/2表达与胆管癌临床病理参数相关性
ERK1/2的表达与肝外胆管癌患者肿瘤大小、分化程度、淋巴结转移、临床分期、年龄、性别比较均未见相关性。p-ERK1/2表达与肿瘤分化程度和淋巴结转移密切相关:淋巴结转移的病例,p-ERK1/2阳性率明显高于未发生淋巴结转移的病例(χ2=5.323,P= 0.021);肿瘤分化程度低的患者,p-ERK1/2阳性表达率明显高于分化程度高的患者(χ2=8.435,P=0.015)。不同肿瘤大小、年龄、性别患者中,p-ERK1/2蛋白阳性表达率比较,差异无统计学意义(P>0.05)。见表1。
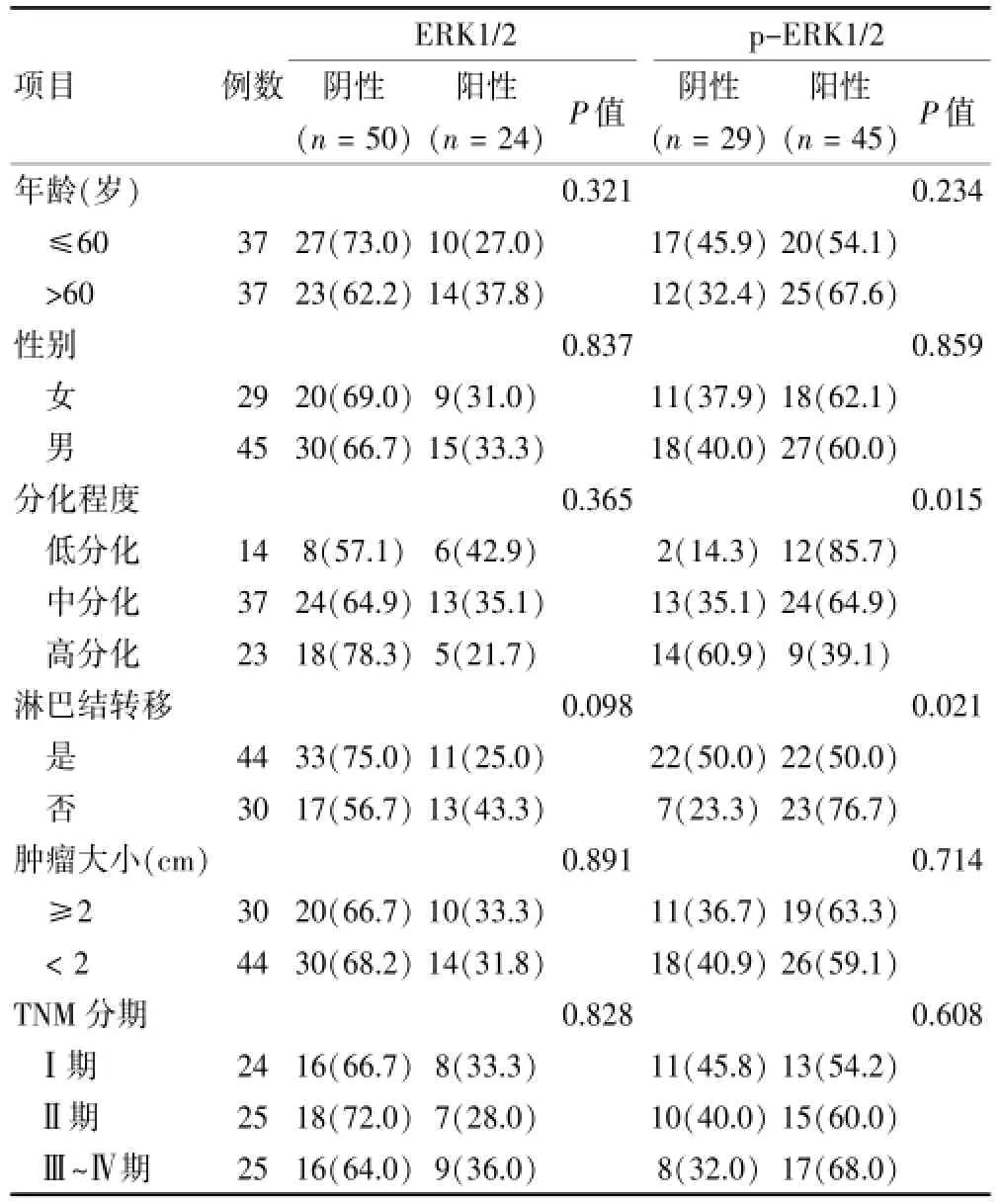
表1 胆管癌患者临床病理参数与ERK1/2和p-ERK1/2蛋白表达的关系[n(%)]
2.3 ERK1/2和p-ERK1/2表达与患者预后的相关性
ERK1/2和p-ERK1/2表达与肝外胆管癌患者的总体生存期的关系研究结果:ERK1/2表达水平与肝外胆管癌患者的总体生存期无明显相关性(P>0.05),见图2。p-ERK1/2阳性表达的患者总体生存期明显短于p-ERK1/2阴性表达者(P=0.034),见图3。

图2 ERK表达水平与胆管癌患者临床预后相关性分析

图3 p-ERK1/2表达水平与胆管癌患者临床预后相关性分析
2.4 总体生存期风险因素分析
进行单变量COX回归法分析,发现肿瘤分化程度、淋巴结转移、TNM分期、p-ERK1/2与患者的OS均显著相关。进一步进行多变量COX回归分析,引入分化程度、TNM分期、淋巴结转移、p-ERK1/2等因素,结果发现TNM分期和p-ERK1/2表达为影响预后的独立风险因素。见表2、3。

表2 总体生存期的单因素分析(个月)

表3 总体生存期的多因素分析
3 讨论
ERK属于丝氨酸/苏氨酸残基的蛋白激酶,是MAPK家族的重要成员,可以将多种细胞外信号,如肿瘤启动因子、细胞因子、生长因子等,经过磷酸化活化逐级传递至细胞核,并激活多种核转录因子,参与细胞生长、发育、分裂及分化等[7-8],是多种生长因子如表皮生长因子(EGF)[9]、神经生长因子(NGF)[10]、血小板源性生长因子(PDGF)[11]等的下游蛋白,在肿瘤侵袭和转移过程中ERK及其信号途径起中介和放大信号作用:接受来自丝裂原、生长因子、环境刺激等的信号;通过ERK信号级联反应作用于核转录因子如AP21、NF2κB等,调控基因表达[12-13]。
ERK的过度激活在许多癌症,如口腔癌[14]、黑色素瘤[15]、乳腺癌[16]等中均可发现。现有研究显示,ERK1/2信号转导通路通过调控线粒体凋亡途径减弱了TRAIL诱导的宫颈癌细胞株HeLa的凋亡[17]。ERK1/2途径的激活参与XCL12/CXCR4和肝细胞生长因子诱导的胆管癌细胞侵袭和转移[18-19]。而目前在肝外胆管癌组织中关于ERK1/2的表达研究较少。
ERK1/2磷酸化后即p-ERK1/2,p-ERK1/2是ERK1/2的活化形式,磷酸化后的ERK1/2(p-ERK1/2)作用于细胞核内的c-jun、NF-κB、c-fos等转录因子,磷酸化核转录因子和其他蛋白激酶等多种底物,调节相关基因的转录,进而参与细胞生长、发育等,并在细胞恶性转化等病理过程中起重要作用[20-21]。目前国内关于p-ERK1/2在肝外胆管癌组织中的表达研究报道较少。基于此,本文研究肝外胆管癌组织中ERK1/2和p-ERK1/2的表达及其与临床病理参数及预后的关系,具有重要的临床意义和社会价值,可能为胆管癌的治疗提供一个新的肿瘤的治疗的靶点。
本研究结果:ERK1/2、p-ERK1/2在胆管癌组织、正常胆管组织中均有表达,但胆管癌组织中ERK1/2、p-ERK1/2的表达率明显高于对照组(正常胆管组织),提示胆管癌的发生可能与ERK1/2、p-ERK1/2的过表达密切相关。在分化程度低、淋巴结发生转移的患者中p-ERK1/2表达明显增高,提示p-ERK1/2与肿瘤的分化程度、淋巴结转移密切相关。胆管癌组织中p-ERK1/2表达越高,其总体生存期越短。综合研究提示,p-ERK1/2表达可能作为胆管癌判断预后的独立风险因子。而研究发现ERK1/2的表达与患者临床病理参数、预后无统计学差别,提示ERK1/2的表达可能不是胆管癌的一个预后因子。
总之,从本研究结果可以得出这样的结论:胆管癌组织存在ERK1/2和p-ERK1/2高表达;p-ERK1/2表达与临床分期可作为胆管癌的预后因子。
[1]Gatto M,Alvaro D.Cholangiocarcinoma:risk factors and clinical presentation[J].Eur Rev Med Pharmacol Sci,2010,14(4):363-367.
[2]Gatto M,Bragazzi MC,Semeraro R,et al.Cholangiocarcinoma:update and future perspectives[J].Dig Liver Dis,2010,42(4):253-260.
[3]Wang H,Wang J,Wang HL.Multivariate analysis of survival rates in patients with hilar cholangiocarinoma[J].J Surg Concepts Pract,2014,19(5):80-89.
[4]Lu MQ,Kong QZ.Silk crack the original activated protein kinase signaling pathways in the research status of malignant tumors[J].The Practical Journal of Cancer,2013,28 (3):21-30.
[5]Cooper R,Sarioglu S,Sokmen S,et al.Glucose transporter-1(Glut-1):a potentialmarker of prognosis in rectal carcinoma[J].Br JCancer,2003,89(5):870-876.
[6]Zhong H,DeMatzo AM,Laugher E,et al.Overexpression of hypoxia-inducible factor la in common human cancers and theirmetastases[J].Cancer Res,1999,59(22):5830-5835.
[7]Keshet Y,Seger R.The MAP kinase signaling cascades:a system of hundreds of components regulates a diverse array of physiological functions[J].MethodsMol Biol,2010,661:3-38.
[8]Séverin S,Ghevaert C,Mazharian A.Themitogen-activated protein kinase signaling pathways:role in megakaryocyte differentiation[J].JThromb Haemost,2010,8(1): 17-26.
[9]Ren HB.Introduction to the application of the epidermal growth factor[J].Basic Medicineand Clinical,1991,11:7-9.
[10]Yang XQ.EGFR family and NGF plays/TrkA expression characteristics and the interaction in the bile duct carcinoma[D].Shandong:Shandong University,2014.
[11]Li Y,Qian YL.Its role in the development of PDGF in gynecological tumors[J].Journal of Yanan University (Medical Science),2014,12(3):57-58.
[12]Papageorgiou E,Pitulis N,Msaouel P,et al.Enomic crosstalk between PPAR-gamma ligands and ERK1/2 incancer cell lines[J].Expert Opin Ther Targets,2007,11 (8):1071-1085.
[13]Roberts PJ,Der CJ.Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer[J].Oncogene,2007,26(22):3291-3310.
[14]Choi KH,Kim HK,Kim JH,et al.The p38 MAPK pathway is critical for 5,5'-dibromodiindolylmethane-in-duced apoptosis to prevent oral squamous carcinoma cells[J].Eur J Cancer Prev,2010,19(2):153-159.
[15]Hersey P,Zhuang L,Zhang XD.Current strategies in overcoming resistance of cancer cells to apoptosis melanoma as a model[J].Int Rev Cytol,2006,251:131-158.
[16]Whyte J,Bergin O,Bianchi A,et al.Key signalling nodes in mammary gland development and cancer.Mitogenactivated protein kinase signalling in experimental models of breast cancer progression and in mammary gland development[J].Breast Cancer Res,2009,11(5):209.
[17]Lee do Y,Lee MW,Lee HJ,et al.ERK1/2 activation attenuates TRAIL-induced apoptosis through the regulation of mitochondria-dependent pathway[J].Toxicol In Vitro,2006,20(6):816-823.
[18]Menakongka A,Suthiphongchai T.Involvement of PI3K and ERK1/2 pathways in hepatocyte growth factor-induced cholangiocarcinoma cell invasion[J].World J Gastroenterol,2010,16(6):713-722.
[19]Leelawat K,Leelawat S,Narong S,et al.Roles of the MEK1/2 and AKT pathways in CXCL12/CXCR4 induced cholangiocarcinoma cell invasion[J].World J Gastroenterol,2007,13(10):1561-1568.
[20]Racaniello M,Cardinale A,Mollinari C,et al.Phosphorylation changes of CaMKII,ERK1/2,PKB/Akt kinases and CREB activation during early long-term potentiation at Schaffer collateral-CA1 mouse hippocampal synapses[J]. Neurochem Res,2010,35(2):239-246.
[21]Buzzi N,Colicheo A,Boland R,et al.MAP kinases in proliferating human colon cancer Caco-2 cells[J].Mol Cell Biochem,2009,328(1-2):201-208.
Expression and clinical significance of ERK1/2 and p-ERK1/2 in cholangiocarcinoma
LIN Yongli ZHAO Haiying LIU Jingang YANG Fuquan TIAN Zhong
Department of General Surgery,Shengjing Hospital of China Medical University,Liaoning Province,Shenyang 110004,China
Objective To study the expression of ERK1/2 and p-ERK1/2 in cholangiocarcinoma and its clinical significance.MethodsERK1/2 and p-ERK1/2 protein expression were detected in 74 cases of cholangiocarcinoma and 25 cases of normal bile ducts tissues using immunohistochemistry(SP method).The correlations of expression of ERK1/2 and p-ERK1/2 with the clinical index were detected by chi-square test.Survival probabilities were estimated by the Kaplan-Meier method and assessed by a Log-rank test.The Kapla-Meier model was used to analyze single factor. Cox’s proportional hazard regression model was performed to evaluate the multi-factors.ResultsThe positive expression rate of ERK1/2 and p-ERK1/2 in the cholangiocarcinoma tissues were 32.4%(24/74),60.8%(45/74),which were significantly higher than those in normal bile ducts tissues[16.0%(4/25),24.0%(6/25)],the differences were statistically significant(P<0.05).The expression of p-ERK1/2 protein was associated with lymph node metastases state and differentiation level of tumor(P<0.05).The survival time in patients with p-ERK1/2 negative expression was longer than patients with positive expression(P=0.034).Single factor analysis showed that p-ERK1/2 expression,differentiated degree of tumor,lymphatic metastasis and clinical stages were connected with prognosis(P<0.05).Multi-factor analysis proved that p-ERK1/2 expression and clinical stages could be regarded as independent risk factors of cholangiocarcinoma prognosis(P<0.05).ConclusionThere are higher expression of ERK1/2 and p-ERK1/2 in cholangiocarcinoma.p-ERK1/2 and clinical stages may be served as a prognostic factor in cholangiocarcinoma.
ERK1/2;p-ERK1/2;Cholangiocarcinoma; Pathology;Immunohistochemistry
R735.8
A
1673-7210(2015)03(a)-0019-05
2014-11-18本文编辑:任念)
辽宁省自然科学基金项目(编号20102297);辽宁省科学技术计划项目(编号2009225036)。
林永利(1979-),男,辽宁辽阳人,中国医科大学2007级临床专业在读硕士研究生;研究方向:肝胆疾病。
赵海鹰(1973-),女,副教授,硕士生导师;研究方向:胆道疾病、乳腺、甲状腺等疾病的外科手术治疗以及腹腔镜微创手术治疗。
