PCR-DGGE技术检测羊羔美酒大曲中细菌多样性
2015-01-05董振玲牟德华
李 艳,董振玲,李 佳,牟德华,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018;3.河北一然生物科技有限公司,河北 石家庄 050800)
PCR-DGGE技术检测羊羔美酒大曲中细菌多样性
李 艳1,2,董振玲1,3,李 佳1,牟德华1,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018;3.河北一然生物科技有限公司,河北 石家庄 050800)
目的:使用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denatured gradient gelelectrophoresis,PCR-DGGE)技术检测羊羔美酒大曲中的细菌,探寻酒曲中细菌菌群的多样性组成,研究羊羔美酒的风味特征。方法:对羊羔美酒大曲进行样品处理、提取总DNA、PCR扩增、DGGE条带的切胶与测序分析。结果:利用PCR-DGGE技术检测到羊羔美酒大曲中包含魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、片球菌(Pediococcus)、芽孢乳杆菌(Sporolactobacillus)、葡萄球菌(Staphylococcus)、高温放线菌属(Thermoactinomyces)和4个不可培养的细菌种类。结论:羊羔美酒大曲中细菌菌群多样性丰富,其中乳酸菌菌群是最大的细菌群系。
羊羔美酒大曲;细菌;聚合酶链式反应-变性梯度凝胶电泳
羊羔美酒是一种北方特色黄酒,其酿造所使用的酒曲是大曲。通常大曲的制作是以小麦为原料,经破碎加水压制成砖块装的曲坯,自然接种微生物,在适宜的品温、湿度等条件下自然培育而成[1-3]。大曲是酿制大曲酒的生香剂、糖化剂与发酵剂,含有丰富的微生物与酶系,其质量的优劣对酒的品质和风味有极大的影响,故有“曲是酒之骨”之称[4-6]。独特的大曲微生物群系组成是影响酒类香气物质和种类繁多的风味物质的重要原因之一。羊羔美酒有着与众不同的风味与口感,与大曲中独特的微生物群系紧密相关。传统的微生物培养方式可以得到菌株的纯培养物,利于后续研究菌株的特性及其在酒类酿造中的作用,但是常规培养基与培养条件也会在微生物的分离研究中遗漏很多物种,况且大多数细菌很难培养或者不可培养。要想尽可能全面地了解羊羔美酒大曲中的细菌菌群的种类,应当寻求新的技术方法和手段。
聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denatured gradient gelelectrophoresis,PCRDGGE)技术的原理是根据碱基序列上存在差异的不同DNA在双链进行解链时需要的变性剂体积分数不同,一旦DNA双链解链,其在聚丙烯酰胺凝胶中的电泳速度将急剧下降。因此,将PCR扩增得到长度相同的DNA片段加样到含有变性剂梯度的聚丙烯酰胺凝胶中进行电泳,序列不同的DNA片段在其相应的变性剂体积分数条件下变性,发生解链行为,导致电泳速度的迅速下降,停留在与其相应的变性剂梯度位置,染色后即可在凝胶上呈现分散的条带。自1979年Fischer和Lerman提出后,该技术经改进与完善,已经成为一项成熟稳定的现代分子生物学技术并得到广泛应用[7-8]。
本研究以羊羔美酒酿造用酒曲为原料,以细菌菌群为研究对象,在非培养的方式下利用PCR-DGGE技术对酒曲中细菌直接进行分析检测,为进一步研究羊羔美酒的风味物质形成和优化传统发酵工艺提供参考依据。
1 材料与方法
1.1材料、试剂与引物
羊羔美酒大曲 河北味道府酒业有限责任公司。
配制溶液的各种试剂和生化试剂等均为分析纯,引物F341(5’-CCTACGGGAGGCAGCAG-3’)、R534(5’-ATTACCGCGGCTGCTGG-3’)、F341-GC(5’-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3’)上海生工生物工程技术服务有限公司。
1.2仪器与设备
PCR仪、凝胶成像分析仪、变性梯度凝胶电泳装置美国Bio-Rad公司;DYY-8C型稳压稳流电泳仪 北京六一公司。
1.3方法
1.3.1样品的处理
称取3 g均匀的酒曲样品,加27 mL磷酸盐缓冲液(phosphate buffered saline,PBS),200 r/min摇床30 min,旋涡振荡5 min,4层纱布过滤,滤液经200 r/min离心5 min,取上清液,将上清液8 000 r/min离心3 min,得到沉淀,加入5 mL PBS,旋涡振荡5 min,离心沉淀,重复洗涤2次[9-11]。将样品置于-20℃保存备用。
1.3.2 DNA提取方法的选择
羊羔美酒大曲中总基因组DNA的提取,共选择3种不同的方法:1)化学裂解法:取样品重悬于TE溶液,用TE溶液洗涤一次,除去上清液。加20 mg/mL的溶菌酶50μL,于37℃水浴60 min。向每管加入200μL裂解缓冲液,混合均匀。加入10μL蛋白酶K(10 mg/mL),55℃处理0.5 h,向每管加入66μL饱和的NaCl溶液,充分混合后,12 000 r/min离心10 min,然后除去蛋白质复合物及细胞壁等残渣。离心后取上层清液,加入等体积的Tris饱和酚,14 000 r/min离心5 min,取上清液用等体积的氯仿-异戊醇(24∶1,V/V)溶液抽提2次,取出上清液,用预冷的1倍体积的冰异丙醇沉淀DNA,15 000 r/min离心10 min,弃去上清液。用400μL70%的乙醇洗涤沉淀2次。真空干燥后,用50μLTE缓冲液(10 mmol Tris-HCl,1 mmol EDTA,pH 8.0)溶解DNA,-20℃保存备用;2)CTAB法[12];3)氯化苄法[13]。
DNA样品用0.8 g/100 mL琼脂糖凝胶电泳检测,Marker为λ-HindⅢ,电压90 V,电泳时间60 min,拍照观察。
1.3.3 PCR技术的选择
1.3.3.1普通PCR
普通PCR反应体系(在0.2 mL离心管内配制50 ☒L反应体系):10×buffer缓冲液5μL,dNTP 1μL,Taq酶(0.5 U/L)0.5μL,上、下游引物各1μL,模板DNA 2μL,补足水至50μL。
反应程序:95℃预变性7 min,94℃变性30 s,55℃退火1 min,72℃延伸30 s,35个循环,最后72℃延伸10 min。
1.3.3.2降落PCR
降落PCR:反应体系同普通PCR。
反应程序:95℃预变性7 min,94℃变性1 min,65℃退火1 min,每个循环降低0.5℃,经20个循环后,退火温度降低至55℃,72℃延伸1 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,10个循环,最后72℃延伸10 min[14-15]。
PCR产物的检测:吸取5μLPCR产物,通过1%琼脂糖凝胶电泳检测,80 V电压50 min,经过EB染色15 min后,利用凝胶成像系统成像。
1.3.4 DGGE最佳实验条件的研究
设置实验变性剂体积分数为45%~60%[16-17],进行后续实验的研究分析。实验设计PCR产物加样量为5、15、25、35、45μL,以寻求最佳PCR产物加样量。
根据上述实验确定的最佳PCR产物加样量进行实验,设计电泳时间为7、10、13、16 h,以寻求最佳电泳时间。
1.3.5条带切胶回收、纯化及测序
条带的切胶回收:将DGGE电泳完毕的凝胶,置于凝胶成像仪上,选取目标条带,使用无菌手术刀切割后放入灭过菌的1.5 mL离心管中,加入50μL的灭菌去离子水清洗2次,加入50μL的灭菌去离子水并于4℃静置过夜。
取过夜储存样品液1μL作为PCR反应模板,进行PCR反应,反应程序与引物同1.3.3节。
目的条带的纯化:将上述PCR产物进行2次变性梯度凝胶电泳,重复切胶回收步骤,以使得目的条带得到纯化。直至目的条带单一、无杂带干扰为止。
目的条带的测序:将纯化完成的样品进行2次PCR扩增,引物为F341(不带GC夹子)与R534,反应程序与体系同1.3.3节。PCR产物经琼脂糖电泳检测合格后委托上海生工生物工程技术服务有限公司进行序列测定。测序结果在NCBI数据库中进行BLAST比对,进行同源性分析。下载相关菌株序列信息,使用MEGA4软件中的邻接法构建系统树图,并以Bootstrap对进化树进行1 000次可信度分析。
2 结果与分析
2.1 DNA提取方法的选择
实验选择3种不同的DNA提取方法,得到的DNA经过0.8%琼脂糖凝胶电泳分析后,电泳图谱见图1,羊羔美酒大曲中细菌总基因组DNA在23 kb左右;3种方法均可以对酒曲中细菌总DNA进行有效提取,但是从DNA的得率与DNA完整性来说,氯化苄法优于化学裂解法和CTAB法。图谱中泳道前部有少量拖尾现象,可能是样品中存在少量DNA降解或者是存在少量的RNA。从实验结果可知,氯化苄方法提取的DNA完整性较好,可以满足后续实验的要求。
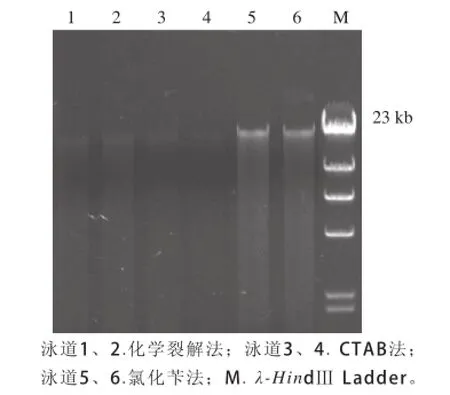
图1 DNA电泳图Fig.1 DNA electrophoretogram
2.2 PCR技术的选择
本实验采用普通PCR技术与降落PCR技术两种方法对酒曲中宏基因组DNA进行扩增,将扩增产物进行琼脂糖检测,结果见图2。

图2 不同PCR方法扩增产物的图谱Fig.2 Electrophoretogram of amplified products of the V3 region of 16S rDNA by different PCR techniques
由图2可以看出,普通PCR技术与降落PCR技术都可以对酒曲样品中总基因组DNA进行有效扩增,在200 bp处均有目的条带。但是,普通PCR扩增产物的条带有弥散现象,略有非特异性扩增现象,而降落PCR技术条带无这两种现象,且降落PCR技术本身可以减少非特异扩增,故本实验选择降落PCR技术进行后续的实验。
2.3 DGGE最佳实验条件的研究
从图3可以看出,PCR产物加样量5~35μL条带越来越清晰明了,电泳图谱效果也越来越好,但是35~45μL图谱的清晰度没什么差别,而背景色却越来越严重,综合考虑,PCR产物加样量确定为35μL,并以此进行后续实验。
从图4可以看出,电泳时间较短时,泳道前方的条带分离度很差,区分效果不好,而泳道后半部分的条带分离度与区分度较好;随着电泳时间的延长,泳道前方的条带分离效果逐渐越来越好,但是后方的条带却逐渐在区分度上越来越差。虽然有文献报道,由于在变性梯度电泳过程中PCR产物有了GC夹子,可以在遇到最佳变性剂体积分数时不完全解链,故此时不会继续随着电泳时间的延长而继续移动,但从上述实验结果可以看出,DNA序列解链后仍会继续随着电泳的进行而移动,只是移动速率会大大降低。综合考虑,电泳时间为13 h时,电泳效果最佳。

图4 电泳时间的选择Fig.4 Selection of electrophoresis time
2.4条带切胶回收、纯化及测序

图5 条带进切胶图Fig.5 Electrophoresis of DNA bands of interest
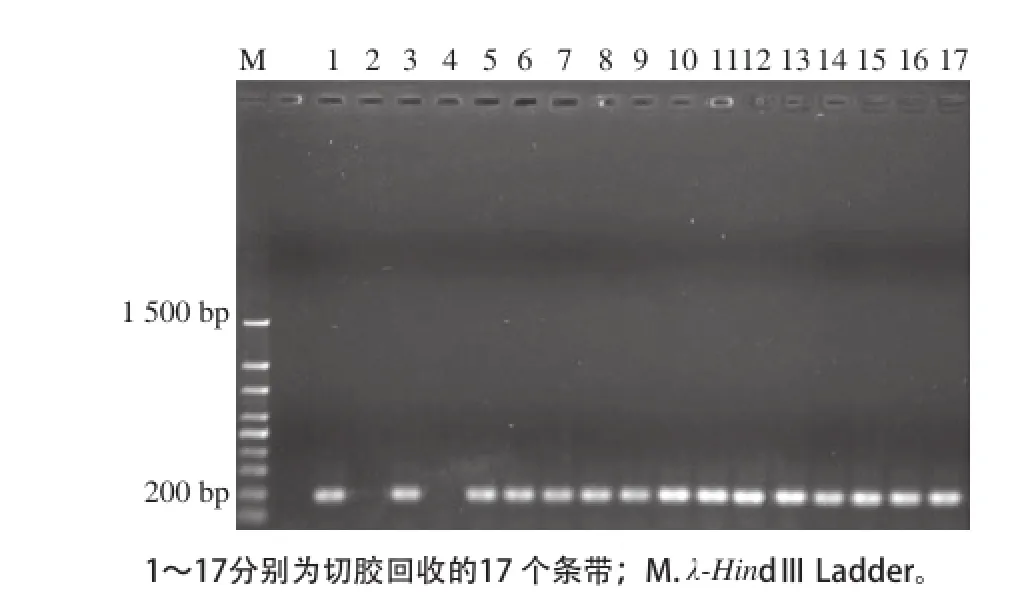
图6 DGGE切胶条带重新PCR电泳图Fig.6 Electrophoresis of PCR-amplified products of target bands in DGGE profile
2.4.1条带的切胶回收DGGE电泳完毕后,共选取了17个条带进行了切胶回收,结果见图5。将切胶回收的条带使用F341与R534进行2次PCR扩增后,进行琼脂糖电泳分析,结果见图6。从图6可以看出,除了条带2与条带4切胶回收失败外,其他条带均能满足后续实验的要求。条带2、4失败的原因可能是由于切胶回收产物的浓度太低,不能满足PCR反应要求。
2.4.2电泳条带纯化

图7 切胶条带的纯化结果Fig.7 Electrophoresis of purified bands
经过数次变性梯度凝胶纯化后,回收条带的DGGE图谱(图7)可以看出,使用DGGE凝胶可以对切胶条带有很好的纯化效果。
2.4.3测序
将纯化后的条带进行测序,测序所得基因序列结果登陆GenBank数据库,进行BLAST相似性比对,测序结果见表1。
通过邻接法构建的系统发育树可以判断细菌的同源关系,结果见图8。在系统发育树上同一分支的细菌同源关系最近,可以清楚地看出所分离细菌的分类情况及各自最相近的种属名称。

表1 条带16S V3可变区序列分析Table 1 Sequence analysis of the bands based on 16S rDNA V3 region
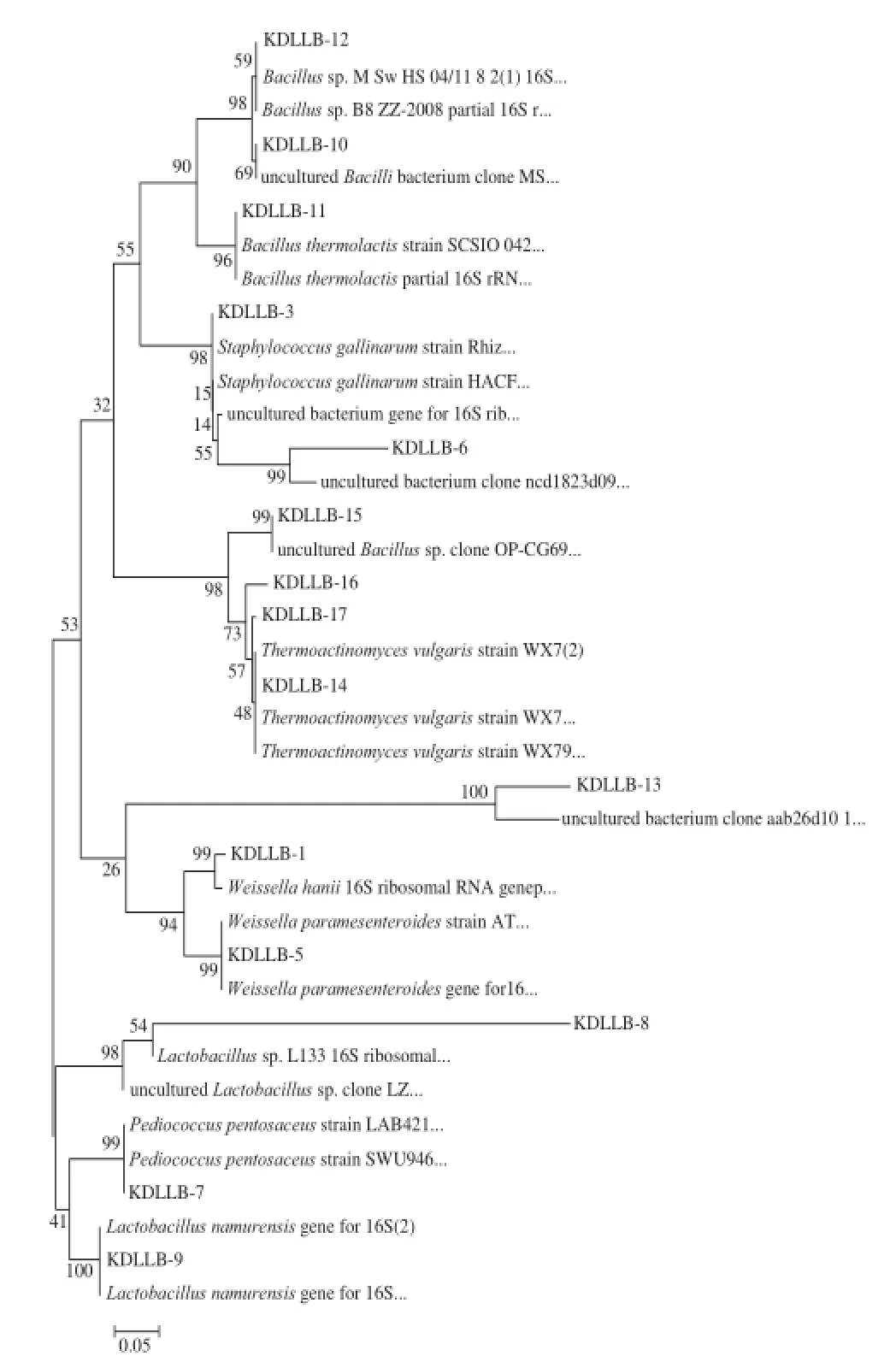
图8 基于16S V3区序列和Neighbor-Joining法构建的系统发育树Fig.8 Phylogenetic tree based on sequences of 16S rDNA V3 region and Neighbor-Jointing method
由图8可以看出,所得序列与GenBank数据库中16S rDNA序列的相似性在94%~100%之间。实验结果中,与条带1、5、7、8、9同源性最高的物种分别对应为Weissella hanii、Weissella paramesenteroides、Pediococcus pentosaceus、Lactobacillussp.、Lactobacillus namurensis,共涉及魏斯氏菌属、乳杆菌属和片球菌属3个属。乳酸菌对酿酒过程及最终产品的风味形成有突出贡献,发酵初期产生大量乳酸,使发酵环境的pH值下降,可抑制有害菌繁殖;发酵中后期产生的乳酸是形成乳酸乙酯和其他香气成分的提前物质,进而对增强酒的甜醇感和延长味感、增加酒的香气柔和性等发挥作用[18]。可见,乳酸菌群系是羊羔美酒大曲中重要的产酸细菌菌群,推测其与羊羔美酒最终独特的口感有一定相关性。条带10、11、12、15同源性最高的物种分别对应为unculturedBacilli bacterium、Bacillus thermolactis、Bacillussp.、unculturedBacillussp.,都属于芽孢杆菌属细菌,赵佳[19]和李增胜[20]等研究表明,芽孢杆菌(如枯草芽孢杆菌)有水解淀粉、分解蛋白质的能力,其在酒类酿造过程中起着增香、产酸、增加酒体绵甜与清香有一定作用,所以必要的芽孢杆菌对酿造过程是有益的。而与高温放线菌属有较高同源性的条带为14、16、17,最相似序列为普通高温放线菌(Thermoactinomyces vulgaris)序列,可见其也在酒曲细菌菌群中占有一席之地。有研究[21-23]表明在芝麻香型白酒大曲中曾分离到普通高温放线菌,并发现其具有嗜高温酶、碱性磷酸盐酶、酯酶、类脂酯酶活性等特性,而对其在酒曲和酿酒过程中的作用,尚需进一步研究。
3 结 论
本实验建立了利用PCR-DGGE技术快速高效分析羊羔美酒大曲中细菌菌群构成的方法,并利用PCRDGGE技术分析了羊羔美酒大曲中细菌的多样性。研究结果表明,在非培养方式下,检测到羊羔美酒大曲中细菌物种资源信息非常丰富,从酒曲中直接进行总基因组DNA的提取,得到的物种里包含了魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、片球菌(Pediococcus)、芽孢乳杆菌(Sporolactobacillus)、葡萄球菌(S t a p h y l o c o c c u s)、高温放线菌属(Thermoactinomyces),除此之外,还发现了4个不可培养的微生物种类,分别为条带6 uncultured bacterium、条带10 unculturedBacilli bacterium、条带13uncultured bacterium和条带15 unculturedBacillussp.。由此可见,在羊羔美酒大曲中存在着部分不可培养的微生物。微生物的非培养鉴定技术结合PCR-DGGE分子生物学手段,非常有利于酿酒微生物资源的研究,尤其是对不可培养的物种。本实验结果丰富了羊羔美酒大曲中微生物物种资源的信息,为进一步研究具有我国北方特色的地方名酒风味物质特征、改进传统的配料和酿造工艺提供了可靠的参考依据。
[1]荣瑞金,李祖明.中国酒曲微生物研究进展[J].中国酿造, 2009, 28(6): 5-8.
[2]万自然.大曲培养过程中微生物及酶的变化[J].酿酒科技, 2004(4): 25-26.
[3]傅金泉.中国酒曲的起源与发展史探讨[J].中国酿造, 2010, 29(6): 180-185.
[4]惠丰立,褚学英,冯金荣,等.大曲中可培养霉菌多样性的分子分析[J].食品与生物技术学报, 2007, 26(2): 76-79.
[5]敖宗华,陕小虎,沈才洪,等.我国浓香型大曲产业发展概况[J].酿酒科技, 2001(1): 78-81.
[6]傅金泉.中国酒曲技术的发展与展望[J].酿酒, 2002, 29(2): 7-9.
[7] NGUYEN T V, THUY M L, ANH T D. Microbial diversity of traditional vietnamese alcohol fermentation starters (banh men) as determined by PCR-mediated DGGE[J]. International Journal of Food Microbiology, 2008, 128(2): 268-273.
[8] KESMEN Z, YETIMAN A E, GULLUCE A, et al. Combination of culture-dependent and culture-independent molecular methods for the determination of lactic microbiota in sucuk[J]. International Journal of Food Microbiology, 2012, 153(3): 428-435.
[9]高亦豹.聚合链式反应-变性梯度电泳技术(PCR-DGGE)研究中国白酒大曲中微生物群落结构[D].无锡:江南大学, 2010.
[10]LÜXucong, WENG Xing, ZHANG Wen, et al. Microbial diversity of traditional fermentation starters for Hong Qu glutinous rice wine as determined by PCR-mediated DGGE[J]. Food Control, 2012, 28(2): 426-434.
[11]闫亮珍,李晓然,全哲学,等.汾酒大曲和酒醅样品DNA提取方法的优化[J].食品与发酵工业, 2011, 37(3): 32-36.
[12]谭映月,胡萍,谢和.应用PCR-DGGE技术分析酱香型白酒酒曲细菌多样性[J].酿酒科技, 2012(10): 107-111.
[13]代道芳.基于宏基因组学技术的传统发酵泡菜中乳酸菌多样性研究[D].南宁:广西大学, 2011.
[14] PEREIRA G V D M, MAGALH☒ES-GUEDES K T, SCHWAN R F. rDNA-based DGGE analysis and electron microscopic observation of cocoa beans to monitor microbial diversity and distribution during the fermentation process[J]. Food Research International, 2013, 53(3): 482-486.
[15]施思,邓宇,李波. DGGE法在盛夏习酒酒醅的微生物菌群结构解析中的应用[J].酿酒科技, 2010(3): 51-53.
[16] LI M Y, ZHOU G H, XU X L. Changes of bacterial diversity and main flora in chilled pork during storage using PCR-DGGE[J]. Food Microbiology, 2006, 23(7): 607-611.
[17] HU P, XU X L, ZHOU G H, et al. Study of theLactobacillus sakeiprotective effect towards spoilage bacteria in vacuum packed cooked ham analyzed by PCR-DGGE[J]. Meat Science, 2008, 8: 462-469.
[18]毛青钟.论黄酒发酵过程酵母和乳酸杆菌协同作用关系[J].山东食品发酵, 2006(1): 29-31.
[19]赵佳,雷振河,吕利华,等.汾酒产酸细菌的分离鉴定及其产酸条件研究[J].食品与发酵工业, 2009, 35(12): 43-46.
[20]李增胜,任润斌.清香型白酒发酵过程中酒酷中的主要微生物[J].酿酒, 2005, 32(5): 33-34.
[21]刘洋,赵婷,姚粟,等.一株芝麻香型白酒高温大曲嗜热放线菌的分离与鉴定[J].生物技术通报, 2012(12): 210-216.
[22]葛媛媛,姚粟,刘洋,等.芝麻香型白酒高温大曲嗜热细菌群落研究[J].食品与发酵工业, 2012, 38(11): 16-19.
[23]束莹.古井贡酒大曲中微生物群落结构的鉴定及分析[D].哈尔滨:哈尔滨工业大学, 2013.
Bacterial Diversity of Daqu for Yanggaomeijiu as Determined by PCR-Mediated DGGE
LI Yan1,2, DONG Zhenling1,3, LI Jia1, MOU Dehua1,*
(1. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China; 2. R&D Center for Fermentation Engineering of Hebei Province, Shijiazhuang 050018, China; 3. Hebei Inatural Biological Technology Co. Ltd., Shijiazhuang 050800, China)
Purpose: To detect and analyze the bacterial diversity of Yanggaomeijiu Daqu (traditional Chinese fermentation starter) by polymerase chain reaction-denatured gradient gelelectrophoresis (PCR-DGGE) for further understanding of the flavor characteristics of Yanggaomeijiu. Methods: Samples of Yanggaomeijiu were processed and then extracted to obtain total DNA for PCR amplification and the amplified DNA bands were excised from the gels for sequence analysis by DGGE. Results: By using PCR-DGGE, the genus ofWeissella,Lactobacillus,Pediococcus,Sporolactobacillus,Staphylococcus,Thermoactinomycesand 4 unculturablebacterial strains were identified in Yanggaomeijiu Daqu. Conclusions: This work shows that the bacterial diversity is abundant in Yanggaomeijiu Daqu among which, lactic acid bacteria constituted the largest group.
Yanggaomeijiu Daqu; bacteria; PCR-DGGE
TS261.1
A
1002-6630(2015)12-0142-06
10.7506/spkx1002-6630-201512027
2014-09-29
河北省石家庄市科技支撑计划项目(101171271A;10117901A);河北省自然科学基金项目(C2011208028)
李艳(1958—),女,教授,本科,研究方向为饮料酒酿造、酿酒微生物。E-mail:lymdh5885@163.com
*通信作者:牟德华(1960—),男,教授,本科,研究方向为农产品加工。E-mail:dh_mou@163.com
