氢化物原子荧光法分析不同地区刺参总硒和无机硒含量及分布规律
2015-01-05李秀梅孙国华杨建敏任利华马元庆谷伟丽刘兆存
李秀梅,孙国华,杨建敏,*,任利华,马元庆,谷伟丽,张 健,刘兆存
(1.上海海洋大学水产与生命学院,上海 201306;2.山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台 264006;3.山东华春渔业有限公司,山东 东营 257236)
氢化物原子荧光法分析不同地区刺参总硒和无机硒含量及分布规律
李秀梅1,2,孙国华2,杨建敏2,*,任利华2,马元庆2,谷伟丽2,张 健2,刘兆存3
(1.上海海洋大学水产与生命学院,上海 201306;2.山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台 264006;3.山东华春渔业有限公司,山东 东营 257236)
为测定我国黄渤海海域刺参群体硒含量并探索其分布规律,采用氢化物原子荧光光谱法进行含量分析。结果显示,呼吸树为总硒和无机硒含量最高的组织,平均值分别为(14.171±3.412)mg/kg和(6.194±3.829)mg/kg,不同组织内的总硒、无机硒含量变化呈现一致的规律,硒含量由高到低为:呼吸树>消化道>肌肉>内壁>外壁,同时刺参体壁和肌肉(食用部分)中有机硒比例在75.6%~89.4%之间(除东营地区刺参群体肌肉组织的有机硒比例最低为53.6%);5个地区刺参群体同一组织内的总硒及无机硒含量有显著性差异,东营地区呼吸树、消化道和肌肉中无机硒含量较高。
氢化物原子荧光光谱法;刺参;总硒;无机硒;有机硒
刺参(Apostichopus japonicus)属棘皮动物门、海参纲、刺参科、仿刺参属,主要分布在北纬35°~44°的西北太平洋沿岸,在全世界约40余种可供食用的大型海参中,以产于我国黄渤海的刺参的质量最佳[1-2]。刺参具有高蛋白、低脂肪、低糖及无胆固醇等优点,深受人们的喜爱,是我国海水养殖中重要经济品种之一。硒是人体所必需的微量元素之一,在机体内发挥重要的生理作用,具有抗病、防老抗衰、解毒等功能[3],与人类健康密切相关。生物体中的硒(特别是有机硒)是人类营养硒来源的基本渠道,而刺参体内硒含量相当丰富,根据2002年中国食物成分表中的数据,在21类1 506种食物中干海参的硒含量排位第5[4]。近年来富硒功能性食品的开发已成为关注的热点[5],已有研究者对作为主要水产品的刺参体内总硒含量进行了测定[6],但刺参体内硒的研究还比较薄弱,有机硒和无机硒的比例、不同组织间和不同地区间有何差异,这些方面还缺乏相关研究。
近年来硒的分析方法得到了很大的发展,目前硒元素检测在GB 5009.93—2010《食品中硒的测定》中有原子荧光光谱法和荧光法,还有光学分析法、电化学分析法和色谱法等方法[7],但是很多方法都存在一定的缺点,比如分光光度法灵敏度低,试剂不稳定;电化学法干扰严重;色谱法操作繁琐,而其中氢化物原子荧光光谱法具有灵敏度高、检出限低、共存离子干扰小、线性范围宽、方法快速简便等优点。其主要体现在Se元素在常温条件下与还原剂反应形成气态氢化物,可与大量基体分离,大大降低了基体干扰,且因为是气体进样方式,极大地提高了进样效率和灵敏度。氢化物发生反应要求的酸度范围也很宽,硼氢化钠的消耗量也小。在仪器最佳工作条件下,回收率及精密度高,因此是一种行之有效的检测手段。目前,氢化物原子荧光光谱法已被广泛应用于测定水产品等食品中的硒含量[8-9]。
硒特殊的生理、生化功能不仅取决于其总浓度水平,而且同硒存在的化学形态以及不同化学形态下硒化物的浓度水平密切相关,无机硒和有机硒生物学特性大不相同[10],因此建立准确有效的总硒和无机硒含量测定方法十分必要。本研究以黄渤海海域5个典型地区刺参群体为研究对象,进行刺参体内不同组织的总硒及无机硒含量的测定,一方面通过比较不同地区刺参群体硒含量的差异,为研究环境对刺参体内硒含量的影响提供基础数据;另一方面获得刺参体内不同组织的硒含量分布信息,为进一步探明不同形态存在的硒的代谢及硒蛋白分子生物学方面的研究提供参考。
1 材料与方法
1.1材料与试剂
2014年4月,取黄渤海海域大连、东营、烟台、青岛、日照5个典型刺参群体样品,刺参生长期约22个月。取刺参的外壁、内壁、呼吸树、消化道、肌肉,用剪刀剪碎,分别装入样品袋-80℃冷冻,低温冷冻干燥48 h,粉碎,过80目筛,干燥保存,备用。
硒标准储备液(100 mg/L) 国家标准物质研究中心;质控样:黄鱼(Pseudosciaena polyactis)成分分析标准物质(GBW 08573) 国家海洋局第二海洋研究所;环己烷(优级纯) 天津市光复精细化工研究所;硼氢化钾(优级纯) 国药集团化学试剂有限公司;氢氧化钾、盐酸、硝酸(均为优级纯)、铁氰化钾(分析纯) 天津市科密欧化学试剂有限公司。
1.2仪器与设备
AFS-930型半/全自动顺序注射原子荧光光度计 北京吉天仪器有限公司;MARS微波消解仪 美国CEM公司;EH45B型电子控温加热板 北京莱伯泰科仪器有限公司;EH35A-Plus位控数显电热板 上海川翔生物科技有限公司;JY 92-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Elix-5+MILLI-Q纯水超纯水系统 美国Millipore公司;DK-8D型电热恒温水槽上海一横科技有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;YB-FD-J冷冻干燥机 上海亿倍实业有限公司;CHB-100水浴锅 杭州博日科技有限公司;CR21G高速冷冻离心机 天美科技有限公司;超净工作台 日本Air Tech公司。
1.3方法
1.3.1 检出限的计算
按照本实验方法连续12次测定空白溶液,按公式(1)计算检出限(L),计算得出最低检出限为0.000 506 ng/mL。

式中:S为空白多次测量的标准方差;k为方法的灵敏度。
1.3.2仪器条件
MARS微波消解仪:功率800 W;升温程序:6 min升至120℃,保持2 min,之后以6 min升至150℃,保持2 min,最后4 min升至180℃,保持15 min。降温程序:15 min降至120℃。
EH35A-Plus位控数显电热板:功率800 W;升温程序:30 min升至140℃,保持120 min。降温程序:15 min降至100℃。
AFS-9130双道原子荧光光度计:波长196. 0 nm;灯电流80 mA;光电倍增管负高压270 V;原子化器温度:200℃;炉高8 mm;载气流量400 mL/min;屏蔽气流量800 mL/min;采用峰面积读数,读数时间7 s;延时1.5 s;进样量0.5 mL。
1.3.3消解方法
样品处理总硒消解:准确称取样品0.20 g(精确到0.000 1 g)于聚四氟乙烯消解罐中,加硝酸10.00 mL(硝酸即可使样品消解完全,所以无需再加入过氧化氢),于微波消解仪中消解,消解完毕,用电子控温电热板加热赶酸,再继续加热至剩余体积1.00 mL左右,不可蒸干,再加5.00 mL体积分数50%盐酸(以浓盐酸为基准)溶液将正6价硒还原为正4价,继续加热至溶液变为清亮无色并伴有白烟出现。冷却,冷却后转移到50 mL比色管中,用超纯水定容、混匀。同时做空白实验。
无机硒消解:准确称取样品0.20 g(精确到0.000 1 g)于50 mL离心管中,加入20.00 mL超纯水,超声破碎20 min,然后90℃水浴加热10 min,冷却后,9 000 r/min离心10 min,移取上清液至分液漏斗,用环己烷萃取,分出水相即为无机硒提取液。
无机硒提取液采用电热板加热消解。移取无机硒提取液6.00 mL,置于消化瓶中,加10.00 mL混合酸(高氯酸-硝酸,1∶9,V/V)及几粒玻璃珠,盖上表面皿冷消化过夜。次日于电热板上加热,并及时补加硝酸。当溶液变为清亮无色并伴有白烟时,再继续加热至剩余体积2.00 mL左右,切不可蒸干。同总硒消解,冷却后再加5.00 mL体积分数50%盐酸溶液,继续加热至溶液变为清亮无色并伴有白烟出现。冷却后转移至50 mL比色管,用超纯水定容、混匀。同时做空白实验。
1.3.4测定方法的准确性验证
用体积分数10%盐酸溶液逐级稀释100 mg/L硒标准储备液至30μg/L,并含1%K3[Fe(CN)6],作为硒标准工作液。仪器在线自动配制标准系列,依次为:0.50、1.00、2.00、5.00、10.00、30.00μg/L。在最佳实验条件下进行测定,以测得的荧光强度为纵坐标,相应质量浓度为横坐标绘制标准曲线;取2头刺参冷冻干燥,粉碎过筛后,称取16份各0.20 g(精确到0.000 1 g)的样品,分别添加100 ng/mL硒标准溶液400.00、1 000.00和2 000.00μL,每个质量浓度做5个重复,然后按1.3.3节中总硒的测定步骤进行处理及分析。同样测定无机硒的回收率和精密度;准确称取0.20 g国家标准物质黄鱼,按1.3.3节步骤进行前处理,用已经优化好的最佳仪器条件进行检测,考察检测结果的准确性。
1.3.5样品分析与计算
样品经1.3.3节处理后,吸取10.00 mL试样消化液于25 mL容量瓶中,加浓盐酸2.50 mL,铁氰化钾溶液1.00 mL,稀释至刻度混匀。分别取标准系列及样品于自动进样器专用管中,用体积分数10%盐酸溶液为载体,10 g/L硼氢化钾为还原剂依次测定标准系列、样品空白、样品,按1.3.2节设定的仪器条件进行分析,仪器数据处理系统自动记录荧光强度和进行数据处理。并根据线性方程,自动计算结果。按公式(2)计算样品中硒含量:
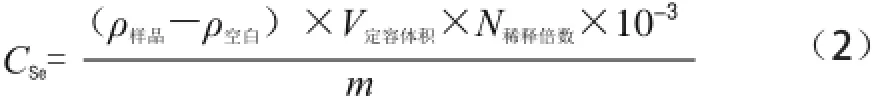
式中:CSe为样品中硒含量/(mg/kg);ρ样品为样品消解液中硒质量浓度/(μg/L);ρ空白为空白溶液(试剂空白)中的硒质量浓度/(μg/L);V定容体积为消解液定容的体积50 mL;N稀释倍数为定容后的消解液稀释倍数;m为样品质量/g。
总硒测定值与无机硒测定值差减得到有机硒。
1.4数据处理
实验数据用Excel软件进行常规计算后,采用SPSS 17.0软件进行单因素方差分析(One-way ANOVAAnalysis),结果用P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1测定方法的准确性验证
标准曲线绘制结果表明,硒元素质量浓度为0~30μg/L,与荧光强度有良好的线性关系,线性方程为I=133.065C+21.761,相关系数为0.999 8,回归方程的斜率倒数为0.007 515。由表1可知,当在各样品中分别加入质量浓度为0.32、0.80、1.60 ☒g/L硒标准溶液时,样品总硒的回收率达到96.375%~99.738%,相对标准偏差为2.926%~5.257%,无机硒的回收率达到92.875%~95.363%,相对标准偏差为2.725%~6.096%,以上结果表明,测定总硒及无机硒的方法准确度高,重复性好,通过差减法得到样品的有机硒含量是真实可信的,同时国家标准物质测定值在标准值允许误差范围内,说明该方法准确、可靠,能够满足水产品中总硒的检测要求。
2.2刺参不同组织间硒含量分布规律及差异性
由表2可知,黄渤海海域大连、东营、烟台、青岛、日照5个典型刺参群体的不同组织总硒及无机硒含量存在较大的组织间差异性,刺参呼吸树组织中总硒含量在9.877~18.719 mg/kg之间,外壁、内壁、消化道和肌肉组织内总硒含量分别为1.541~4.795、1.632~5.925、8.801~15.585 mg/kg和4.547~9.568 mg/kg。对比不同组织硒含量,呼吸树为含量最高的组织,平均值达(14.171±3.412)mg/kg。由图1可知,不同刺参群体呼吸树组织间总硒含量有极显著差异(P<0.01);消化道为含量次高组织,平均值为(11.503±2.978)mg/kg;外壁与内壁组织中总硒含量值较接近,且远低于其他3个组织(P<0.01)(图1A),可食用部分体壁和肌肉组织低于呼吸树和消化道。刺参呼吸树组织无机硒含量在2.553~12.212 mg/kg之间,均值为(6.194±3.829)mg/kg,方差分析表明,仅日照刺参呼吸树中的无机硒含量低于消化道中的无机硒含量(P<0.01),其余4个地区刺参呼吸树无机硒含量仍远高于其他各组织(P<0.01)(图1B);外壁与内壁组织无机硒含量非常接近且最低,仅青岛刺参内壁与外壁无机硒含量有差异(P<0.05),其余4个地区刺参内壁与外壁无机硒含量均无显著差异(P>0.05)。总之,各地区不同组织中的总硒及无机硒含量平均值整体变化规律为:呼吸树>消化道>肌肉>内壁>外壁(图1B)。
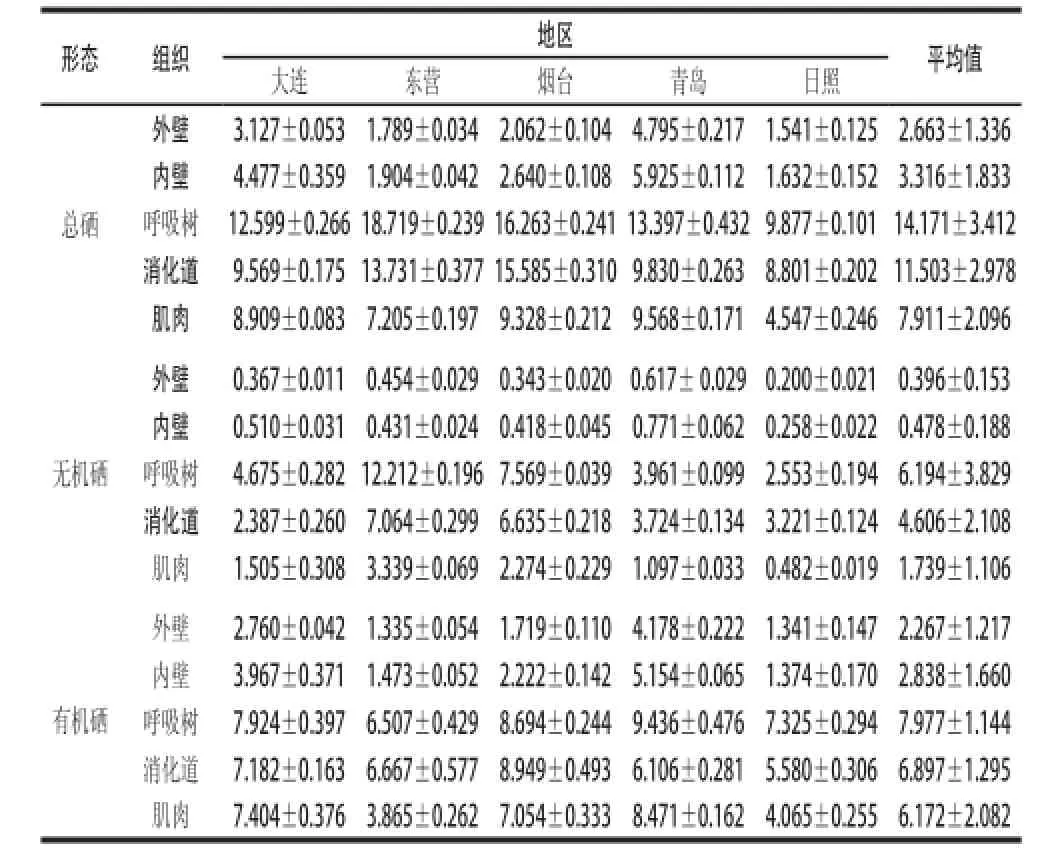
表2 不同地区刺参不同组织的不同形态硒含量( =3)Table 2 Selenium levels in different tissues of Apostichopus japonicus ( = 3) mg/kg
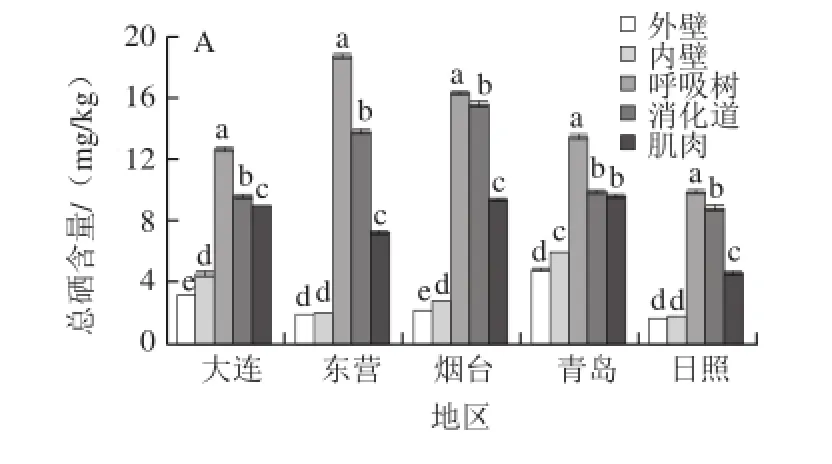
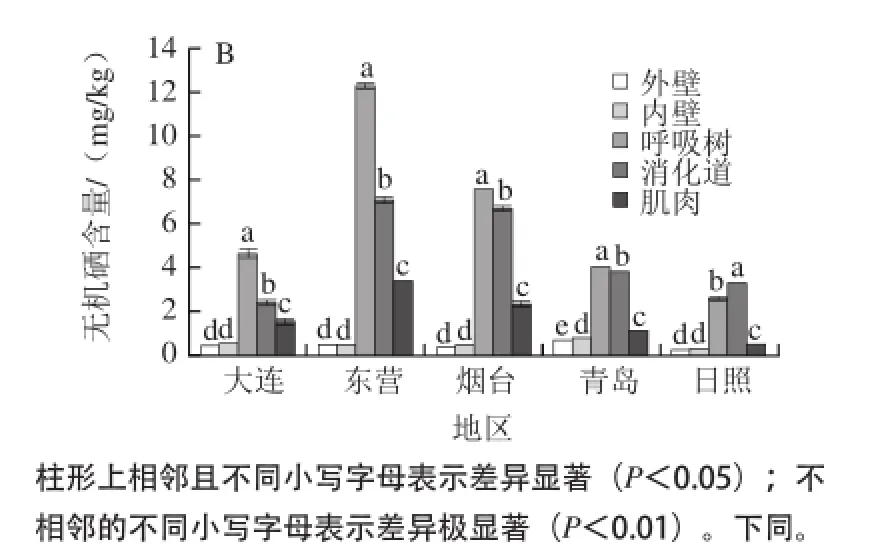
图1 刺参总硒含量(A)及无机硒含量(B)在不同组织间的差异比较Fig.1 Comparison of total selenium and inorganic selenium contents in different tissues ofApostichopus japonicus
2.3 不同地区间刺参群体组织硒含量分布规律及差异性
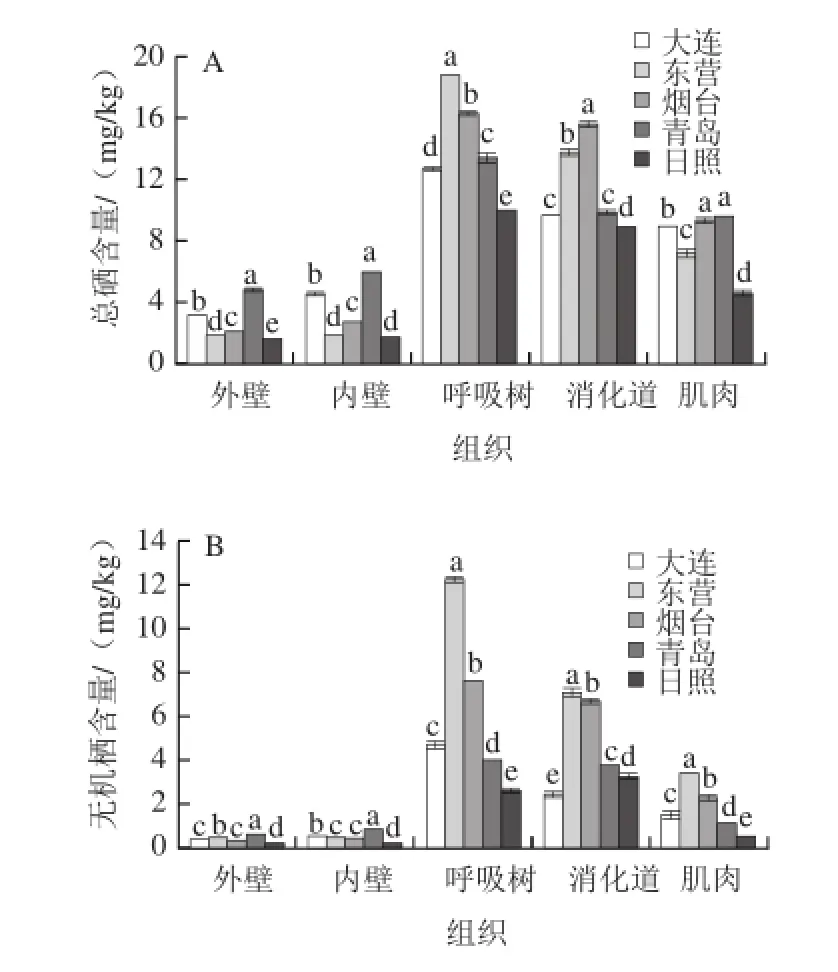
图2 刺参总硒含量(A)及无机硒含量(B)在不同地区间的差异比较Fig.2 Comparison of total selenium and inorganic selenium contents inApostichopus japonicusfrom different regions
由图2可知,不同地区间刺参体内硒的含量亦存在差异。在东营刺参中呼吸树组织总硒含量最高为18.719 mg/kg,在日照刺参中最低为9.877 mg/kg,在大连、烟台、青岛刺参中分别为12.599、16.263、13.397 mg/kg。方差分析表明,各地区间呼吸树总硒含量有极显著差异(P<0.01);刺参消化道中总硒含量烟台群体最高为(15.585±0.310)mg/kg,东营群体次之为(13.731±0.377)mg/kg,日照群体最低为(8.801±0.202)mg/kg,大连(9.569 mg/kg)和青岛(9.830 mg/kg)刺参消化道中总硒含量接近(P>0.05),分别与其他3个地区的差异极显著(P<0.01);各地区刺参外壁、内壁组织总硒含量呈现一致的变化规律:青岛>大连>烟台>东营>日照(图2A)。不同地区刺参无机硒含量对比发现,东营地区刺参呼吸树、消化道和肌肉中无机硒含量均高于其他地区,且各地区间无机硒含量在刺参呼吸树、消化道和肌肉3个组织中均有显著差异(P<0.05),此外,青岛、日照刺参群体内壁无机硒含量分别和其他3个地区间有极显著差异(P<0.01),5个地区刺参的内壁、外壁组织无机硒含量变化规律与总硒变化规律略有不同(图2B)。
2.4 5个地区刺参群体各组织中有机硒及无机硒比例
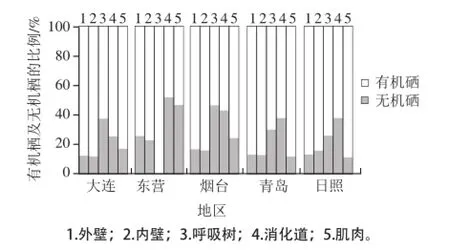
图3 不同地区刺参不同组织有机硒和无机硒比例Fig.3 Percentages of organic selenium and inorganic selenium in different tissues
通过差减法计算样品中有机硒的含量,并计算出无机硒及有机硒占总硒的比例,见图3。在刺参体壁和肌肉(食用部分)中有机硒比例为75.6%~89.4%(除东营地区刺参群体肌肉组织的有机硒比例最低为53.6%);呼吸树和消化道(非食用部分)为无机硒比例较高的组织,呼吸树无机硒含量比例为25.8%~65.2%,消化道无机硒含量为24.9%~51.4%。东营地区刺参样品各组织中无机硒的含量百分比均高于其他4个地区,其中呼吸树无机硒比例高达65.2%。
3 讨论与结论
3.1刺参不同组织间的硒含量差异分析
硒在刺参各组织中分布广泛,且呈现不同程度的积累,与丁君等[11]研究的幼参不同组织对Zn2+、Cu2+的蓄积结果一致,另有研究结果表明,硒在其他水产动物各器官的分配也各不相同[12-13]。刺参不同组织间硒含量有显著性差异,主要原因是各组织对硒的富集能力及代谢过程不同。刺参呼吸树组织中硒含量均高于其他组织。毛文君等[14]研究发现无机硒以被动吸收的形式渗透进入细胞以及一些贝类(紫贻贝和海湾扇贝)的外套膜中硒含量也明显高于其他组织中的,而刺参的呼吸树起到贝类中鳃的作用,所以硒的蓄积量相对较高,因此呼吸树中的硒含量可以在一定程度上反映出环境中的硒含量。此外,呼吸树中无机硒含量也偏高,推测一方面是因为环境中无机硒含量偏高,另一方面是因为富集的无机硒不能通过呼吸树被吸收。本实验结果表明5个刺参群体呼吸树总硒与无机硒含量变化几乎呈现一致的规律,且呼吸树中的无机硒比例最高,进一步说明呼吸树由于滤水作用而引起的硒富集是不可忽略的;刺参消化道中硒含量普遍偏高。有研究者对畜禽动物进行的相关实验证明,以硒(Ⅳ)和硒(Ⅵ)存在形式的无机硒主要通过小肠被动吸收,而以氨基酸形式为主的有机硒也是通过小肠被吸收,但运输机制是主动吸收[15]。此外,刺参的消化道结构非常简单,没有消化腺,也没有特化出与解毒作用和排泄作用相关的组织和器官[11],吸收进入体内的硒主要在肠中积累,因此刺参消化道中总硒的含量普遍偏高。此外,消化道中的无机硒的含量较高,推测原因为环境中以无机价态硒含量较高,消化道吸收的大量无机硒未完全转化为有机硒而进入其他组织;刺参肌肉组织中硒值仅低于呼吸树和肠组织中硒值。有相关研究表明,肌肉是动物体内硒库之一[16],以硒蛋氨酸的形式存在于肌蛋白中,并在蛋氨酸充足的情况下,转变为硒半胱氨酸,同理推测硒在刺参体内最终以硒代氨基酸的形式稳定贮存在肌肉中;刺参内壁、外壁组织中硒含量相差不大,且明显低于其他3个组织。主要因为刺参体壁的胶原蛋白中蛋氨酸和半胱氨酸的比例较低[17],所以硒蓄积量低于肌肉组织中的。
3.2不同地区间的刺参硒含量差异分析
有研究表明,海洋动物对重金属的累积量与其环境海水中重金属含量具有指数相关[18]。侯淑敏等[19]报道富硒地区水产品硒含量明显高出普通地区,与养殖环境中的硒有很大的相关性。本实验中东营刺参群体呼吸树中总硒含量最高,但在肠中并不是最高的,且肌肉、外壁及内壁组织中的总硒含量也比大连、烟台、青岛刺参群体的低,同时东营刺参群体各组织中无机硒含量普遍偏高,此外,东营刺参群体肠中有机硒比例很低(48.6%),且外壁、内壁和肌肉中的有机硒比例也低于以上3个地区群体组织,推测是因为黄河径流排入海洋中大量的含硒废水[20],黄河口浅海区海水与外界海水对流混合缓慢,硒大量沉积于淤泥中后通过复杂的食物链被刺参富集;或者推测另外的因素为刺参对不同形态的硒具有选择吸收性,东营水环境中刺参可利用硒含量较低,其详细机理有待进一步探讨。相反,日照刺参群体呼吸树组织中总硒含量最低,推测日照地区取样海区含硒量较低或可被刺参利用的硒含量低。同时肠中总硒含量相对偏高,而肌肉、外壁及内壁组织中总硒含量也并不高,推测原因为低硒环境有利于刺参对硒的吸收代谢,但不利于硒的积累。总之,外环境中硒含量偏高或偏低以及可利用的硒形态较少均不利于吸收代谢和积累。
刺参不同地区间的硒含量差异,不仅与养殖水环境相关,还与刺参的摄食结构、发育阶段、生长周期等生物学因素密切相关。在自然界中,刺参主要附着在礁石等附着基上,以海藻和海浮泥等沉积物为主要饵料的刺参摄食复杂[21]。实验中刺参均选自围堰养殖的成参,5个地区围堰海区的生态环境均不同,底栖动物的种类组成及群落结构呈现多样性[22],若需探索其更深层次的规律,则需要进一步研究养殖刺参水体中的微观生态环境及海水环境中的硒元素指标,进行综合评价。另外不同刺参苗种来源其摄取硒的能力及刺参的生长期不同亦可能影响地区间刺参硒值差异。
3.3测定无机硒的意义
不同形态的硒具有不同的生物学活性,所以仅由总硒含量并不足以了解其对人体健康的影响。Caroli[23]认为形态分析是鉴定和测量对人体健康和环境有危害的各种形式的无机物,研究结果表明无机硒的毒性远高于有机硒,且有机硒毒性小、生物活性高[24]。但是中国水产品中硒的限量要求(GB 2762—2005《食品中污染物限量》)及我国营养学会推荐硒的安全摄入量(50~200μg/d)都是根据总硒含量而定的,忽略了毒性较大的无机硒含量。而路文彬[25]利用富硒乳酸杆菌做的相关研究表明微量硒元素在人体内之所以能参与许多生理功能,主要取决于有机硒的作用,无机硒作用很差。因此在测定水产品中的硒时,进行测定不同形态的硒含量非常重要。实验中测定的无机硒、有机硒含量及比例,可以保证基本的硒安全摄入量。呼吸树及肠中有毒的无机硒比例偏高,不建议食用,而可食用部分体壁及肌肉中无机硒含量极其低,有机硒含量高,同时作为刺参的主要可食用部分是可以安全食用的。此外,测定无机硒及有机硒含量还可以为确定刺参体内无机态硒离子及有机态的小分子硒化物含量及化学结构奠定研究基础,进一步准确分析硒在刺参体内的营养利用性。
刺参体内硒含量非常丰富,测定刺参不同部位硒含量及形态分布对于了解硒在刺参体内的分布规律具有重要意义。此外,舍弃无机硒含量高的呼吸树及消化道,合理膳食刺参体壁和肌肉,可以充分利用活性高的有机硒,以避免无机硒中毒,为指导人们合理膳食提供了重要依据。同时需要说明的是,各种硒化合物代谢是复杂的,并不能将简单的吸收测定与生物利用等同,还需要进一步完善氢化物发生-原子荧光光谱法与反相高效液相色谱、气相色谱、毛细管电泳、凝胶色谱等的联用技术,研制高纯度的标准参考物质,测定生物体内的不同硒代谢产物,进一步深入探究硒的作用机理,以促进刺参养殖业的发展。
[1]徐永东,李可闻.我国海参产业现状分析[J].渔业信息与战略, 2013, 28(2): 117-122.
[2]李成林,宋爱环,胡炜,等.山东省刺参养殖产业现状分析与可持续发展对策[J].渔业科学进展, 2010, 31(4): 126-133.
[3]屈兰竺,杨松杰,禚苏,等.微量必需元素硒的作用探析[J].中国农学通报, 2010, 26(7): 94-97.
[4]中国疾病预防控制中心营养与食品安全所.中国食物成分表[M]. 2版.北京:北京大学医学出版社, 2002: 24-211.
[5]蒋步云,柴振林,朱杰丽,等.富硒产品的开发利用及研究现状[J].江苏农业科学, 2012, 40(11): 446-448.
[6]王正,沙博郁,孙开奇,等.测定海参中硒含量的微波消解-氢化物原子荧光光谱法[J].职业与健康, 2013, 29(12): 1480-1484.
[7]于振,李建科,李梦颖,等.食品中微量硒测定方法研究进展[J].食品工业科技, 2012, 33(18): 371-377.
[8] LIU Bojing, QIAN Lichun. Determination of trace selenium in spirulina by continuous-flow hydride generation atomic absorption spectrometry[J]. Spectroscopy and Spectral Analysis, 1999, 19(4): 610-612.
[9]徐明敏,方波,蔡曦.双通道原子荧光光谱法同时测定海产品中的硒和汞[J].中国卫生检验杂志, 2011, 21(6): 1392-1397.
[10]夏弈明.硒[J].营养学报, 2013, 35(3): 223-226.
[11]丁君,张学辉,丁鸣,等.幼刺参不同部位对Zn2+、Cu2+的蓄积动力学研究[J].海洋环境科学, 2008, 27(4): 359-362.
[12]刘伟,石连玉,卢玲,等.鲤、虹鳟组织硒含量及外源硒对其影响探讨[J].上海水产大学学报, 1998, 7(8): 136-139.
[13] DIANNE F J, WILLIAM A M, JENNELLE K. Selenium accumulation in the cockleAnadara trapezia[J]. Environmental Pollution, 2004, 132(2): 203-212.
[14]毛文君,管华诗,李八方.几种海洋生物体内硒含量的测定[J].海洋湖沼通报, 1995(4): 28-32.
[15]何若方,李绍钰,李静,等.动物产品中硒富集的研究[J].饲料工业, 2008, 29(12): 57-58.
[16] ZHOU Xuxia, WANG Yanbo, GU Qing, et al. Effects of different dietary selenium sources (selenium nanoparticle and selenomethionine) on growth performance, muscle composition and glutathione peroxidase enzyme activity of crucian carp (Carassius auratus gibelio)[J]. Aquaculture, 2009, 291(1): 78-81.
[17]韩华.不同年龄刺参体壁营养成分分析及评价[J].海洋环境科学, 2011, 30(1): 404-408.
[18] SCHULZ B M. Lead uptake from seawater and food and lead loss in the common musselmytilusedulis[J]. Marine Biology, 1974, 25(3): 177-193.
[19]侯淑敏,问思恩,李寒松,等.陕西安康富硒地区鱼肉中硒含量分析[J].微量元素与健康研究, 2014, 31(1): 30-31.
[20] KIRBY J, MAHER W, KRIKOWA F. Selenium, cadmium, copper and zinc concentrations in sediment and mullet (Mugil cephalus) from the southern basin of Lake Macquarie, New South Wales, Australia[J]. Archives of Environmental Contamination and Toxicology, 2001, 40(2): 246-256.
[21]姜森颢,周一兵,唐伯平,等.刺参养殖池塘初级生产力及其粒级结构周年变化[J].生态学报, 2014, 34(7): 1698-1706.
[22]顾炎斌,宋文豪,姚韡远,等.东营市河口区潮间带大型底栖动物群落结构特征[J].海洋环境科学, 2013, 32(5): 702-706.
[23] CAROLI S. Element speciation: challenges and prospects[J]. Microchemical Journal, 1995, 51(1/2): 64-72.
[24] SCHRAUZER G N, WHITE D A. Elemental selenium in organic selenium compounds: their chemistry and biology[J]. Biology Inorganic Chemistry, 1983, 8(3): 303-305.
[25]路文彬.富硒乳酸杆菌的研究[J].首都医学院学报, 1994, 15(2): 114-116.
Analysis of Total Selenium and Inorganic Selenium in Apostichopus japonicus from Different Regions by Hydride Generation-Atomic Fluorescence Spectrometry
LI Xiumei1,2, SUN Guohua2, YANG Jianmin2,*, REN Lihua2, MA Yuanqing2, GU Weili2, ZHANG Jian2, LIU Zhaocun3
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Shandong Marine Resource and Environment Research Institute, Yantai 264006, China; 3. Shandong Huachun Fisheries Co. Ltd., Dongying 257236, China)
This study aimedto explore the selenium status ofApostichopus japonicusfrom the Yellow Sea and the Bohai Sea. Total selenium and inorganic selenium were detected by hydride generation-atomic fluorescence spectrometry (HGAFS). This method had a wide linear dynamic range and good precision and accuracy, so it was suitable for the determination of different forms of selenium in aquatic products. Selenium levels in four populations ofApostichopus japonicusfrom Dalian, Dongying, Yantai, Qingdao, and Rizhao respectively were examined. Among five tissues investigated, respiratory tree contained the highest levels of organic selenium and inorganic selenium which were averaged at (14.171±3.412) and (6.194±3.829) mg/kg, respectively, and both of which followed the same decreased order of respiratory tree>digestive tract>muscle>inner body wall>outer body wall. The proportions of organic selenium in body wall and muscle (the edible part) were between 75.6%and 89.4%, except forApostichopus japonicasmuscle from Dongying containing the lowest level (53.6%) of organic selenium. There were significant differences in the contents of total selenium and inorganic selenium in the same tissues from different regions, and the contents of inorganic selenium in respiratory tree, digestive tract and muscle were higher in Dongying population than in those from other regions.
hydride generation-atomic fluorescence spectrometry (HG-AFS);Apostichopus japonicus; total selenium; inorganic selenium; organic selenium
O657.31;TS207.3
A
1002-6630(2015)12-0113-06
10.7506/spkx1002-6630-201512021
2014-11-03
山东省自然科学基金项目(ZR2013CM029);山东省现代农业产业技术体系刺参创新团队项目(SDAIT-08);
山东省优秀中青年科学家基金项目(Y231041011);烟台市科技发展计划项目(2012133);
海洋经济创新发展区域示范项目(20130125);国家海洋局海洋公益性行业科研专项(201205027;201105029)
李秀梅(1989—),女,硕士研究生,主要从事海洋生物遗传育种研究。E-mail:saishangxunmei@163.com
*通信作者:杨建敏(1967—),男,研究员,博士,主要从事海洋生物遗传育种研究。E-mail:ladderup@126.com
