反相高效液相色谱法测定东北地区6种红树莓果实中鞣花酸含量
2015-01-05王金玲李亮亮吕长山
王金玲,李亮亮,吕长山
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.东北农业大学应用技术学院,黑龙江 哈尔滨 150030)
反相高效液相色谱法测定东北地区6种红树莓果实中鞣花酸含量
王金玲1,李亮亮1,吕长山2
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.东北农业大学应用技术学院,黑龙江 哈尔滨 150030)
建立反相高效液相色谱法 测定 东北地区6种红树莓果实中鞣花酸含量,同时与蓝莓进行比较 分析。色谱条件:色谱柱Si noChrom DS-BP C18(150 mm×4.6 mm,5μm);流动相为CH3OH-0.3%磷酸(40∶60,V/V);流速1 mL/min,柱温30℃,检测波长254 nm。结果表明:鞣花酸得到很好地分离,鞣花酸含量在0.1~1μg范围内与峰面积 呈良好的线性关系,R2为0.999 3。精密度实验相对标准偏差为0.06%,重复性实验相对标准偏差为0.09%,稳定性实验相对标准偏差为0.39%,平均加样回 收率为93.00%~98.62%,相 对标准偏差为0.21%~0.42%,该方法简单、准确、重复性好。测得不同品种红树莓果实中总鞣花酸含量为39.10~155.98 mg/100 g;游离鞣花酸含量为1.24~8.26 mg/100 g,红树莓中含有丰富的鞣花酸,具有潜在的开发利用价值。
红树莓;鞣花酸;反相高效液相法
红树莓为蔷薇科(Rosaceae)悬钩子属(Rubusspp.)多年生灌木型植物,也叫托盘、马林果、覆盆子等。果实酸甜可口,具有较高的营养价值和保健价值[1-4],其中鞣花酸是红树莓果实中重要的功能成分[5]。鞣花酸又叫并没食子酸,是没食子酸的二聚衍生物,属于多酚二内酯,结构如图1所示。天然的鞣花酸广泛存在于各类浆果、坚果等植物组织和果实中,如草莓、石榴、板栗、龙眼、芒果等[6-9]。自然界中以游离形式存在的鞣花酸较少,主要以鞣花单宁的形式存在,经过酸水解后释放鞣花酸。大量研究表明鞣花酸具有抗氧化、抗炎、抗癌等活性功能[10-16]。因此,受到众多学者的关注,逐渐成为研究的热点。
东北地区是我国红树莓的主产区,资源丰富,种植历史久,规模大,品种多。对本地区红树莓中鞣花酸的系统研究未见报道。本实验建立了一种反相高效液相色谱法测定6种红树莓果实中总鞣花酸和游离鞣花酸含量,同时与蓝莓进行比较分析,该方法能够快速、准确地测定出鞣花酸含量,从而可以明确不同品种红树莓鞣花酸含量及品种间含量差异,为东北地区红树莓鞣花酸的相关研究、产品开发提供参考依据。
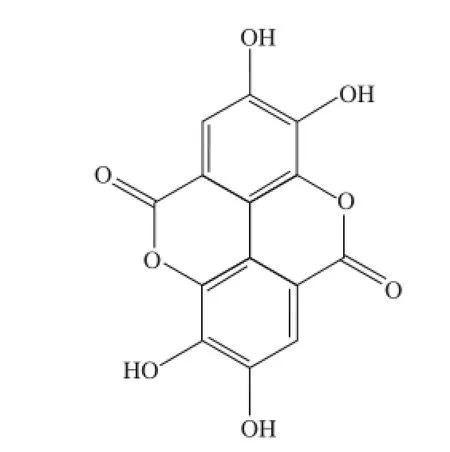
图1 鞣花酸化学结构[17]Fig.1 Chemical structure of ellagic acid
1 材料与方法
1.1材料、试剂与仪器
红树莓,野生品种;欧洲红、红宝石、哈瑞太兹、菲尔杜德、秋福,均为红树莓栽培品种,2013年7月采自哈尔滨市尚志市,成熟度好;蓝莓:北陆,为栽培品种,2013年7月采自哈尔滨市五常市,成熟度好。
鞣花酸对照品(纯度大于98%) 南京森贝伽生物科技有限公司;甲醇(色谱纯) 赛默飞世尔(中国)有限公司;水 杭州娃哈哈集团有限公司;二甲基亚砜、甲醇(均为分析纯) 天津富宇精细化工有限公司;盐酸(分析纯) 北京化工厂。
1260高效液相色谱仪 美国安捷伦公司;恒温水浴锅 上海森信实验仪器有限公司;0.45μm微孔滤膜天津市奥特赛恩斯仪器有限公司;FA-2004型电子天平上海天平仪器厂;RE-2000A旋转蒸发器 巩义市予华仪器有限责任公司;超声波清洗器 昆山市超声仪器有限公司。
1.2方法
1.2.1色谱条件
色 谱 柱 为S i n o C h r o m D S-B P C18柱(150 mm×4.6 mm,5μm);流动相为CH3OH-0.3%磷酸(40∶60,V/V),流速1 mL/min,柱温30℃,进样量10μL,检测波长254 nm。
1.2.2对照品溶液的制备
准确称取鞣花酸对照品12.50 mg,置于25 mL量瓶中,用二甲亚砜溶解并稀释至刻度,摇匀。经0.45μm的微孔滤膜过滤,制成0.5 mg/mL溶液,作为对照品溶液。
1.2.3 标准曲线绘制
用对照品溶液配制成0.01、0.02、0.04、0.06、0.08、0.10 mg/mL的标准溶液,采用高效液相色谱法测定,进样量10μL, 测定峰面积。以峰面积为纵坐标,鞣花酸质量浓度(mg/mL)为横坐标进行回归,绘制鞣花酸含量的标准曲线和回归方程。
1.2.4游离鞣花酸含量测定
取研磨后的5 g红树莓匀浆,加入90%甲醇溶液50 mL,室温提取8 h,超声处理30 min,抽滤,再用旋转蒸发仪浓缩至干,残渣用二甲亚砜溶解,定容于100 mL容量瓶中,经0.45μm的微孔滤膜过滤,用于高效液相色谱分析。根据标准曲线计算其鞣花酸含量。
1.2.5总鞣花酸含量测定
取研磨后的5 g树莓匀浆,加入酸化的甲醇(含1.2 mol/L盐酸)50 mL,85℃回流8 h,再用旋转蒸发仪浓缩至干,残渣用二甲亚砜溶解,定容于100 mL容量瓶中,经0.45μm的微孔滤膜过滤,用于高效液相色谱分析。根据标准曲线计算其鞣花酸含量。
1.3数据分析
采用Word、Excel、SPSS 11.5软件对数据进行处理与分析。结果表示为 ±s。
2 结果与分析
2.1标准曲线
以峰面积为纵坐标,鞣花酸质量浓度为横坐标绘制鞣花酸含量的标准曲线,得到回归方程为y=132 261x-45.527,R2=0.999 3。
2.2精密度
分别精密吸取已知质量浓度的鞣花酸对照品溶液和某一品种红树莓水解后样品溶液连续进样5次,测定总鞣花酸的峰面积。结果测得,总鞣花酸对照品峰面积分别为5 209.19、5 209.95、5 269.61、5 244.59、5 229.35,相对标准偏差(relative standard deviation,RSD)为0.41%;红树莓样品峰面积分别为10 274.60、10 265.60、10 268.40、10 267.00、10 257.40,峰面积RSD为0.06%,表明测定结果精密度良好。
2.3重复性
取某一品种红树莓样品5份,分别按总鞣花酸含量测定方法处理,分别进样,测定鞣花酸峰面积。结果显示,峰面积RSD为0.09%,表明样品处理过程和测定方法重复性好。
2.4稳定性
取某一品种红树莓水解后样品溶液室温条件下分别放置0、2、4、6、8 h后进样测定峰面积,结果显示峰面积RSD为0.39%,说明鞣花酸性质稳定。
2.5回收率
吸取某一品种红树莓水解后样品溶液5 mL,共3份,测定出其实际含量,然后分别加入质量浓度为0.06、0.08、0.10 mg/mL的鞣花酸对照品溶液5 mL,得到混合样品。进样10μL,每次加标测定3次,计算平均加标回收率,结果如表1所示,计算得平均加标回收率为93.00%~98.62%,RSD为0.21%~0.42%。
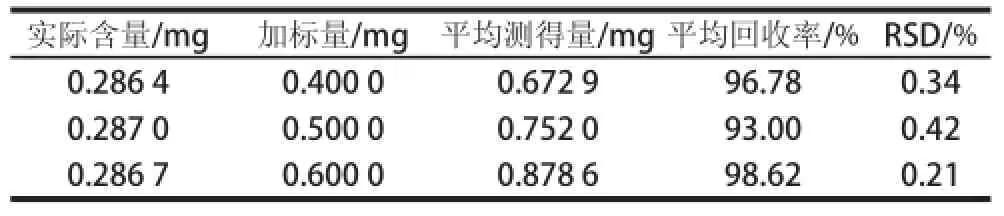
表1 回收率实验结果Table 1 Results of recovery tests
2.6样品分析
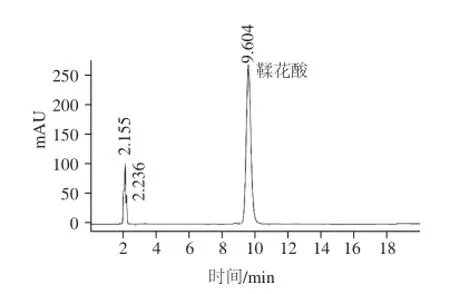
图2 0.04 mg/mL鞣花酸对照品色谱图Fig.2 HPLC chromatogram of 0.04 mg/mL ellagic acid standard
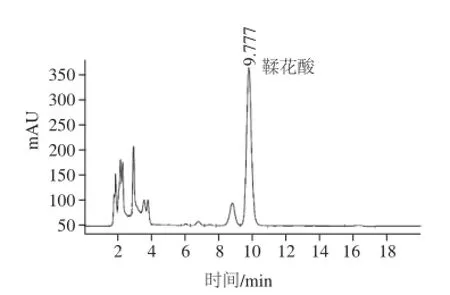
图3 红树莓样品总鞣花酸色谱图(以菲尔杜德品种为例)Fig.3 HPLC chromatogram of total ellagic acid from red raspberry sample (Ferlod i as an example)
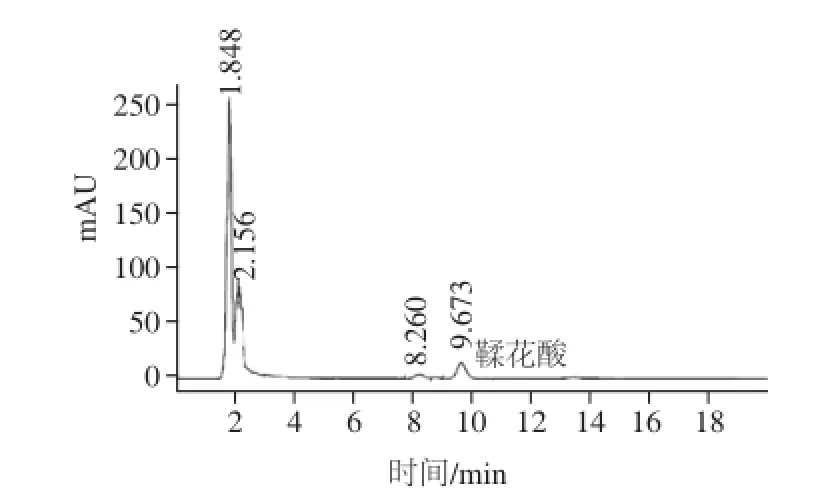
图4 红树莓样品游离鞣花酸色谱图(以菲尔杜德品种为例)Fig.4 HPLC chromatogram of free ellagic acid from red raspberry sample (Ferlodi as an example)
将鞣花酸对照品和不同品种红树莓样品溶液按照1.2.1节色谱条件分别进样分析。鞣花酸对照品色谱图与红树莓鞣花酸色谱图如图2~4所示。根据图2鞣花酸对照品色谱峰保留时间确定出红树莓样品中总鞣花酸和游离鞣花酸色谱峰。
2.7样品测定结果
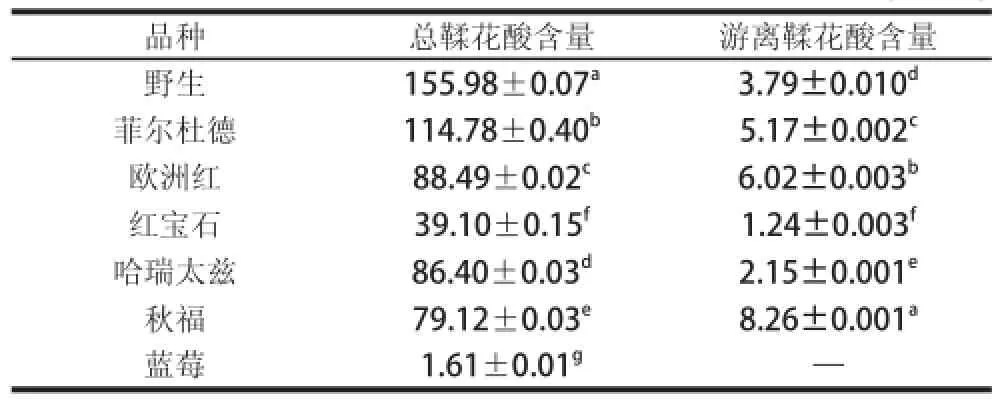
表2 不同品种红树莓鞣花酸含量Table 2 The contents of ellagic acid from different red raspberry cultivars mg/100 g
由表2可知,6个品种红树莓总鞣花酸含量为39.10~155.98 mg/100 g,野生品种鞣花酸含量最高,红宝石品种含量最低,且野生品种鞣花酸含量显著高于栽培品种,是红宝石品种的近4倍,与蓝莓相比,红树莓总鞣花酸含量远高于蓝莓。红树莓果实中游离鞣花酸含量少,在1.24~8.26 mg/100 g范围内,在蓝莓中未检测到游离鞣花酸,可能蓝莓中游离鞣花酸含量极少甚至没有。红树莓果实中游离鞣花酸远远低于总鞣花酸含量,说明在红树莓果实中鞣花酸主要以鞣花单宁形式存在,较少以游离鞣花酸形式存在。
Bobinaite等[18]测得不同红树莓品种中游离鞣花酸为2.0~5.5 mg/100 g,通过酸水解后的总鞣花酸含量为119.8~323.5 mg/100 g。与本实验测定的结果具有一定的相似性。李小萍等[19]利用高效液相色谱法测定红树莓中水解后鞣花酸含量为223 mg/kg,张成涛等[20]利用高效液相色谱法测定红树莓果实中水解鞣花酸含量为43.5 mg/g,与本实验测定结果有差异,可能跟品种、种植环境、种植气候等因素有关。
3 讨 论
鞣花酸作为红树莓中一种具有重要保健价值的天然活性物质,有必要对其准确测定。目前有很多种测定鞣花酸的方法,如紫外分光光度法[21]、高效毛细管电泳法[22]等,但高效液相色谱法因其快速、准确的特点被广泛运用于鞣花酸含量测定[23-25]。高效液相色谱法对红树莓鞣花酸定量测定已有报道,为本实验的开展提供了参考。由于红树莓样品中复杂多样的成分和色谱条件,如色谱柱、流动相的选择与配比、流动相pH值、流速、柱温等,都会影响目标成分的分离效果,流 动相选择与配比是影响分离效果的关键因素,本实验在参考相关报道的基础上,结合现有实验条件,选择以CH3OH-0.2%三氟乙酸、CH3OH-0.3%三氟乙酸[19]、CH3OH-0.2%磷酸、CH3OH-0.3%磷酸[20](50∶50,V/V)作为流动相时,结果发现4种流动相的鞣花酸色谱峰出峰时间早,均低于5 min,但以CH3OH-0.3%磷酸(50∶50,V/V)为流动相的色谱峰峰形最好,于是进一步调整CH3OH-0.3%磷酸体积比,发现体积比为40∶60时鞣花酸色谱峰出峰时间更适宜,且没有杂峰干扰,分离度高,鞣花酸得到很好的分离,因此确定流动相为CH3OH-0.3%磷酸(40∶60,V/V)。从色谱条件看,以CH3OH-0.3%磷酸为流动相,无需其他特殊试剂,低毒、简单易得、成本低。从色谱图看,出峰时间大约为10 min,测定时间适宜,可以快速进行分析,且基线平稳,鞣花酸与其他物质分离效果好,受其他物质影响较小。该方法适合于红树莓鞣花酸的测定分析。
回流提取时间影响鞣花酸的含量,回流提取时间短,鞣花单宁水解不完全,时间过长,鞣花酸易氧化而降低。Bobinaite等[18]分别测定回流提取4、8、16、20 h时鞣花酸含量,结果发现鞣花酸含量先升高后降低,在回流提取8 h时鞣花酸含量最高。根据上述结果,本实验选择回流提取时间为8 h,但是对于本实验中不同的红树莓品种,8 h是否为最佳回流提取时间,以及提取回流时间对其鞣花酸的影响有待进一步研究。
4 结 论
本实验对东北地区不同品种红树莓果实中鞣花酸含量测定结果表明:红树莓果实中总鞣花酸含量丰富,为39.10~155.98 mg/100 g;但游离鞣花酸含量很低,为1.24~8.26 mg/100 g,远低于总鞣花酸含量。此外,红树莓果实中总鞣花酸含量远高于蓝莓。红树莓是理想的天然鞣花酸来源,具有巨大的利用价值。
[1]韩加,新华·纳比,阿里木·帕塔尔,等.新疆树莓果实营养成分及其提取物抗氧化性研究[J].营养学报, 2008, 30(4): 410-413.
[2]郭军战,彭少兵,陈铁山.树莓和黑莓引种品种果实营养成分分析[J].西北林学院学报, 2004, 19(1): 108-109.
[3] KAFKAS E, OZGEN M, OZOGUL Y, et al. Phytochemical and fatty acid profile of selected red raspberry cultivars: a comparative study[J]. Journal of Food Quality, 2008, 31: 67-78.
[4] CHEN Liang, XIN Xiulan, ZHANG Hucheng, et al. Phytochemical properties and ant-ioxidant capacities of commercial raspberry varieties[J]. Journal of Functonal Foods, 2013, 5(1): 508-515.
[5] MULLEN W, YOKOTA T, LEAN M E J, et al. Analysis ofellagitannins and conjugates of ellagic acid and quercetinin raspberry fruits by LC-MSn[J]. Phytochemistry, 2003, 64(2): 617-624.
[6] PINTO M D S, LAJOLO F M, GENOVESE M I. Bioactive compounds and quantification of total ellagic acid in strawberries (Fragaria × ananassaDuch.)[J]. Food Chemistry, 2008, 107(4): 1629-1635.
[7] VEKIARI S A, GORDON M H, GARCLA-MACLAS P, et al. Extraction and determination of ellagic acid content in chestnut bark and fruit[J]. Food Chemistry, 2008, 110(4): 1007-1011.
[8] XIANG Lan, XING Dongming, LEI Fan, et al. Effects of season, variety, and processing method on ellagic acid content in pomegranate leaves[J]. Tsinghua Science and Technology, 2008, 13(4): 460-465.
[9] SOONG Y Y, BARLOW P J. Quantification of gallic acid and ellagic acid from longan (Dimocarpus longanLour.) seed and mango (Mangifera indicaL.) kernel and their effects on antioxidant activity[J]. Food Chemistry, 2006, 97(3): 524-530.
[10] QIU Zhenpeng, ZHOU Benhong, JIN Long, et al.In vitroantioxidant and antiproliferative effects of ellagic acid and its colonic metabolite, urolithins, on human bladder cancer T24 cells[J]. Food and Chemical Toxicology, 2013, 59: 428-437.
[11] OU H C, LEE W J, LEE S D, et al. Ellagic acid protects endothelial cells from oxidized low-density lipoprotein-induced apoptosis by modulating the PI3K/Akt/eNOS pathway[J]. Toxicology and Applied Pharmacology, 2010, 248(2): 134-143.
[12] CORBETT S, DANIEL J, DRAYTON R, et al. Evaluation of the antiinflammatory effects of ellagic acid[J]. Journal of Peri-Anesthesia Nursing, 2010, 25(4): 214-220.
[13] ZHAO Min, TANGA S N, MARSH J L, et al. Ellagic acid inhibits human pancreatic cancer growth in Balb c nude mice[J]. Cancer Letters, 2013, 337(2): 210-217.
[14] SRIGOPALRAM S, ILAVENIL S, JAYRAAJ I A. Apoptosis associated inhibition of DEN-induced hepatocellular carcinogenesis by ellagic acid in experimental rats[J]. Biomedicine and Preventive Nutrition, 2012, 2(1): 1-8.
[15]郑建仙.植物活性成分开发[M].北京:中国轻工业出版社, 2005: 89-91.
[16]陆晶晶,丁轲,杨大进.保健品功能因子鞣花酸研究进展[J].食品科学, 2010, 31(21): 451-454.
[17] KILIC I, YESILOGLU Y, BAYRAK Y. Spectroscopic studies on the antioxidant activity of ellagic acid[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 130: 447-452.
[18] BOBINAITE R, PRANAS V, PATRAS R V. Variation of total phenolics, anthocyanins, ellagic acid and radical scavenging capacity in various raspberry (Rubusspp.) cultivars[J]. Food Chemistry, 2012, 132(1): 1495-1501.
[19]李小萍,梁琪,辛秀兰,等.高效液相色谱法测定红树莓中鞣花酸含量[J].安徽农业科学, 2009, 37(24): 11345-11346.
[20]张成涛,万国盛,赵余庆,等.红树莓果实中鞣花酸和树莓酮的含量测定[J].中国实验方剂学杂志, 2013, 19(19): 140-143.
[21]陈笳鸿,吴冬梅,汪咏梅,等.紫外分光光度法测定鞣花酸含量的研究[J].生物质化学工程, 2007, 41(3): 18-20.
[22]纪白慧,杨笑笑,倪鑫炯,等.毛细管电泳法测定石榴皮中鞣花酸与安石榴苷含量[J].分析测试学报, 2013, 32(3): 367-371.
[23]刘玉革,刘丽琴,刘胜辉,等.高效液相色谱法测定成熟龙眼各部位游离鞣花酸含量[J].食品科学, 2012, 33(14): 181-183.
[24]刘振平,陈祥贵,彭海燕,等.反相高效液相色谱法测定石榴籽中鞣花酸的含量[J].食品科学, 2012, 33(18): 220-222.
[25]孙杰,朱佳,李博,等.高效液相色谱法测定黑莓果汁中鞣花酸含量[J].食品与机械, 2013, 29(5): 84-86; 119.
Determination of Ellagic Acid from Six Red Raspberry Cultivars Grown in Northeast China Using RP-HPLC
WANG Jinling1, LI Liangliang1, L☒ Changshan2
(1. School of Forestry, Northeast Forestry University, Harbin 150040, China; 2. School of Applied Technology, Northeast Agricultural University, Harbin 150030, China)
A reversed phase high performance liquid chromatography (RP-HPLC) method was established to determine the contents of ellagic acid in six red raspberry cultivars grown in northeast China. Meanwhile, the results were compared with those of the blueberry fruit. A SinoChrom DS-BP C18column (150 mm×4.6 mm, 5μm) was used to separate ellagic acid; the mobile phase was a mixture of 0.3%phosphate and methanol solution (60:40,V/V) at a flow rate of 1.0 mL/min; the column temperature was set at 30 ℃ and the UV detection wavelength was 254 nm. Our results indicated that ellagic acid could be separated well, and a good linear relationship appeared between the content of ellagic acid in the range of 0.1-1μgand peak area with correlation coefficient of 0.999 3. The relative standard deviation (RSD) was 0.06%for precision, 0.09%for reproducibility, and 0.39%for stability. The average recovery rates of ellagic acid from spiked samples were between 93.00%and 98.62%with RSD of 0.21%-0.42%. The proposed method is convenient, accurate, and repeatable. The contents of total ellagic acid in different red raspberry cultivars varied from 39.10 to 155.98 mg/100 g, and the content of free ellagic acid was in the range of 1.24 to 8.26 mg/100 g. Red raspberry is rich in ellagic acid, and it could be fully developed and utilized.
red raspberry; ellagic acid; reversed phase high performance liquid chromatography (RP-HPLC)
S663.2
A
1002-6630(2015)12-0093-04
10.7506/spkx1002-6630-201512017
2014-10-26
中央高校基本科研业务费专项(2572014CA14)
王金玲(1975—),女,副教授,博士,主要从事植物源活性物质研究。E-mail:Wangjinling08@163.com
