厦门白姑鱼腌制加工过程中的脂肪酸变化分析
2015-01-05蔡秋杏吴燕燕李来好杨贤庆赵永强王悦齐
蔡秋杏,吴燕燕,李来好,*,杨贤庆,赵永强,王悦齐
(1.中国海洋大学食品科学与工程学院,山东 青岛 266000;2.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300;3.钦州学院食品工程学院,广西 钦州 535099)
厦门白姑鱼腌制加工过程中的脂肪酸变化分析
蔡秋杏1,2,3,吴燕燕2,李来好2,*,杨贤庆2,赵永强2,王悦齐2
(1.中国海洋大学食品科学与工程学院,山东 青岛 266000;2.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300;3.钦州学院食品工程学院,广西 钦州 535099)
探讨厦门白姑鱼(Argyrosomus amoyensis)腌制加工过程中的脂肪酸的变化,并结合脂肪氧化相关指标:过氧化值(peroxide value,POV)及硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)值,确定脂肪氧化对脂肪酸组成的影响。从腌制加工的7 个关键工序中取样,采用气相色谱-质谱联用法分析脂肪酸,同时考察POV及TBARS值。结果表明:厦门白姑鱼原料含26.41%的饱和脂肪酸(saturated fatty acids,SFA)、20.26%的单不饱和脂肪酸(monounsaturated fatty acids,MUFA)和53.33%的多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),共24种,必需脂肪酸占12.49%,二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)占40.70%。在腌制加工中,SFA含量显著增加,MUFA含量和PUFA含量显著降低(P<0.05)。POV和TBARS值都呈现了先增后减的趋势,分别在烘干1 d和3 d出现峰值。相关性分析表明,SFA与MUFA呈显著负相关(P<0.05),与PUFA呈极显著负相关(P<0.01),MUFA和PUFA没有相关性;SFA与POV和TBARS值呈现显著正相关(P<0.05),而PUFA与POV和TBARS值分别呈显著(P<0.05)和极显著负相关(P<0.01)。因此,厦门白姑鱼脂肪酸种类多,含有丰富的不饱和脂肪酸,腌制加工过程对主要8 种脂肪酸有显著影响,脂肪的氧化使SFA含量增加,同时使PUFA含量降低,PUFA更容易发生氧化。
厦门白姑鱼;腌制加工;脂肪酸;脂肪氧化
白姑鱼(Argyrosomus amoyensis)为石首鱼科的其中一种,分布于印度西太平洋区,主要包括中国、台湾、印度、印尼等海域,栖息深度可达60 m,体长可达40 cm。厦门白姑鱼属于低值鱼类,很少得到加工利用,随着海洋资源的日益短缺,这些低值鱼类也越来越得到重视。腌制加工是传统水产品加工的一种重要方式,腌制水产品口感和风味独特,很受我国消费者的欢迎,但安全问题也日益受到关注,目前腌制鱼在亚硝酸盐及其致癌物亚硝基化合物[1-2]等方面的研究比较集中,而关于脂质氧化引起的腌制鱼类制品质量安全问题的相关研究较少。海水鱼含有丰富的ω-3系列长链多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),如二十碳五烯酸(eicosapentaenoic acid, EPA)及二十二碳六烯酸(docosahexaenoic acid,DHA)等,在腌制加工过程中,在氧、微生物、酶等内外因素条件下,容易导致脂肪氧化[3]。脂质氧化过程产生的自由基和脂质氢过氧化物进一步作用可产生次级脂质氧化产物(如醛、醇、酮等化合物),脂肪适度氧化可赋予产品独特的风味,过度氧化则会产生令人不愉快的气味(如哈喇味、腐败味等),亦可引起鱼肉表面褐变、营养流失及水合能力变差品质劣变问题,甚至会产生毒性化合物[4]。而且食用过多的氧化脂质还会造成一系列的健康问题(如癌症、阿尔茨海默病、帕金森病、动脉粥样硬化等)[5]。国内外对传统腌制肉产品加工过程的脂肪氧化,已经进行了大量的研究,但主要集中在培根、香肠、腊鸭等禽畜肉产品,王艳等[6]对中式培根在高温强化加工时的脂肪氧化与未作高温强化的样品做比较研究表明,亚油酸含量增加了41.73%(P<0.01);同时成品中硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)值和过氧化值(peroxide value,POV)分别下降了26.10%和45.00%。Huang Yechuan等[7]考察了中式传统腌制培根加工过程的脂肪氧化变化。武华等[8]研究表明腌制能加速鳙鱼片变色,促进脂肪酸尤其是ω-3系列PUFA的氧化。Andersen等[9]发现在腌制青鱼的成熟过程中,脂肪氧化的程度不明显,可能是由于内源性VE的抗氧化作用。总之,国内外对于腌制鱼制品的脂肪氧化的研究不多,更没有对白姑鱼这种低值杂鱼进行过研究。因此,本实验通过研究厦门白姑鱼腌制加工过程中的脂肪酸的变化以及考察脂肪氧化和脂肪酸变化的关系,揭示腌制鱼加工过程的脂肪氧化规律,从而指导腌制鱼的实际加工生产。
1 材料与方法
1.1 材料与试剂
厦门白姑鱼、海水晒制粗盐 广东台山李贵记水产有限公司;三氯乙酸、氯仿、甲醇、氢氧化钠、硫氰酸钾、氯化亚铁、还原铁粉(均为分析纯) 广州化学试剂厂;TBA、1,1,3,3-四乙氧基丙烷、正己烷、三氟化硼-甲醇溶液(均为高级纯) 美国Sigma-Aldrich公司。
1.2 仪器与设备
BS224S分析天平 美国Sartorius公司;3k30冷冻离心机 美国Sigma公司;UV-2550紫外分光光度计、QP2010 plus气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪 日本岛津公司;T25均质机 德国IKA公司;HH-4快速恒温数显水浴箱 常州澳华仪器公司;RG-5型热泵干燥机广东省农业机械研究所干燥设备制造厂。
1.3 方法
1.3.1 样品制备
厦门白姑鱼为新鲜捕捞活鱼宰杀再冰冻2 d后运至广州实验室,每尾鱼的质量在800 g左右,将鱼去鳞,去内脏后用冰水冲洗干净,然后按照传统广东台山咸鱼的制作方法腌制,粗盐使用量为鱼体总质量的20%,在鱼体表面擦盐和肚子里塞盐后,将它们层装在腌制容器内,各层之间还应均匀地撒上食盐[10],加入刚好没过全部鱼体的饱和粗盐水,置于室温腌制5 d,然后流水冲洗3 次,再换水漂洗过夜,沥干后垂直悬挂于热泵干燥机中,28 ℃恒温干燥5 d。在整个腌制加工过程中取样,分别是原料(A)、腌制1 d(B)、腌制3 d(C)、漂洗后(D)、烘干1 d(E)、烘干3 d(F)、成品(G),每次取4 尾鱼,总质量约500 g鱼腹背肉,绞肉机绞碎后,真空包装并置于-80℃冰箱保存备用。
1.3.2 脂肪氧化指标分析
1.3.2.1 POV的测定
采用GB/T 5009.37—2003《食用植物油卫生标准的分析方法》[11]比色法进行测定,结果以meq/kg表示。
1.3.2.2 TBARS值的测定
按照Hasret[12]的方法进行测定,略做修改。称取1 g试样,加入25 mL 7.5%三氯乙酸溶液(含0.1% EDTANa2)溶液,振摇30 min后中速滤纸过滤2 次,取5 mL滤液加入5 mL 0.02 mol/L TBA溶液,置于沸水浴中保温40 min后,取出冷却至室温后加5 mL氯仿溶液摇匀,静置分层后,上清液于波长538 nm处测吸光度。空白对照以5 mL蒸馏水过滤后得上清液。丙二醛(malondialdehyde,MDA)含量以1,1,3,3-四乙氧基丙烷标准曲线标定后计算。结果以mg/kg计。
1.3.3 脂肪酸分析
1.3.3.1 脂肪的提取
按照Folch等[13]的方法,略作修改,称取5.0 g绞碎鱼肉于离心管中,加入15 mL氯仿-甲醇(2∶1,V/V)溶液,冰浴中用高速分散均质机匀浆2 次(10 000 r/min,2×15 s,间隔30 s)。转入50 mL具塞量筒中定容,静止1 h过滤,加入1/5体积的生理盐水,于4 000 r/min离心20 min,弃上层水与甲醇等液体杂质,下层脂质溶液转移到45 mL离心管中,用氮气吹扫有机试剂,得到浓缩脂质。
1.3.3.2 脂肪酸的甲酯化
将得到的浓缩脂质加入2 mL 14%三氟化硼-甲醇溶液[14],进行甲酯化反应30 min(60 ℃水浴),冷却至室温,分别加入1 mL正己烷和蒸馏水,振荡1 min,静止分层后,吸取上层有机层,挥干溶剂,用正己烷定容,过0.22 μm有机滤膜后,用GC-MS进行分析测定。
1.3.3.3 脂肪酸的GC-MS分析[14]
GC条件:DB-5MS色谱柱(30 m×0.25 mm,0.25 μm);进样口温度230 ℃;升温程序:110 ℃保持4 min,以10 ℃/min升温到160 ℃,保持 1 min,最后以5 ℃/min升到240 ℃,保持15 min;载气为氦气,流量为1.52 mL/min;采用恒线速度,分流比为1∶30;进样量1 μL。
MS条件:离子源温度200 ℃;电子能量70 eV;质量扫描范围m/z 40~550;溶剂切除时间3 min。
1.4 数据处理
脂肪酸分析利用计算机NIST 0.5谱库数据库检索,通过对MS图库中的标准谱图进行比较,来确认厦门白姑鱼腌制加工过程中的脂肪酸甲酯成分,按面积归一化法分析脂肪酸相对含量[14]。上述所有指标,每类样品测定3 个平行。采用Excel计算均值和标准差,Origin 7.0软件作图,JMP 7.0软件的Tukey HSD检验对数据进行显著性分析,采用SPSS软件进行相关性分析。
2 结果与分析
2.1 厦门白姑鱼腌制加工过程的脂肪氧化分析
如图1所示,在整个腌制鱼加工过程中POV和TBARS值的变化趋势是基本一致的,都呈现先增加后减少的趋势。方差分析结果表明,加工过程对厦门白姑鱼的TBARS值和POV都有显著影响(P<0.05)。如图1a所示,在整个腌制阶段(A~D)POV的变化很小(P>0.05),但从漂洗后开始急剧增加,在烘干1 d时达到最高峰,此后则一直下降直到产生成品。POV的升高主要是脂肪初级氧化产物的出现,在氧化初期,其形成速度大于分解速度,故从原料(A)到烘干1d(E),其POV是增加的,随后下降是因为氢过氧化物不稳定,很快就分解形成醛、酮类和其他产物,其分解速度则大于形成速度,因此从烘干1d(E)开始下降。由图1b可知,TBARS值则从腌制1d后(B)就出现显著性增加(P<0.05),之后一直呈上升趋势,最高值出现在烘干3d(F),而显然比POV最高值的出现滞后,因为TBARS值是油脂中不饱和脂肪酸分解所产生的衍生物如MDA与TBA反应产生的,TBARS的高低表示脂肪二级氧化产物的量。MDA随后还会与氨基相互作用生成1-氨基-3-氨基丙烯[15],所以TBARS值在最高峰后也出现了显著下降(P<0.05)。张永丝等[16]在研究鸡翅在腌制加工过程中,初期鸡翅的TBARS增大,从腌制20min开始减少;Andrés等[17]对干腌火腿的脂肪氧化的研究指出TBARS在腌制阶段出现显著性增加,而在风干后期达到峰值,这个结果也与本实验一致。
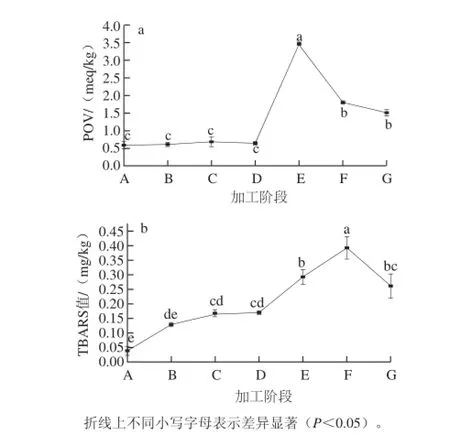
图1 厦门白姑鱼腌制加工过程中POV(a)、TBARS值(b)的变化Fig.1 Changes in POV (a) and TBARS (b) during processing
2.2 厦门白姑鱼腌制加工过程中的脂肪酸变化分析
低脂厦门白姑鱼在腌制过程中的脂肪酸组成变化见表1。新鲜厦门白姑鱼原料的总脂肪酸由26.41% SFA、20.26% MUFA和53.33% PUFA组成,脂肪酸的种类丰富,其中SFA 11 种,MUFA 8 种,PUFA 5 种,含量较高的脂肪酸有棕榈酸(C16∶0)、硬脂酸(C18∶0)和棕榈油酸(C16∶1n6)、油酸(C18∶1n9)、亚油酸(C18∶2n6)、花生四烯酸(C20∶4n6)、EPA(C20∶5n3)和DHA(C20∶6n3),人类必需的3 种脂肪酸,厦门白姑鱼里含2 种,分别是亚油酸(C18∶2n6)、花生四烯酸(C20∶4n6),总量占12.49%,而海洋生物特有的脂肪酸(EPA+DHA),在厦门白姑鱼里更是含量丰富,总量达40.70%,说明厦门白姑鱼的脂肪酸不仅种类丰富,而且富含营养。
对加工过程中出现的8 种主要脂肪酸进行方差分析以及7 个加工过程的同一种脂肪酸的变化进行显著性差异分析,结果见表1。方差分析结果表明,厦门白姑鱼腌制加工过程对这8 种主要脂肪酸都有显著影响(P<0.05)。显著性差异分析显示,对于SFA,棕榈酸(C16∶0)在腌制3 d开始表现出显著性升高(P<0.05),而硬脂酸(C18∶0)则在烘干1 d时才表现出显著性升高。总体而言,SFA总量出现3 次显著性升高(P<0.05),分别在腌制1 d、漂洗和烘干1 d。对于MUFA,棕榈油酸(C16∶1n6)在烘干3 d表现出了显著性升高(P<0.05),而油酸(C18∶1n9)则3 次表现出显著性下降(P<0.05),分别在腌制1 d、腌制3 d以及漂洗后。MUFA总量趋势是减少的,出现显著性下降(P<0.05)是在漂洗后。对于PUFA,亚油酸(C18∶2n6)表现出在腌制1 d先显著下降后(P<0.05)又在烘干1 d时出现显著升高(P<0.05);花生四烯酸(C20∶4n6)则在烘干1 d时出现显著性升高(P<0.05)。EPA(C20∶5n3)在烘干1 d后表现出显著性下降(P<0.05),而DHA(C20∶6n3)则出现了2 次显著性下降(P<0.05),分别在腌制1 d和烘干1 d时,总体而言,PUFA在烘干1 d表现出显著性下降(P<0.05)。

表1 厦门白姑鱼腌制加工过程脂肪酸组成及相对含量Table 1 Changes in fatty acid composition and relative contents during processing%
在整个厦门白姑鱼腌制加工过程中,SFA含量的变化整体趋势是升高的,而MUFA含量和PUFA含量的变化趋势是下降的,这表明腌制加工能够促进厦门白姑鱼不饱和脂肪酸的氧化,从而使其总量下降,而相对地提高了SFA含量。Kanner等[18]认为,盐能够增强铁离子的活性进而促进脂肪酸的氧化,特别是EPA(C20∶5n3)和DHA(C20∶6n3)等ω-3系列的多烯酸,是人和动物生长发育所必需的营养物质,这些物质含量的下降降低了鱼肉的营养价值,但是同时部分不饱和脂肪酸氧化生成醛类和酮类等物质,给鱼肉带来特有的风味[19]。
2.3 厦门白姑鱼腌制加工过程脂肪酸变化和脂肪氧化的关系

表2 厦门白姑鱼腌制加工过程脂肪酸和脂肪氧化指标之间的Pearson相关系数Table 2 Pearson s correlation coefficients between fatty acids and lipid oxidation parameters during processing
考察SFA、MUFA和PUFA总含量与脂肪氧化指标POV和TBARS值之间的Pearson相关性,由表2分析可知:脂肪酸之间,SFA与MUFA呈显著性负相关(P<0.05),与PUFA呈极显著负相关(P<0.01),而MUFA和PUFA之间则没有相关性,表明在腌制厦门白姑鱼加工过程中,SFA的变化趋势与MUFA和PUFA相反,MUFA和PUFA可能大部分发生了初级和次级氧化而含量下降,而SFA则较少发生氧化降解,所以相对含量上升,而PUFA更容易发生氧化。这个结果与武华等[8]在腌制鳙鱼片中的研究结果一致。刘昌华等[20]在风干鲈鱼加工过程的脂肪氧化规律研究中表明,水产品丰富的PUFA在加工与贮藏过程中比SFA更容易氧化,从而使游离的PUFA增多。但本实验略不同的是考察结合脂肪酸而不是游离脂肪酸,游离脂肪酸是脂质分解和氧化的重要中间物质,是形成风味物质的关键[21]。游离脂肪酸的增加也就意味着结合脂肪酸减少,而变化的共同原因就是脂肪分解和氧化。脂肪酸和脂肪氧化指标之间的关系表明,SFA与POV和TBARS值呈现显著正相关(P<0.05),由于POV反映的是初级氧化,而TBARS值反映的是次级氧化,说明脂肪的初级和次级氧化反应都可使SFA 的相对含量增加。MUFA则与2 个氧化指标都没有显著相关性,表明脂肪氧化对MUFA影响较小。而PUFA与POV呈现显著负相关(P<0.05),而与TBARS值呈现极显著性负相关(P<0.01),表明了PUFA的相对含量下降,生成了初级和次级氧化产物,所以POV和TBARS值升高。Fuentes等[22]在研究发酵香肠脂肪酸构成对脂肪氧化的影响时指出,PUFA含量和正己醛呈极显著正相关(P<0.01),但正己醛与TBARS值的变化部分相反,也就是与TBARS值成极显著性负相关(P<0.01),这与本实验的研究结果一致。还有研究[22-23]指出TBARS作为脂肪氧化指标的不足,原因是在火腿等腌制畜肉制品中,MDA形成以后部分参与了亚硝化反应,使TBARS测定时反应不敏感,导致TBARS实测值变小。本实验研究对象为腌制鱼制品是否出现和畜肉制品一致的结论还需要进一步地探讨。
3 讨 论
3.1 厦门白姑鱼的脂肪酸组成与营养价值
厦门白姑鱼属于闽南-台湾海峡地区的一种中上层鱼类,和蓝圆鰺(Decapterus maruadsi)、金色小沙丁鱼(Sardinella aurita)、颌圆鰺(Decapterus lajang)、鲐鱼(Pneumato phorus japonicus)等鱼类属于同一产区,吴志强等[24]对该海区的6 种鱼类的脂肪酸进行了分析,得出了综合结果为:SFA占总脂肪酸含量的35.24%~38.60%,MUFA占23.59%~30.07%,PUFA占33.06%~40.33%,EPA占2.35%~3.62%,DHA占17.95%~24.29%。SFA中,C16∶0、C18∶0占主要成分,MUFA中以C18∶1为主,PUFA中,含量最高的是DHA,其次为C20∶4、EPA等。厦门白姑鱼原料的SFA占(26.41±0.93)%,MUFA占(20.26±0.18)%,PUFA则高达(53.33±0.33)%,EPA占(8.13±0.15)%,DHA占(32.57±0.46)%。由此可知,厦门白姑鱼对比所 属海区的其他鱼类,SFA和MUFA的比例偏低,但含有更高比例的PUFA,高出13%左右,而其中的DHA含量更是高出7%左右,达到32.57%,说明就脂肪酸组成而言,厦门白姑鱼的营养价值是很高的,但目前还没有鱼脂肪酸组成的报道,可能由于这类鱼烹调后的口味远逊于黄鱼等同科鱼类,经济价值低,被列为杂鱼、低值鱼类,比较少得到研究和加工应用[25]。所以这种鱼有相当大的经济潜在价值,最近对白姑鱼加工的研究主要集中于制作鱼糜和研究其蛋白特性[26]。而腌制是一种传统的加工方式,能够合理利用白姑鱼,其腌制加工过程中脂肪酸组成变化及脂肪氧化的规律研究目前还没有相应的报道。
3.2 厦门白姑鱼腌制加工过程中脂肪氧化的规律
在腌制加工过程中,在烘干1d时白姑鱼的POV出现峰值,但之后显著下降,变化范围从0.59meq/kg到3.46meq/kg再到1.51meq/kg,POV反映脂肪的初级氧化,但因为产物氢过氧化物分解速度很快,超过了其生成速度,形成小分子醛、酮类化合物及其他物质,导致POV值降低[27]。TBARS值是不饱和脂肪酸氧化分解所产生的衍生物如MDA等与TBA反应的结果,TBARS值高低表示氧化最终生成物的多少。厦门白姑鱼原料中TBARS值最低,仅有0.04 mg/kg,而在加工的过程中,从原料开始显著性增加,到了烘干3 d时达到最高值为0.39 mg/kg,这比POV出现最高值的时间要晚,说明TBARS值显示的是次级氧化产物,而最高值出现以后也很快呈显著性下降,说明次级氧化产物MDA可能与氨基相互作用生成1-氨基-3-氨基丙烯,或者与氨基酸等物质生成美拉德产物,这些物质赋以产品风味,最终产品的TBARS值为0.26 mg/kg。刘昌华等[20]对于鲈鱼的腌制烘干成熟过程的脂肪氧化进行的研究表明,POV和TBARS值都出现了 先升后降的趋势,整个烘干成熟过程是5.5 d,峰值都出现在烘干第4天,分别达到了14.81 meq/kg和2.99 mg/kg。本实验的厦门白姑鱼腌制加工中POV和TBARS峰值也出现在烘干阶段,分别在第1天和第3天,并 且2 个峰值分别是烘干鲈鱼的23%和13%,一方面可能是淡水鱼和海水鱼之间的鱼种差别,另一方面则可能在于腌制加工工艺之间的差别。Adersen等[9]对青鱼腌制成熟过程的研究表明,POV的变化在0.4~1.1 meq/kg之间。Eymard等[28]对鯵鱼鱼糜加工和贮藏整个过程的脂肪氧化研究表明,POV的峰值也在1 meq/kg左右。
研究[29]表明肌肉中MDA含量在0.5~1.0 mg/kg之间不会有腐败气味的产生,MDA小于1.0 mg/kg是可以接受的;还有学者认为,TBARS反映的是脂肪的深层氧化程度,当TBARS值处于0.20~0.66 mg/kg时,为良质肉;超过1 mg/kg时,为变质肉,被认为已严重氧化,产品不能食用[30]。而厦门白姑鱼腌制加工过程中TBARS峰值为0.39 mg/kg,尚处于可接受食用的范围。通过本研究可评估厦门白姑鱼在腌制加工过程中脂肪氧化的程度和可接受性,以及脂肪氧化出现的关键工序,为进一步合理地控制脂肪氧化提供理论基础。
[1] 吴燕燕, 刘法佳, 李来好, 等. 改良离子色谱法测定咸鱼中亚硝酸盐的研究[J]. 南方水产科学, 2011, 7(6): 1-6.
[2] 吴燕燕, 刘法佳, 李来好, 等. GC-MS检测咸鱼中N-亚硝胺的条件优化[J]. 南方水产科学, 2012, 8(4): 16-22.
[3] JACOBSEN C, BRUNI L M, NIELSEN N S, et al. Antioxidant strategies for preventing oxidative flavour deterioration of foods enriched with n-3 polyunsaturated lipids: a comparative evaluation[J]. Trends in Food Science & Technology, 2008, 19: 76-93.
[4] CONTINI C, ALVAREZ R, O’ SULLIVANA M, et al. Effect of an active packaging with citrus extract on lipid oxidation and sensory quality of cooked turkey meat[J]. Meat Science, 2014, 96: 1171-1176.
[5] WILLIAMS G M, CALDWELL J, ARMSTRONG D, et al. Multicenter study to assess potential hazards from exposure to lipid peroxidation products in soya bean oil from Trilucent (TM) breast implants[J]. Regulatory Toxicology and Pharmacology, 2009, 53: 107-120.
[6] 王艳, 刘昌华, 章建浩, 等. 强化高温风干工艺对中式培根脂质分解氧化的影响[J]. 食品科学, 2013, 34(11): 77-82. doi: 10.7506/ spkx1002-6630-201311018.
[7] HUANG Yechuan, LI Hongjun, HUANG Tian, et al. Lipolysis and lipid oxidation during processing of Chinese traditional smoke-cured bacon[J]. Food Chemistry, 2014, 149: 31-39.
[8] 武华, 阴晓菲, 罗永康, 等. 腌制鳙鱼片在冷藏过程中品质变化规律的研究[J]. 南方水产科学, 2013, 9(4): 69-74.
[9] ANDERSEN E, ANDERSEN M L, BARON C P. Characterization of oxidative changes in salted herring (Clupea harengus) during ripening[J]. Journal of Agriculture and Food Chemistry, 2007, 55(23): 9545-9553.
[10] 陈胜军, 杨贤庆, 樊丽琴, 等. 蓝圆鲹在不同腌制条件下三甲胺和二甲胺含量变化规律[J]. 食品科学, 2012, 33(13): 58-61.
[11] 国家标准化管理委员会. GB/T 5009.37—2003 食用植物油卫生标准的分析方法[S]. 北京: 中国标准出版社, 2003.
[12] HASRET U. Evaluation of three 2-thiobarbituric acid methods for the measurement of lipid oxidation in various meats and m eat products[J]. Meat Science, 2004, 67: 683-687.
[13] FOLCH J, LEES M, SLOANE S G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1): 497-509.
[14] 丁丽丽. 咸鱼加工过程风味形成机理的研究[D]. 上海: 上海海洋大学, 2012: 62.
[15] DÍAZ P, LINARES M B, EGEA M, et al. TBARs distillation method: revision to minimize the interference from yellow pigments in meat products[J]. Meat Science, 2014, 98: 569-573.
[16]张永丝, 李汴生, 阮征, 等. 盐焗鸡翅在腌制过程中的脂肪氧化规律[J].食品与发酵工业, 2013, 39(10): 146-150.
[17] ANDRÉSA I, CAVA R, VENTANAS J, et al. Lipid oxidative changes throughout the ripening of dry-cured Iberian hams with different salt contents and processing conditions[J]. Food Chemistry, 2004, 84: 375-381.
[18] KANNER J, HARELl S, JAFFE R. Lipid peroxidation of muscle food as affected by sodium chloride[J]. Journal of Agriculture and Food Chemistry, 1991, 39(6): 1017-1021.
[19] 李来好, 丁丽丽, 吴燕燕, 等. 咸鱼中的挥发性风味成分[J]. 水产学报, 2012, 36(6): 979-988.
[20] 刘昌华, 章建浩, 王艳. 鲈鱼风干成熟过程中脂质分解氧化规律[J].食品科学, 2012, 33(5): 13-18.
[21] KARSTEN H, PIA L, LOTTE F, et al. Dynamic headspace gas chromatography-mass spectrometry characterization of volatiles produced in fi sh oil enriched mayonnaise during storage[J]. Journal of Agricultural and Food Chemistry, 2000, 48(10): 4858-4867.
[22] FUENTES V, ESTEVEZ M, VENTANAS J, et al, Impact of lipid content and composition on lipid oxidation and protein carbonylation in experimental fermented sausages[J]. Food Chemistry, 2014, 147: 70-77.
[23] KOLODZIEJSKA Y, SKONIECZNY S, RUBIN L J. Malonaldehydenitrite interactions in meat and model systems[J]. Journal of Food Science, 1990, 55: 925-928.
[24] 吴志强, 丘书院, 杨圣云, 等. 闽南-台湾浅滩渔场六种主要中上层鱼类的脂肪酸研究[J]. 水产学报, 2000, 24(1): 61-66.
[25] 陆廷龙, 姜大方. 白姑鱼的加工利用探讨[J]. 海洋渔业, 1988(6): 270-272.
[26] 安利华, 周小敏, 方旭波, 等. 白姑鱼鱼糜的化学组成及冻藏稳定性的研究[J]. 浙江海洋学院学报, 2011, 29(6): 551-556.
[27] 阚健全. 食品化学[M]. 北京: 中国农业大学出版社, 2005: 112-122.
[28] EYMARD S, BARON C P, JACOBSEN C. Oxidation of lipid and protein in horse mackerel (Trachurus trachurus) minceand washed minces during processing and storage[J]. Food Chemistry, 2009, 114: 57-65.
[29] 王永丽, 章建浩, 靳国锋, 等. 风干成熟工艺对风鸭脂质分解氧化影响的研究[J]. 食品科学, 2009, 30(14): 81-86.
[30] 王建辉, 刘永乐, 刘冬敏, 等. 冷藏期间草鱼鱼片脂肪氧化变化规律研究[J]. 食品科学, 2013, 34(6): 243-246.
Changes in Fatty Acids during Salting and Drying of White Croaker (Argyrosomus amoyensis)
CAI Qiuxing1,2,3, WU Yanyan2, LI Laihao2,*, YANG Xianqing2, ZHAO Yongqiang2, WANG Yueqi2
(1. College of Food Science and Engineering, Ocean University of China, Qingdao 266000, China;
2. National Research and Development Center for Aquatic Product Processing, Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 3. School of Food Engineering, Qinzhou University, Qinzhou 5350 99, China)
In this paper, the changes in fatty acids of white croaker (Argyrosomus amoyensis) during the salting and drying processes were analyzed by gas chromatography-mass spectrometry (GC-MS), and relevant indicators of lipid oxidation including peroxide value (POV) and thiobarbituric acid reactive substance (TBARS) were measured to reveal the relationship between the fatty acid composition and lipid oxidation. The results showed that white croaker contained 24 fatty acids including 26.41% saturated fatty acids (SFA), 20.26% monounsaturated fa tty acids (MUFA) and 53.33% polyunsaturated fatty acids (PUFA); 12.49% essential fatty acids; and eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) together accounting for 40.70% of the total fatty acids. During salting the content of SFA signifi cantly increased whereas those of MUFA and PUFA signifi cantly decreased (P < 0.05). Both POV and TBARS values increased fi rst and then decreased, showing their peaks on day 1 and day 3, respectively. Correlation analysis showed that the increase in SFA was negatively signifi cantly related to MUFA (P < 0.05), and was highly negatively related to PUFA (P < 0.01). However, there was no correlation between MUFA and PUFA; SFA was positively signifi cantly related to POV and TBARS (P < 0.05) whereas PUFA was negatively related to POV (P < 0.05) and highly negatively related to TBARS (P < 0.01). Thus, white croaker was rich in unsaturated fatty acids and the salting process had signifi cant infl uences on eight major fatty acids. MoreSFAs were produced in response to lipid peroxidation while signifi cantly decreasing the contents of MUFA and PUFA were sed. PUFA were more susceptible to lipid oxidation.
Argyrosomus amoyensis; salting; fatty acid; lipid oxidation
TS254.1
A
1002-6630(2015)12-0076-06
10.7506/spkx1002-6630-201512014
2014-11-24
国家自然科学基金面上项目(31371800);广东省海洋渔业科技推广专项(A201101F02;A201301C01);中国水产科学研究院基本科研业务费专项(2014C05XK01)
蔡秋杏(1981—),女,讲师,博士研究生,主要从事水产品加工与质量安全研究。E-mail:cindyqqcai@163.com
*通信作者:李来好(1963—),男,研究员,博士,主要从事水产品精深加工与质量安全研究。E-mail:laihaoli@163.com
