灯盏细辛合尼莫地平对谷氨酸所致神经元凋亡的影响*
2015-01-05刘新迎巫祖强李蓉林智勇梁佩玲董燕王培训
刘新迎巫祖强李 蓉林智勇梁佩玲董 燕王培训
(1.广东省佛山市南海区罗村医院,广东 佛山 528226;2.广州中医药大学,广东 广州510405)
·研究报告·
灯盏细辛合尼莫地平对谷氨酸所致神经元凋亡的影响*
刘新迎1巫祖强1李 蓉1林智勇1梁佩玲1董 燕2王培训2
(1.广东省佛山市南海区罗村医院,广东 佛山 528226;2.广州中医药大学,广东 广州510405)
目的观察灯盏细辛合尼莫地平对谷氨酸所致PC12细胞凋亡的影响。方法培养PC12细胞,并用谷氨酸诱导建立神经细胞损伤模型,用流式细胞仪观察尼莫地平以及灯盏细辛合尼莫地平共作用对PC12细胞凋亡的影响。结果尼莫地平10、20 μmol/L浓度组作用2 h和尼莫地平3个浓度组作用4 h对神经细胞凋亡均具有保护作用,灯盏细辛与尼莫地平3个浓度组合用,作用2 h和4 h对神经细胞凋亡均具有保护作用。结论尼莫地平对神经细胞凋亡的保护作用,具有时间和剂量依赖性,灯盏细辛与尼莫地平合用能有效减少和降低尼莫地平的用量和作用时间,达到神经细胞保护作用。
灯盏细辛 尼莫地平 谷氨酸 神经元凋亡
缺血性脑卒中占全部脑卒中的60%~85%[1],严重影响了患者的生存质量,带来了严重的经济负担。缺血性脑卒中级联损伤的“瀑布反应”是非线性和循环的,采用作用机制多样的神经保护剂,或联合作用于级联反应不同环节的几种神经保护剂,即神经保护剂鸡尾酒疗法可能是阻断脑缺血发病机制的一个合理方向。本研究拟通过建立谷氨酸诱导损伤的神经细胞损伤模型,探讨灯盏细辛合尼莫地平合用对神经元的保护作用。现报告如下。
1 材料与方法
1.1 材料 1)细胞株:高分化PC12细胞购自中国科学院昆明细胞库。2)药物与试剂:灯盏细辛注射液,云南生物谷药业股份有限公司,批号20130436。尼莫地平注射液,青岛金峰制药有限公司,批号13101101。高糖DMEM培养基(H-DMEM),Gibco公司产品。胎牛血清,海克隆公司产品。谷氨酸(Glu):Amresco公司产品。Annexin V-FITC细胞凋亡检测试剂盒:由南京凯基生物科技发展有限公司生产。完全培养液:含10%胎牛血清、100 IU/mL青霉素、100 IU/mL链霉素的HDMEM培养液。灯盏细辛培养液和尼莫地平培养液分别用不含胎牛血清的完全培养液稀释至相应浓度。3)主要仪器:MCO175型二氧化碳细胞培养箱 (日本SANYO公司产品);倒置显微镜(日本Olympus产品);流式细胞仪(型号为CYTOMICS FC500,日本BECKMAN COULTER产品)。
1.2 PC12细胞的培养 PC12细胞用完全培养基在37℃,5%CO2,饱和湿度的条件下培养,取处于对数生长期的细胞用于实验。
1.3 Glu诱导PC12细胞损伤模型的建立 将处于对数生长期的细胞按1×104个细胞/孔接种于96孔培养板中,待细胞完全融合后,磷酸盐缓冲液(PBS)轻轻荡洗两遍,加入含Glu无胎牛血清完全培养液,使Glu终浓度分别为0.1、0.5、1.0、5.0、10、20、30、50 mmol/L,每个剂量设3个平行孔,同时设未加药物的无血清培养液组作对照,在加药培养后的16 h时,以MTT法测定其增殖情况。
1.4 灯盏细辛对Glu诱导PC12细胞增殖的影响 将处于对数生长期的细胞接种于96孔培养板,待细胞完全融合后,随机分组,每组设3个平行孔,其中空白对照组和诱导损伤液组换用无血清完全培养液培养,灯盏细辛培养液组,加入终浓度分别为原液、1/4原液、1/16原液、1/64原液的灯盏细辛培养液培养4 h,然后除空白对照组外,其余各组均换用含上述筛选浓度的Glu诱导损伤液继续培养16 h,以MTT法测定其增殖情况。
1.5 尼莫地平对Glu诱导损伤PC12细胞凋亡的影响取出接种24孔培养板且铺满单层的PC12细胞,弃原培养基,用PBS荡洗1次,随机分为8组,每组设3个平行孔,其中空白对照组和诱导损伤液组换用无血清完全培养液培养,尼莫地平培养液组加入终浓度分别为20、10、5 μmol/L尼莫地平培养液,分别作用2 h和4 h,除空白对照组外,其余各组均换用含上述筛选浓度的Glu诱导损伤液继续培养16 h,弃培养液,PBS洗涤,0.25%胰酶消化,完全培养液终止,1000 r/min离心5 min,弃上清,按照Annexin V-FITC试剂盒说明操作,上流式细胞仪分析各组细胞凋亡情况。
1.6 灯盏细辛与尼莫地平合用对Glu诱导损伤PC12细胞凋亡影响 取出接种24孔培养板且铺满单层的PC12细胞,弃原培养基,用PBS荡洗1次,随机分为8组,每组设3个平行孔,其中空白对照组和诱导损伤液组换用无血清完全培养液培养,灯盏细辛与尼莫地平合用组,分别加入含灯盏细辛(通过以上实验筛选出的灯盏细辛最佳剂量组)与尼莫地平高、中、低药液的无血清完全培养液,其中3组先加灯盏细辛培养液作用2 h后,再加入不同剂量的尼莫地平培养液再共同作用2 h;另3组为灯盏细辛与不同剂量的尼莫地平培养液共同作用4 h后,除正常对照组外,其余各组均换用含上述筛选浓度的Glu诱导损伤液继续培养16 h,处理同前,上流式细胞仪分析各组细胞凋亡情况。
1.7 统计学处理 采用SPSS11.0统计软件分析。计量资料以(±s)表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Glu诱导PC12细胞损伤模型的建立 见表1。含0.1~5 mmol/L Glu对PC12细胞增殖无明显影响,而10~50 mmol/L Glu对PC12细胞增殖有明显抑制作用,因此,本研究拟选用10 mmol/L Glu作为造模浓度。
表1 各组PC12细胞增殖的比较(±s)
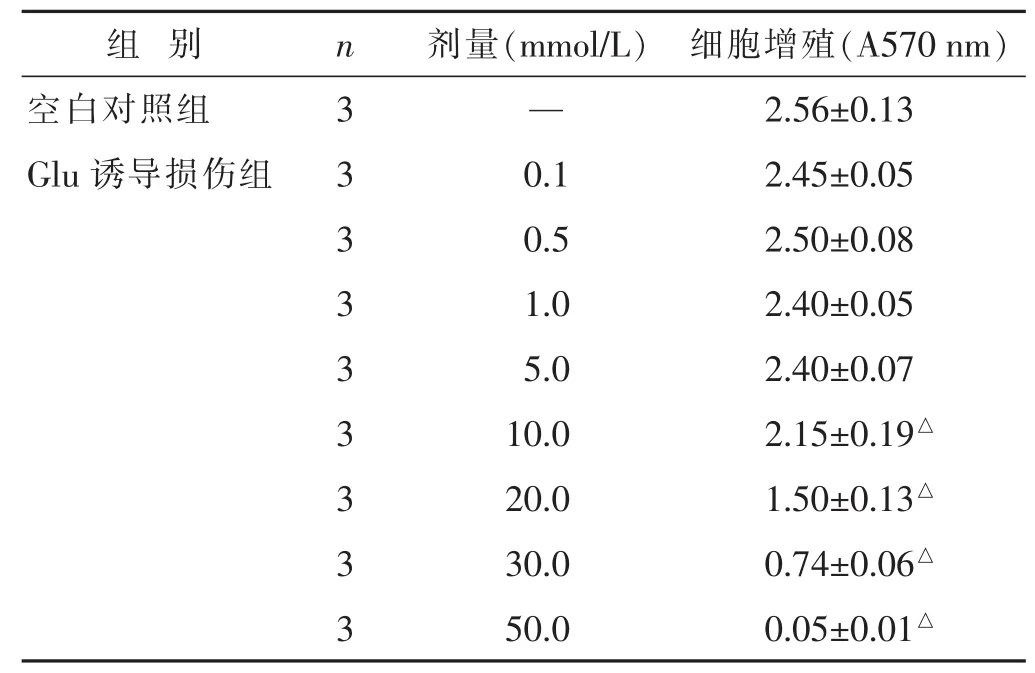
表1 各组PC12细胞增殖的比较(±s)
与空白对照组比较,△P<0.01。
组 别 n 剂量(m m o l / L) 细胞增殖(A 5 7 0 n m)空白对照组 3 — 2 . 5 6 ± 0 . 1 3 G l u诱导损伤组 3 0 . 1 2 . 4 5 ± 0 . 0 5 3 0 . 5 2 . 5 0 ± 0 . 0 8 3 1 . 0 2 . 4 0 ± 0 . 0 5 3 5 . 0 2 . 4 0 ± 0 . 0 7 3 1 0 . 0 2 . 1 5 ± 0 . 1 9△3 2 0 . 0 1 . 5 0 ± 0 . 1 3△3 3 0 . 0 0 . 7 4 ± 0 . 0 6△3 5 0 . 0 0 . 0 5 ± 0 . 0 1△
2.2 灯盏细辛对Glu诱导PC12细胞增殖的影响 见表2。灯盏细辛1/4原液,1/16原液组能明显促进Glu损伤的PC12细胞增殖,与诱导损伤组比较有显著差异有统计学意义(P<0.05或P<0.01);原液组和1/64原液组与诱导损伤组差异无统计学意义(P>0.05)。
表2 各组Glu损伤PC12细胞增殖的比较(±s)

表2 各组Glu损伤PC12细胞增殖的比较(±s)
与诱导损伤组比较,*P<0.05,**P<0.01;与空白对照组比较,△P<0.05,△△P<0.01。下同。
组 别 n 剂量(m m o l / L) 细胞增殖(A 5 7 0 n m)空白对照组 3 — 2 . 5 6 ± 0 . 1 3 G l u诱导损伤组 3 — 2 . 1 5 ± 0 . 1 9灯盏细辛组 3 原液 2 . 2 2 ± 1 . 9 5△△3 1 / 4原液 2 . 4 9 ± 0 . 1 0**3 1 / 1 6原液 2 . 6 9 ± 0 . 0 8**3 1 / 6 4原液 2 . 2 8 ± 0 . 1 3△
表3 各组Glu损伤PC12细胞凋亡的比较(±s)
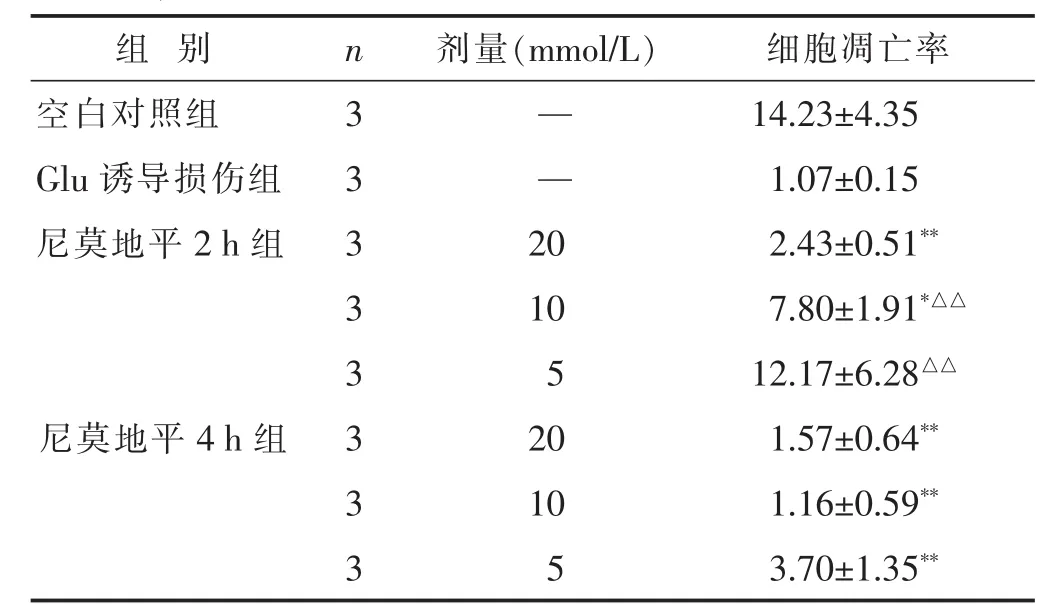
表3 各组Glu损伤PC12细胞凋亡的比较(±s)
组 别 n 剂量(m m o l / L) 细胞凋亡率空白对照组 3 — 1 4 . 2 3 ± 4 . 3 5 G l u诱导损伤组 3 — 1 . 0 7 ± 0 . 1 5尼莫地平2 h组 3 2 0 2 . 4 3 ± 0 . 5 1**3 1 0 7 . 8 0 ± 1 . 9 1*△△3 5 1 2 . 1 7 ± 6 . 2 8△△尼莫地平4 h组 3 2 0 1 . 5 7 ± 0 . 6 4**3 1 0 1 . 1 6 ± 0 . 5 9**3 5 3 . 7 0 ± 1 . 3 5**
2.3 尼莫地平对Glu诱导损伤PC12细胞凋亡的影响见表3。尼莫地平20 mol/L浓度组作用2 h,尼莫地平3个浓度组作用4 h,均能明显抑制Glu诱导损伤的PC12细胞凋亡,与诱导损伤组比较差异有统计学意义(P<0.05或P<0.01),提示尼莫地平对Glu诱导损伤PC12细胞凋亡的抑制作用成时间和剂量依赖性,剂量越大,作用时间越长,效果越明显。
2.4 灯盏细辛与尼莫地平合用对Glu诱导损伤PC12细胞凋亡影响 见表4。灯盏细辛原液/4与尼莫地平3个浓度组合用,无论作用2 h还是4 h,均能明显抑制Glu诱导损伤的PC12细胞凋亡,与诱导损伤组比较差异有统计学意义(P<0.05或P<0.01),提示灯盏细辛可以增强尼莫地平的神经细胞保护作用。
表4 各组Glu损伤PC12细胞凋亡的比较(±s)
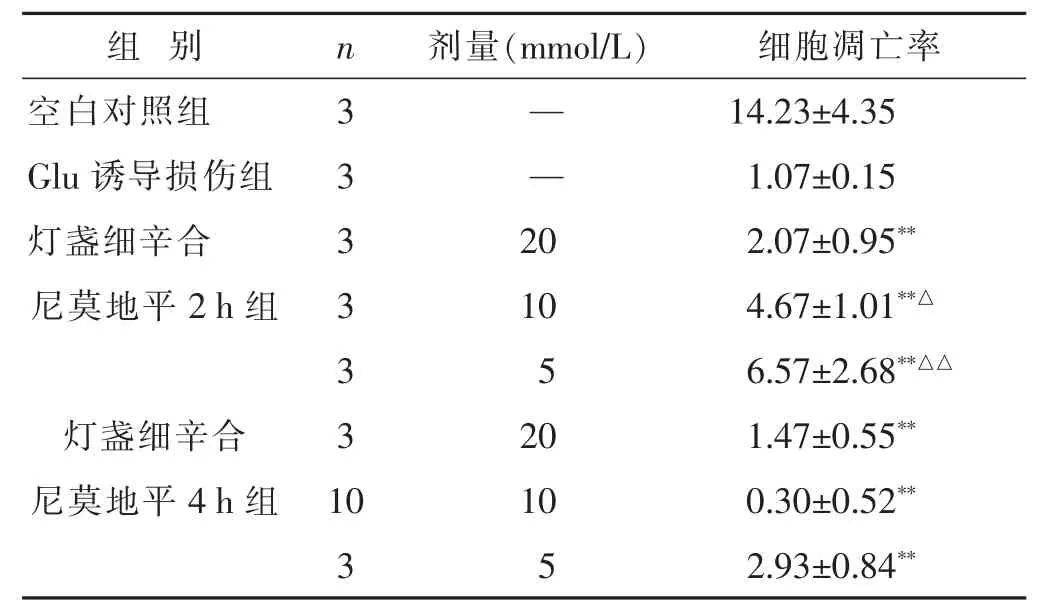
表4 各组Glu损伤PC12细胞凋亡的比较(±s)
组 别 n 剂量(m m o l / L) 细胞凋亡率空白对照组 3 — 1 4 . 2 3 ± 4 . 3 5 G l u诱导损伤组 3 — 1 . 0 7 ± 0 . 1 5灯盏细辛合 3 2 0 2 . 0 7 ± 0 . 9 5**尼莫地平2 h组 3 1 0 4 . 6 7 ± 1 . 0 1**△3 5 6 . 5 7 ± 2 . 6 8**△△灯盏细辛合 3 2 0 1 . 4 7 ± 0 . 5 5**尼莫地平4 h组 1 0 1 0 0 . 3 0 ± 0 . 5 2**3 5 2 . 9 3 ± 0 . 8 4**
3 讨 论
脑缺血是一个复杂的病理级联反应机制,其核心问题是神经元损害引起的神经功能障碍,脑缺血后神经细胞并不会立即死亡,而是神经细胞的凋亡[2]是一渐进的过程,这就为神经保护治疗带来了机会[3]。
目前,虽然神经保护剂的研究取得了长足进步,但是几乎所有的神经保护剂临床均无效或效果很差,或因严重副作用,限制了临床应用[4],因此,进一步研究新的神经保护剂或寻求新的神经保护方法成为研究的重点。缺血性脑卒中级联损伤的“瀑布反应”是非线性和循环的,采用作用机制多样的神经保护剂,或联合作用于级联反应不同环节的几种神经保护剂,即神经保护剂鸡尾酒疗法[5]也得到越来越多的关注。尼莫地平是二氢吡啶类(DHPs)钙离子拮抗剂,具有脂溶性,易于穿透血脑屏障(blood-brain barrier),并具有选择性扩张脑血管作用及神经和精神药理活性,实验证实尼莫地平具有明显的细胞保护效应[6],但由于其选择性不高、系统性血压降低等副作用,限制了其临床应用。
灯盏细辛来源于菊科飞蓬属植物短草飞蓬,始载于《滇南本草》,其记载有“左瘫右痪,水煎点水酒服”。研究显示[7-9],灯盏细辛能改善脑缺血患者的脑血液循环,减轻脑组织缺血性损伤,增加脑血流量,使梗死灶的血供恢复;而申亮等[10]研究显示灯盏细辛具有较强的清除自由基作用;张静等[11]研究显示,灯盏细辛能促进大鼠大脑皮层神经元细胞的存活而达到脑保护的作用;大量现代药理研究均证实,它能扩张微细血管改善微循环,降低血液黏稠度,清除氧自由基,抗炎、对抗脂质过氧化及缺血再灌注等广泛的药理作用。而其与尼莫地平合用对脑缺血患者的脑保护作用,研究甚少。
本研究结果显示,灯盏细辛1/4原液、1/16原液组对体外建立的神经细胞损伤模型具有明显的保护作用,尼莫地平单药对体外建立的神经细胞损伤模型也具有保护作用,且成时间和剂量依赖性,剂量越大,作用时间越长,效果越明显。将灯盏细辛与尼莫地平合用,探讨其共作用对体外建立的神经细胞损伤模型研究发现,灯盏细辛可以增强尼莫地平的神经细胞保护作用,能有效减少和降低尼莫地平的用量和作用时间,达到神经细胞保护作用。这也表明鸡尾酒疗法有助于神经细胞的保护性治疗,也进一步提示我们临床上二药合用,有助于缺血性脑卒中的治疗,但是二者合用的作用机制,有待于进一步探索。
[1] 王拥军.脑卒中神经保护剂治疗的研究进展[J].中国医疗前沿,2007,(5):85-88.
[2] Ferrer I,Planas AM.Signaling of cell death and cell survival following focal cerebral ischemia:life and death struggle in the penumbra[J].J Neuropathol Exp Neurol,2003,62(4):328-329.
[3] 于永发,董国淑.脑梗死治疗时间窗的差异与个体化研究进展[J].国外医学:脑血管疾病分册,2002,10(3):181-184.
[4] 卞永禄,沈达涛,吴炳泉.缺血性脑卒中神经保护剂联合治疗的研究进展[J].中国医药导报,2007,4(27):6-7.
[5] Liniger R,Popovic R,Sullivan B,et al.Effects of neuroprotective cocktails on hippocampal neuron death in an in vitro model of cerebral ischemia[J].J Neurosurg Anesthesiol,2001,13(1):19-25.
[6] 席刚明,魏国耀,何国厚,等.小鼠局灶性脑缺血后细胞凋亡及尼莫地平的影响[J].卒中与神经疾病,2005,12(3):164-166.
[7] 巫祖强,粟漩,刘吉昌.灯盏细辛注射液对血瘀型急性脑梗死患者VEGF及sICAM-1的影响[J].中西医结合心脑血管病杂志,2009,7(6):658-660.
[8] 吴大鸿,刘晓娟,曾鸿.灯盏细辛注射液对脑梗死患者的疗效及血液流变学的影响[J].广东医学,2006,27(7):1088-1089.
[9] 李风君,赵春芬,孙广斌.灯盏细辛注射液治疗脑梗死疗效观察[J].实用中医药杂志,2006,(22)10:610-611.
[10]申亮,纪洪芳,柴建国.对九种天然产物清除自由基活性的理论评价[J].生物物理学报,2005,21(5):332-338.
[11]张静,盛艳梅,张艺.灯盏细辛注射液对大鼠大脑皮层神经元细胞存活率的影响[J].中药药理与临床,2007,23(5):135-136.
Objective:To investigate the effects of Erigeron breviscapus and nimodipine on neurons apoptosis of PC12 cell induced by glutamate.Methods:PC12 cells were cultured,using glutamate to intervention,then with flow cytometry to detect the effects of apoptosis by Erigeron breviscapus and nimodipine.Results:10,20 μmol/L dose group in 2 h and three dose group in 4 h of Nimodipine can inhibit the apoptosis of PC12 cells obviously. Erigeron breviscapus and nimodipine with different dose in 2 h and 4 h can inhibit the apoptosis of PC12 cells obviously.Conclusion:Nimodipine can inhibit the apoptosis of PC12 cells on time and is dose dependent. Erigeron breviscapus and nimodipine can inhibit the apoptosis of PC12 cells obviously.Erigeron breviscapus can induce the time and dose of nimodipine.
Erigeron breviscapus;Nimodipine;Glutamate;Neurons apoptosis
R285.6
A
1004-745X(2015)08-1367-03
10.3969/j.issn.1004-745X.2015.08.020
2015-02-18)
广东省佛山市医学类科技攻关项目(No.201308179)
To Investigate the Protective Effects of Erigeron Breviscapus and Nimodipine on Neurons Damage In-duced by Glutamate
LIU Xinying,WU Zuqiang,LI Rong,et al. Luocun Hospital of Nanhai Foshan,Guangdong,Foshan 528226,China
