基于呼吸代谢系统动态监测慢性心衰(心阳虚证)大鼠模型的建立及评价*
2015-01-05侯衍豹尹翠翠2高敏杨
侯衍豹尹翠翠,2高 敏杨 勇,3△容 蓉
(1.山东中医药大学,山东 济南 250355;2.山东省泰安肿瘤防治院,山东 泰安 271000;3.山东省经方研究重点实验室,山东 济南 250355)
·研究报告·
基于呼吸代谢系统动态监测慢性心衰(心阳虚证)大鼠模型的建立及评价*
侯衍豹1尹翠翠1,2高 敏1杨 勇1,3△容 蓉1
(1.山东中医药大学,山东 济南 250355;2.山东省泰安肿瘤防治院,山东 泰安 271000;3.山东省经方研究重点实验室,山东 济南 250355)
目的参考心阳虚慢性心衰的临床表现,通过前期结扎冠状动脉左前降支,后期给予一氧化氮合酶抑制剂(左旋硝基精氨酸)建立大鼠慢性心衰(心阳虚证)模型并给予评价。方法Wistar大鼠按体质量随机分为假手术组、心阳虚慢性心衰模型组。冠脉结扎术后4周后,给予左旋硝基精氨酸(LNNA)4周致心衰发展模型,假手术组穿线不结扎。实验过程中采用无创的呼吸代谢系统动态监测大鼠的呼吸代谢、能量代谢变化情况作为模型评价的依据;最后采用血流动力学检测大鼠的心功能并及时记录造模过程中大鼠的死亡情况,外观体征、精神状况、饮食、排泄及水肿等状况。结果心阳虚慢性心衰模型组与假手术组比较,除第2周呼吸代谢及能量代谢较冠脉结扎初始增强明显外,第6周到第8周呼吸代谢及能量代谢明显减弱(P<0.01);模型组大鼠心率(HR)、左室舒张末期压(LVEDP)、左心室舒张所用时间(Tau)呈上升趋势(P<0.05);左室内压变化最大速率(±dp/dtmax)均呈降低趋势(P<0.01)。结论前期结扎冠状动脉左前降支,后期给予一氧化氮合酶抑制剂(左旋硝基精氨酸),通过采用呼吸代谢系统可以动态监测模型动物的状态和生理机能情况,可准确判断出模型出现的时间窗,从而为慢性心衰(心阳虚证)模型建立提供一种客观、无创的判断方法。
心阳虚 慢性心衰 呼吸代谢 能量代谢 血流动力学
慢性心衰是一种严重的临床综合病,是心血管疾病最大的死因,其危害性已引起社会各界的广泛关注。临床上心衰后期以心肾阳虚、阳气虚脱、血瘀痰凝水泛为主,严重威胁人类生命。近年来,中医对心衰的病症、病机及实验与临床的研究越来越重视,医学界对慢性心衰的治疗也取得较大进展。但是慢性心衰的发病仍呈现逐年上升趋势,慢性心衰的防治意义重大。现有的慢性心衰(心阳虚证)动物模型造模方法虽然有多种方法[1]、但因为该模型复制的周期长、死亡率高、多因素造模,造成不同研究者之间模型复制差别很大;而且作为模型建立的重要因素--造模周期,常常是根据研究者的主观判断,或采用盲杀部分动物的方法来断定。这就会造成模型复制重现性低,难以确定合适的造模时间窗口,并且也很难较好地体现阳虚的特点。因此,采用一种无创的监测手段来建立与临床病症相符的动物模型,对于探索慢性心衰(心阳虚证)的发病机制、病理改变及开发新的治疗药物及治疗手段均具有重大意义。本研究根据慢性心衰(心阳虚证)的临床表现,实验过程中采用无创的呼吸代谢系统动态监测大鼠的呼吸代谢、能量代谢变化情况,通过前期结扎冠状动脉左前降支,后期给予一氧化氮合酶抑制剂(左旋硝基精氨酸)的复合方法建立慢性心衰(心阳虚证)大鼠模型并给予评价。先报告如下。
1 材料与方法
1.1 实验动物 Wistar大鼠,SPF级,雄性,22只,体质量200~250 g,由山东鲁抗动物实验中心提供,动物可证编号:SCXK(鲁)20080002。饲养环境:室温22~26℃,相对湿度40%~70%RH。
1.2 实验仪器 BL-420E生物机能实验系统 (型号BL-420E,成都泰盟科技有限公司);小动物人工呼吸机 (DW3000-B,淮北正华生物仪器设备有限公司);TSE LabMaster System(LabMaster-CaloSys德国TSE公司);MPVS UltraTM压力-容积分析系统 (澳大利亚powerlab公司);Millar压力容积导管SPR-838(美国Millar公司)。
1.3 实验试剂 左旋硝基精氨酸 (购自Sigma公司,批号:101278121);4%水合氯醛;注射用青霉素钠(批号:B130316,山东鲁抗医药股份有限公司);0.9%氯化钠注射液。
1.4 分组及造模 Wistar大鼠22只,按体质量随机分为假手术组10只、心阳虚慢性心衰模型组12只。用4%水合氯醛按照大鼠体质量0.8 mL/100 g腹腔麻醉后,仰位固定,心电图机以标准Ⅱ导联监测动物心电图。气管插管,行人工呼吸(呼吸频率70次/min,潮气量7 mL,呼吸比设为1∶2)。于大鼠左前胸去毛,消毒,沿左锁骨中线纵行切开皮肤1~2 cm,在第4或5肋间钝性分离肌层,打开胸腔,剪开心包,暴露心肌,用棉签拨起左心耳,在左心耳下缘与肺动脉圆锥间以左冠状静脉主干为标志,用圆形无创缝合针6/0丝线置于左冠状动脉前降支起始部下2 mm处结扎,进针深度约为1.5 mm,宽度约为2~3 mm。记录标准Ⅱ导联心电图,以ST段弓背向上抬高0.1 mv作为结扎成功的标志(无ST段及T波改变者淘汰)。假手术组穿线不结扎,清除胸腔内积血并用去针头注射器抽吸气体后逐层缝合、关闭胸腔缝合胸壁,待动物苏醒后拔除气管插管恢复自主呼吸。青霉素40万单位加0.9%氯化钠注射液0.9 mL(共1 mL)腹腔注射,连续3 d,预防感染。结扎成功后大鼠正常喂养4周后,于术后第5周开始模型组大鼠以按体质量0.5 mL/100 g灌胃20 mg/mL的左旋硝基精氨酸(L-NNA)4周。假手术组大鼠灌胃同等体积的0.9%氯化钠注射液。
1.5 检测指标及方法 1)各实验组大鼠死亡情况及外观表现。实验过程中及时记录各实验组造模过程中死亡情况,外观体征(诸如神疲、乏力、四肢欠温、畏寒肢冷等一系列虚寒的外在表现)、精神状况(诸如行为、运动、呼吸等表现)、饮食、排泄及水肿等症状等状况。2)心阳虚慢性心衰大鼠呼吸代谢转换率及产热率[2]。冠状动脉结扎手术后,随机选取假手术组、模型组大鼠各6只分别于冠脉结扎初始的第1日、以后每隔2周进行呼吸代谢的检测。首先应对TSE-System参照笼进行标准气体的校正,冠脉结扎后大鼠放在TSE-System呼吸代谢系统的检测笼内,每个检测笼每次放1只,每次测试前及测试后应打开门窗以保证室内空气的新鲜,相对湿度应控制在70%以内,室温控制在20~25℃,测试前需先准确记录大鼠体质量,流速持续控制在1.20 L/min,根据测试笼内气体交换达到平衡稳定的时间设定数据每10 min采集1次,每组连续监测20 h,设定好参数后即可进行检测。每次需测试的大鼠均应提前30 min放入代谢笼中,以让大鼠充分适应检测环境并达到检测系统最佳循环及平衡状态。测定两组的呼吸转换率 (RER)(RER=VCO2/VO2,其中VCO2、VO2分别是指单位时间内以参比笼作参照,测试笼产生的二氧化碳的量及消耗氧气的量)以及产生的热量H1[kcal/(h·kg)]和H2[kcal/(h·kg)],H1、H2根据LBM方程H=(CVO2×VO2+CVCO2×VCO2)/1000计算[3]。H1是根据动物的实际体质量进行计算;H2是根据动物的瘦体质量 (即按动物脂肪占体质量比例除去动物脂肪以外的体质量)进行计算,两者均是反映机体产热量的指标。3)MPVS UltraTM压力-容积系统检测各组大鼠血流动力学指标。将压力容积导管浸泡在37℃0.9%氯化钠注射液中30 min,MPVS UltraTM压力-容积测定仪与Millar压力容积导管SPR-838正确连接后,对压力、容积信号进行定标和信号的转换。大鼠麻醉后背位固定,切开颈部皮肤,钝性分离皮下组织及肌肉,玻璃探针分离右侧颈动脉,在动脉上穿线两条,一条结扎远心端,动脉夹夹住近心端,1 mL注射器针头针尖处弯成钩状,在动脉壁上穿洞并勾起动脉壁,以辅助压力容积导管沿颈总动脉逆行插入左心室,当导管的尖端(电极部分)完全插入颈动脉时,应快速结扎开口下端,避免大鼠失血过多影响监测结果,插管过程中随时关注P-V Loop环,当出现规则的P-V Loop环时,表明导管已进入左心室,固定插管,对心脏功能进行检测。血流动力学指标:左室收缩压(LVSP)、左室舒张末期压(LVEDP)、左室等容收缩期压力上升最速率(+dp/dtmax)及反映左室舒张功能的指标:左心室舒张所用时间(Tau)、左室舒张期压力下降最大速率(-dp/dtmax)。
1.6 统计学处理 采用SPSS17.0统计软件。计量资料以(±s)表示,采用Fisher确切概率法进行组间差异分析,t检验用于两组间差异分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组大鼠死亡率比较 假手术组自实验初始至结束均无死亡,模型组死亡6只,死亡率为50.00%,两组差异有统计学意义(P<0.01)。
2.2 大鼠外观表现 假手术组大鼠眼睛红润、呼吸均匀、毛发较光泽顺贴多;精神正常、活泼好动;体温稳定、体质量逐渐增加;饮食、排泄正常;抓取时反抗剧烈。模型组大鼠面部、耳部及四肢浮肿、唇舌紫暗;眼周及鼻腔充血;心悸气短、呼吸短促、气喘痰鸣;毛发疏松倒竖,无光泽,枯黄或微红精神萎靡;眼眯不欲睁开、缩肩拱背、喜扎堆蜷缩;行动迟缓肢冷、体寒尾凉;体质量减轻饮食、进水量减少;部分出现大便稀溏;抓取时反抗较轻。
2.3 两组大鼠RER及产热量(H1、H2)的动态比较见表1~表3,图1~图3。假手术组RER随着时间延长表现出逐渐增强趋势,H1、H2除第6周时略有减弱外,其趋势同RER值表现一致。与假手术组比较,模型组在第2周时RER、H1、H2较冠脉结扎初始增强明显,随着时间的增长RER值第8周显著性降低,H1、H2值第6周开始直到第8周都显著降低(P<0.01)。
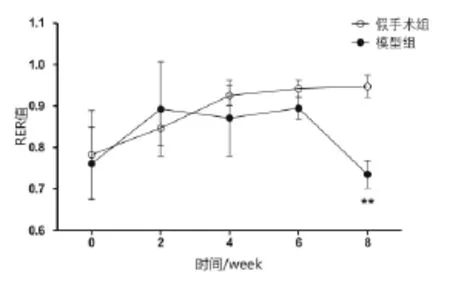
图1 心阳虚慢性心衰大鼠RER值随时间变化
表1 两组RER值随时间变化的对比分析(±s)

表1 两组RER值随时间变化的对比分析(±s)
与模型组比较,**P<0.01。
组别n 第4周 第6周 第8周假手术组 1 0 0 . 9 2 5 ± 0 . 0 2 4 0 . 9 4 2 ± 0 . 0 2 1 0 . 9 4 7 ± 0 . 0 2 7**模型组 1 2 0 . 8 7 1 ± 0 . 0 9 2 0 . 8 9 4 ± 0 . 0 2 7 0 . 7 3 5 ± 0 . 0 3 3第0周 第2周0 . 7 8 3 ± 0 . 1 0 7 0 . 8 4 7 ± 0 . 0 4 2 0 . 7 6 1 ± 0 . 0 8 7 0 . 8 9 3 ± 0 . 1 1 4
表2 两组随时间变化H1的对比分析[kcal/(h·kg),±s]

表2 两组随时间变化H1的对比分析[kcal/(h·kg),±s]
组别n 第4周 第6周 第8周假手术组 1 0 1 1 8 4 . 6 ± 1 9 2 . 7 1 0 2 7 . 9 ± 4 5 . 9**1 0 9 2 . 3 ± 2 1 8 . 6**模型组 1 2 9 7 9 . 6 ± 2 2 0 . 2 8 2 3 . 3 ± 6 3 . 9 6 8 1 . 8 ± 1 1 6 . 1第0周 第2周9 6 0 . 1 ± 1 7 1 . 6 1 0 8 9 . 5 ± 1 8 9 . 6 8 1 6 . 7 ± 1 0 0 . 6 1 3 7 3 . 6 ± 3 2 0 . 7
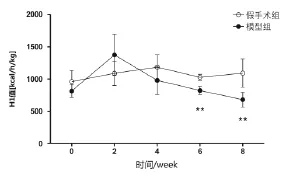
图2 慢性心衰大鼠H1值随时间变化
表3 两组随时间变化H2的对比分析[kcal/(h·kg),±s]

表3 两组随时间变化H2的对比分析[kcal/(h·kg),±s]
组别n 第4周 第6周 第8周假手术组 1 0 9 2 3 . 9 ± 1 4 7 . 5 8 2 6 . 2 ± 4 2 . 3**8 7 3 . 3 ± 1 9 5 . 6**模型组 1 2 7 6 8 . 1 ± 1 8 7 . 8 6 3 1 . 1 ± 6 0 . 9 5 1 1 . 2 ± 8 1 . 3第0周 第2周6 5 8 . 4 ± 1 2 9 . 7 7 6 6 . 4 ± 1 3 8 . 8 5 6 8 . 4 ± 8 6 . 8 1 0 0 0 . 1 ± 2 3 8 . 9
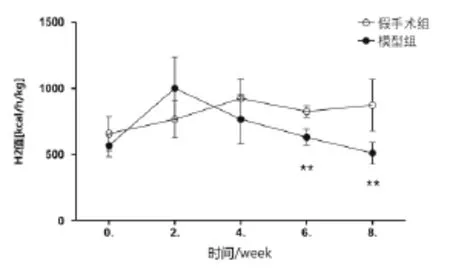
图3 慢性心衰大鼠H2值随时间变化
2.3 两组心阳虚慢性心衰大鼠血流动力学检测比较见表4。与假手术组比较,模型组大鼠心率(HR)、LVEDP、Tau呈上升趋势,差异具有显著性(P<0.05);左室内压上升、下降最大速率均呈降低趋势(P<0.05)
表4 两组慢性心衰大鼠心功能的影响比较(±s)
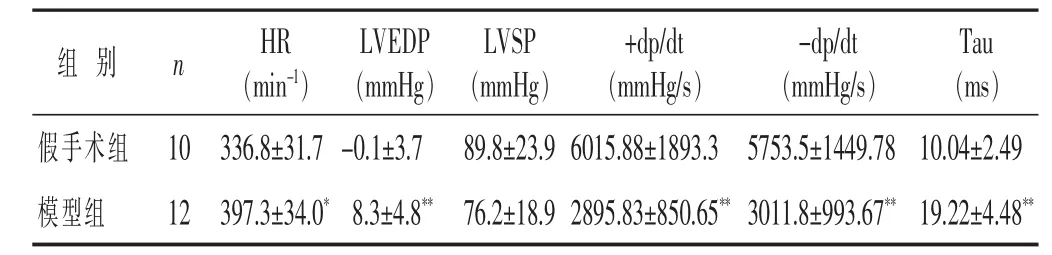
表4 两组慢性心衰大鼠心功能的影响比较(±s)
与假手术组比较,*P<0.05,**P<0.01。
+ d p / d t(m m H g / s)假手术组 1 0 8 9 . 8 ± 2 3 . 9 6 0 1 5 . 8 8 ± 1 8 9 3 . 3模型组 1 2 7 6 . 2 ± 1 8 . 9 2 8 9 5 . 8 3 ± 8 5 0 . 6 5**组别n L V S P(m m H g)L V E D P(m m H g)3 3 6 . 8 ± 3 1 . 7 -0 . 1 ± 3 . 7 3 9 7 . 3 ± 3 4 . 0*8 . 3 ± 4 . 8**H R(m i n-1)T a u(m s)5 7 5 3 . 5 ± 1 4 4 9 . 7 8 1 0 . 0 4 ± 2 . 4 9 3 0 1 1 . 8 ± 9 9 3 . 6 7**1 9 . 2 2 ± 4 . 4 8**-d p / d t(m m H g / s)
3 讨 论
近年来中医病证结合动物模型的研究进展显示,目前就慢性心衰(心阳虚证)动物的造模文献数量及规范化程度的整体水平偏低,归纳总结主要的制备方法有腹主动脉结扎结合寒冷刺激、冠脉结扎结合一氧化氮合酶抑制剂、及腹腔注射阿霉素[4-6],研究表明这些方法基本符合中医学阳虚心衰的病证,但是存在动物造模周期长、模型损伤比较大、模型出现时间节点不好判断等问题。本实验心阳虚证的制备是在左冠状动脉前降支结扎制备心力衰竭心气虚模型的基础上,给予模型大鼠一氧化氮合酶抑制剂(LNNA),使大鼠血压升高,心脏后负荷增加,心功能恶化致心衰的进一步发展,心气虚证加剧,在症状、体征逐渐表现出心阳虚特点,采用这种方法制备的心阳虚慢性心衰模型,将更加符合临床病证特点。
研究表明[7-8],轻度缺血时,心肌的能量并没有明显变化或稍有增强,这是因为心衰早期,心脏会有一种有效的代偿性反应,可增加心脏的收缩力,使心脏得以维持正常的血液循环,但在心衰后期,这种代偿性反应将构成心肌肥厚,肥厚的心肌使心肌耗氧增加,而动脉供血不足使肥大的心肌出现心肌缺血、缺氧,最终构成心肌细胞凋亡,心肌组织纤维化。本实验通过TSE呼吸代谢系统按照一定的时间间隔即从冠脉结扎初期,经过心衰早期发展至心衰后期,检测假手术组与模型组大鼠22 h内呼吸代谢转化率RER及能量代谢的动态变化H1、H2,通过对比假手术与模型组大鼠在相同时间间期下,其呼吸代谢及产热量的对比分析,实时监测心阳虚慢性心衰的发展,其结果显示,假手术组随着时间的延长,体质量呈现均匀增长趋势,其呼吸代谢转化率及产热量呈平稳增长趋势。模型组大鼠在冠脉结扎2周时,RER值、H1、H2均较假手术组高,随着时间延长至第4周,模型组大鼠RER值、H1值、H2值呈平稳下降趋势。结合造模过程中动物外观表现、死亡率等指标,可以较好的判断研究的干预点。
实验后期通过压力容积检测系统评价各组大鼠心功能。心衰的早期主要是心脏负荷的过重,心脏为满足机体的需要表现为心室或心房代偿性的扩张或心室壁的肥厚,随着病情的加重导致心室重塑,出现心脏病理结构的改变及心脏功能的下降。由于心脏收缩之前回心血量的增加,使心脏在收缩时需要较大的张力,当心肌纤维拉长到一定范围时,心脏的收缩力下降。±dp/dtmax和LVSP均是反映左心室心肌的收缩能力的指标,因此心衰发生时,会出现±dp/dtmax、LVSP的下降,此时,心脏为满足机体需要主要通过增加心脏舒张末期左心室容量代偿完成,导致左心室舒张末期压力的增大,LVEDP、Tau是反映左心室舒张功能的指标,因此心衰时会出现LVEDP的升高,Tau时间的延长。本研究数据结果显示与假手术组比较心阳虚慢性心衰模型组大鼠HR、LVEDP及Tau显著性升高;±dp/dtmax及LVSP下降符合心阳虚慢性心衰心功能变化特点。
本研究通过前期结扎冠状动脉左前降支,后期给予一氧化氮合酶抑制剂(左旋硝基精氨酸),采用无创的呼吸代谢系统动态监测大鼠的呼吸代谢、能量代谢变化情况来判断模型状态,建立大鼠心阳虚慢性心衰模型并通过全面检测大鼠的呼吸代谢能量代谢及血流动力学等指标从宏观上对各组大鼠机体表现进行综合评价做为心阳虚慢性心衰模型的重要评价标准,弥补了传统心衰模型建立实验当中,对模型成功及造模周期难以把握的不足,为更客观有效地评价动物模型提供了一种新的手段和方法。
(作者声明:侯衍豹与尹翠翠并列第一作者)
[1] 陈新宇,蔡虎志,余洪,等.慢性心衰心阳虚型病证动物模型的研究进展与评析[J].中医药导报,2011,11(8):108-109.
[2] 李静,杨勇,尹翠翠,等.肾阳虚小鼠模型呼吸代谢转化率、产热量指标的实验研究[J].山东中医药大学学报,2013,37(2):148-150.
[3] Vrang N,Madsen AN,Tang-Christensen M,et al.PYY(3-36)reduces food intake and body weight and improves insulin sensitivity in rodent models of diet-induced obesity[J].Am J Physiol Regul Integr Comp Physiol,2006,291(2):R367-375.
[4] 王大伟,杨喆,严夏.温阳救心方对阳虚型慢性心衰大鼠心功能的影响[J].中药新药与临床药理,2011,22(4):410-413.
[5] 王硕仁,赵明镜,王振涛,等.建立心肌梗死心气虚血瘀证和心阳虚血瘀证病证动物模型的研究[J].中国中西医结合杂志,2008,28(3):245-248.
[6] 张友计,雷蕾,李华,等.心力衰竭心阳虚证大鼠与心钠素的相关性研究[J].泸州医学院学报,2008,31(5):508-511.
[7] Catalucci,D.M.V.Latronico,O.Ellingsen,et al.Physiological myocardial hypertrophy:how and why[J].Front Biosci,2008,13(6):312-24.
[8] 吴俊标.环维黄杨星D对心肌肥厚的影响及其作用机制[D].广州:广州中医药大学,2012.
The Dynamic Monitoring on the Establishment and Evaluation of Rat Model of Chronic Heart Failure with Heart Yang Deficiency Based on Respiratory Metabolism System
HOU Yanbao,YIN Cuicui,YANG Yong,et al.Shandong University of TCM,Shandong,Jinan 250355,China
Objective:To establish and evaluate rat model of chronic heart failure with heart yang deficiency,according to the clinical manifestations of chronic heart failure,with the early ligation of the left anterior descending coronary artery,and the latter nitric oxide synthase inhibitor(L-NNA).Methods:Wistar rats were randomly divided into two groups:the sham group and the model group of chronic heart failure with heart yang deficiency. Chronic heart failure was caused by coronary artery ligation in model group,the sham group threading without ligation.LNNA was given for 4 weeks to cause heart failure.Respiratory metabolism system was used to monitor the changes of respiratory metabolism and energy metabolism in rats during the experiment.The hemodynamics was used to evaluate the cardiac function of rats in each experimental group.At the end of the experiment,these data were recorded-Timely records of the deaths,the appearance of signs,Mental status(such as behavior,movement,breathing)diet,excretion and edema etc.Results:Different from the sham group,in the second week,respiratory metabolism and energy metabolism were significantly enhanced,compared with the initial coronary artery ligation,while in the Sixth to eighth week,the respiratory metabolism and energy metabolism of time showed a gradual weakening trend(P<0.01).Conclusion:Early ligation of the left anterior descending coronary artery,and the later nitric oxide synthase inhibitor(L-NNA)to establish and evaluate rat model of chronic heart failure with heart yang deficiency,with respiratory metabolism system can dynamically monitor the status and physiological function of animal,and accurately determine the time window of the model,providing an objective,noninvasive method to judge the rat model of chronic heart failure with heart yang deficiency.
Heart yang deficiency;Chronic heart failure;Respiratory metabolism;Energy metabolism;Hemo
R285.5
A
1004-745X(2015)08-1335-04
10.3969/j.issn.1004-745X.2015.08.008
2015-04-07)
山东省高等学校科技计划项目(Z09LF31)
△通信作者(电子邮箱:yy7204@163.com)
