治疗药物浓度监测下万古霉素治疗血流感染6例
2015-01-05张慧芳王瑞兰梁晓宇吴菊芳
张慧芳, 汤 荣, 舒 文, 王瑞兰, 梁晓宇, 杨 洋, 吴菊芳, 张 菁
·论著·
治疗药物浓度监测下万古霉素治疗血流感染6例
张慧芳1, 汤 荣*, 舒 文*, 王瑞兰1, 梁晓宇2, 杨 洋2, 吴菊芳2, 张 菁2
目的探讨增大万古霉素剂量治疗血流感染的可行性。方法入选2013年7月1日—12月31日革兰阳性菌血流感染并使用万古霉素治疗的成人患者,检测万古霉素血药浓度并根据患者的治疗反应及血药浓度监测结果,调整万古霉素给药方案,同时记录患者的临床相关资料,分析治疗药物浓度监测下增大万古霉素剂量,治疗甲氧西林耐药凝固酶阴性葡萄球菌(MRCNS)血流感染患者的有效性及安全性。结果本研究中血流感染病原菌均为 MRCNS,除1株人葡萄球菌的万古霉素MIC值为1 mg/L,其余菌株的万古霉素MIC值均为2 mg/L。常规剂量(2 g/d,或1.5 g/d)万古霉素的谷浓度平均值为(3.84±1.42)mg/L,高剂量(3 g/d)万古霉素谷浓度平均值为(9.13±4.88)mg/L。常规剂量时平均万古霉素曲线下面积(AUC)与MIC浓度比值(AUC/MIC)为152±39,高剂量用药时平均AUC/MIC为197±44。6例患者中有1例出现了肾功能损害。6例患者在使用万古霉素后3例临床和细菌学治愈,3例无效。结论万古霉素治疗肾功能正常的 MRCNS血流感染患者时,建议在治疗药物浓度监测下调整患者个体化的给药方案,以达到目标治疗浓度。
治疗药物浓度监测; 血流感染; 万古霉素; 最低抑菌浓度; 肾毒性
万古霉素是20世纪50年代从Streptomyces orientalis中分离获得的糖肽类抗生素,主要用于甲氧西林耐药葡萄球菌属、肠球菌属等革兰阳性菌所致严重感染的治疗,具有一定耳、肾毒性。近年来,随着甲氧西林耐药金黄色葡萄球菌(金葡菌)(MRSA)检出率的上升,万古霉素也被广泛使用,随之也带来了一系列万古霉素耐药性问题。至2012 年9月,全球已发现有33株万古霉素耐药的金葡菌[1]。2005年美国胸科协会(ATS)和美国感染病协会(IDSA)已提出将万古霉素的治疗目标血谷浓度调整为15~20 mg/L[2]。2010年美国卫生系统药师协会(ASHP)、IDSA和美国感染专科药师协会(SIDP)的联合专家共同制定的《万古霉素治疗成人金葡菌感染的治疗监测实践指南》中也提出,为避免金葡菌发生耐药,万古霉素的治疗谷浓度应维持在10 mg/L以上,对于最低抑菌浓度(MIC)为1 mg/L的金葡菌,最低谷浓度需达到15 mg/L才能实现曲线下面积(AUC)与MIC比值(AUC/MIC)为400的目标[3]。2011年IDSA临床操作指南中也有同样的推荐[4]。但是近期研究发现万古霉素谷浓度≥15 mg/L[5-6]、日剂量过高(≥4g)[7]以及治疗时间长(≥14 d)[6]均为万古霉素肾毒性的相关危险因素。本研究通过监测6例较高剂量(3 g/d)万古霉素治疗葡萄球菌血流感染患者的血药浓度及相关临床、实验室和微生物检测指标,以探讨增高万古霉素剂量治疗葡萄球菌血流感染患者的有效性及安全性。
1 材料与方法
1.1 资料
1.1.1 病例选择 本研究是一项开放性、观察性研究,入选了2013年7月1日—12月31日符合以下标准的患者;①非粒细胞缺乏且肾功能正常的革兰阳性菌血流感染;②至少有1次万古霉素血药浓度检测记录者。所有入组患者均签署知情同意书。根据患者的治疗效果及万古霉素血药浓度监测结果调整万古霉素的剂量。病例排除标准;①妊娠或哺乳妇女;②合用替考拉宁或利奈唑胺的患者;③合用氨基糖苷类抗生素的患者;④缺乏感染的临床和实验室评价指标,不能进行疗效和安全性评价者。
1.1.2 资料收集 详细记录患者的基本资料(性别、年龄、体重、血肌酐、基础疾病及是否含有医疗植入物等),血培养的病原菌,万古霉素对该菌的MIC,是否合并其他部位感染,合并使用的抗感染药物和肾毒性药物,万古霉素的给药剂量和给药方式,以及万古霉素的血药浓度等。同时记录万古霉素用药前(1周内)、用药中及用药后(1周内)的相关指标,包括血常规、肾功能及每日最高体温。其中用药时间超过1周的患者,用药过程中每周至少复查1次血常规及肾功能。
1.2 方法
1.2.1 万古霉素给药方案 所有患者均为静脉滴注给药。万古霉素起始剂量不超过2 g/d者分2~3次给药,每次给药间隔8~12 h。根据血药浓度结果和患者的临床疗效增大万古霉素剂量至3 g/d时分3次给药,每次给药间隔8 h。剂量为500 mg时给药时间30 min,剂量为1 g时给药时间控制在1~1.5 h。总疗程不小于5 d。
1.2.2 万古霉素血药浓度监测采样及测定方法
在万古霉素血药浓度达到稳态(3~4个维持剂量)后,于给药前30 min抽血检测谷浓度,于同一剂万古霉素给药结束后30 min抽血检测峰浓度,采用雅培公司的Axsym检测系统检测万古霉素血药浓度。对于血药浓度未在治疗范围内者,予调整剂量,并在其后的第3剂万古霉素用药后复测血药浓度,复测时仅需检测血药谷浓度,方法如上所述。
1.2.3 细菌培养及药敏检测仪器 细菌对万古霉素的药敏测定送至上海华山医院中心实验室,采用琼脂对倍稀释法测定抗菌药物对细菌的 MIC,按2013年CLSI标准判读结果。
1.2.4 疗效及安全性判断 血流感染指来自一份或多份血标本中分离出病原微生物,并具有全身感染相应的临床表现,如发热、畏寒、低血压等[8]。本研究入选的患者均为双侧血培养凝固酶阴性葡萄球菌(CNS),且有全身感染的相关临床表现。疗效判断标准为治愈、无效。治愈,指万古霉素治疗结束后患者能达到病原菌清除、临床和实验室检查恢复正常;无效,指治疗结束后患者未能达到病原菌清除和(或)临床未能恢复正常。微生物疗效按清除和未清除进行评估。万古霉素相关肾毒性指应用万古霉素后,血肌酐值升高≥45μmol/L或较用药前基线升高≥50%[3]。
1.2.5 数据处理 根据Cockcroft-Gault公式计算患者肌酐清除率(CLcr),CLcr=[(140-年龄)×体重(kg)]/[血肌酐(μmol/L)×0.818],女性患者再将计算的结果乘以0.85。根据AUC=24 h万古霉素用量(mg)/[(CLcr×0.79+15.4)×0.06]计算万古霉素24 h AUC[9]。根据血药浓度检测前后2 d内的血肌酐值,按AUC公式结合万古霉素MIC值计算AUC/MIC。应用CORREL函数计算AUC/ MIC间的相关系数。
2 结果
2.1 患者基本资料
共收集到6例患者,该6例患者入住ICU时间均大于14 d,且深静脉导管留置时间均大于3 d,其中1例患者同时还留有肋骨和骨盆内固定支架。本研究中血流感染病原菌均为甲氧西林耐药CNS (MRCNS),除1株人葡萄球菌的万古霉素MIC值为1 mg/L,其余菌株的万古霉素MIC值均为2 mg/L。该6例患者的基本资料见表1。
2.2 万古霉素剂量和血药浓度
本研究的6例患者中有5例患者万古霉素起始剂量采用常规剂量,后因临床疗效不佳及血药浓度偏低而增大剂量。常规剂量(1 g,每12小时给药,或0.5 g,每8小时给药)的万古霉素谷浓度范围为(2.07~5.69)mg/L,高剂量万古霉素谷浓度范围为(4.22~18.23)mg/L。按照公式计算得;常规剂量时万古霉素AUC/MIC为98~197,高剂量用药时AUC/MIC为122~265。根据CRRREL函数计算AUC/MIC和谷浓度间相关系数r=0.36,即万古霉素AUC/MIC和谷浓度间未见明显相关性。患者的用药剂量和血药浓度的关系见表2。
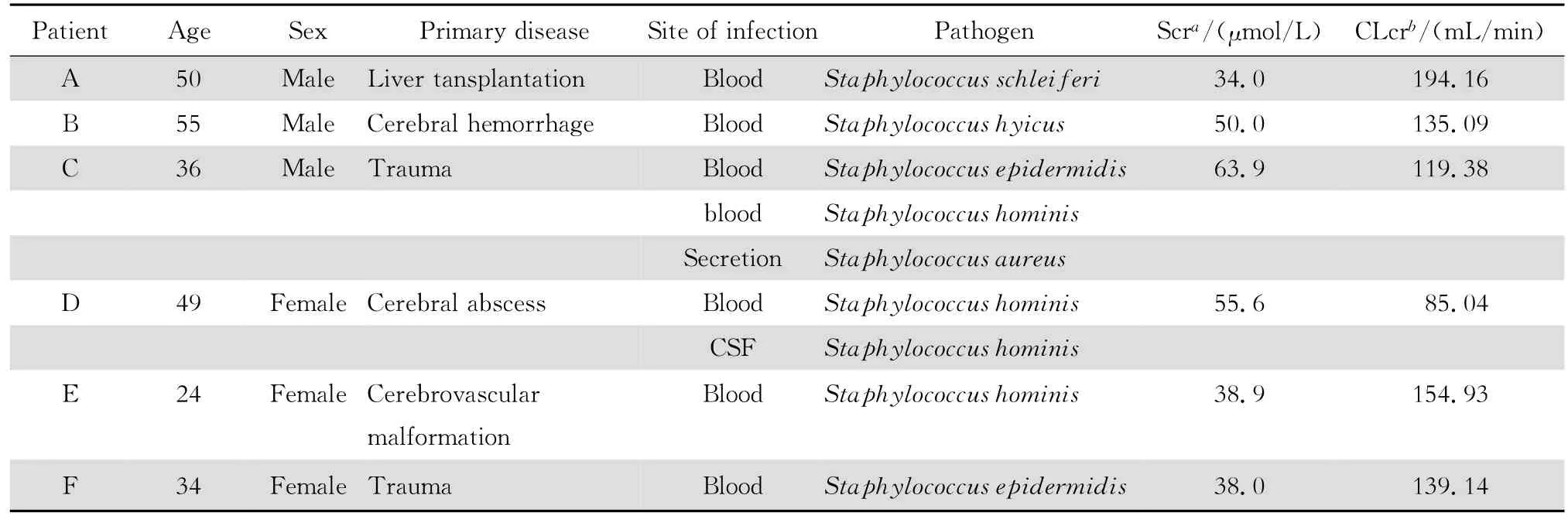
表1 患者基本信息Table1 Clinical data of patients

表2 万古霉素剂量和血药浓度及AUC/MIC关系Table2 Vancomycin dose and serum concentration in relation to AUC/MIC ratio
2.3 疗效及安全性评估
3 例患者经治疗后体温和白细胞恢复正常,血培养转阴,评价为万古霉素治疗有效。1例患者治疗后由于脑外伤原发疾病加重自动出院,未能复查血培养结果,但离院时仍有发热,外周血白细胞升高。1例患者治疗后仍有发热,且手术内固定切口培养出金葡菌。1例患者虽然体温降至正常,微生物清除,但白细胞计数仍高,症状未缓解。此3例判定为万古霉素治疗失败。6例患者中1例肝移植术后患者由于疗程长(总用药时间48 d,高剂量用药时间23 d),以及合并使用其他肾毒性药物(呋塞米、他克莫司等),在治疗第45天时出现血肌酐增高≥45μmol/L,且较用药前基线升高≥50%,停药后3 d患者血肌酐未见下降而自动出院。虽然该患者同时合并使用了其他肾毒性药物,但均为间歇合并用药,且该患者血肌酐及尿素氮水平随万古霉素用药时间和剂量的调整逐渐升高,考虑肾损伤与万古霉素用药有关,故评定为万古霉素相关性肾功能损害。万古霉素的有效性及安全性评价见表3。

表3 疗效和肾毒性评估Table3 Patient outcome and nephrotoxicity following vancomycin treatment
3 讨论
CNS是皮肤、口腔及肠道的正常定植菌群之一,曾被作为临床样本中的污染菌。20世纪80年代后,医院感染日渐增多,病原学方面最显著的变化是多重耐药菌株的出现。CNS成为重要的病原菌,当机体免疫功能低下或进入非正常寄居部位时,可引起多种感染。自1880年临床检出第1株CNS来,目前鉴定出CNS已超过了40种[10]。CNS从共生菌到病原菌的转变与日渐增多的医疗器材植入有着密切的关系;CNS通过黏附在植入物表面并形成顽固的生物膜而致病[11],而处于生物膜阶段的细菌由于表型变化(细胞外基质产生增多,代谢、增殖减慢及多菌定植等),使之对抗菌药物的耐药性增加数倍,并最终导致治疗失败[12]。
本组6例血流感染患者病原菌均为MRCNS。常规剂量的万古霉素治疗后患者临床表现未见好转,检测万古霉素血药谷浓度后发现患者谷浓度值均偏低,平均仅为(3.84±1.42)mg/L。结合患者的临床表现及万古霉素的血药浓度检测结果,将万古霉素的用量调整为54 mg·kg-1·d-1(1 g,每8小时1次给药),调整剂量后万古霉素的平均谷浓度为(9.56±4.97)mg/L,但仍有3例患者治疗失败。在寻找治疗失败的原因时发现,除1株人葡萄球菌的万古霉素MIC值为1 mg/L外,其余菌株的万古霉素MIC值均为2 mg/L。研究显示万古霉素对金葡菌的治疗成功率与其MIC值显著相关[13-14]。这可能是因为高MIC组中异质性万古霉素中介金葡菌(h VISA)菌株的比例高,而h VISA是万古霉素治疗失败的独立相关因素[15]。2009年中国14个城市h VISA的流行病学调查结果显示h VISA组中MIC值>1 mg/L的比例显著高于非h VISA组[16]。更早的研究发现,CNS较金葡菌更易出现h VISA现象[17],且异质性万古霉素中介的CNS多见于万古霉素MIC值为2 mg/L或4 mg/L的菌株[18]。本组中患者治疗成功率低可能与万古霉素 MIC值偏高,有异质性万古霉素中介CNS潜在危险有关(由于技术局限,我们未能进一步做异质性检测)。此外,本组6例患者体内均有医疗植入物,而且深静脉留置时间均大于3 d,1例术后患者还同时留有肋骨和骨盆内固定支架。由于CNS在体内能黏附植入的医疗器材并形成具有保护作用的生物膜,并通过表型变化等使之对抗生素的耐药性增加数倍,故医疗移植物的使用也是本组患者万古霉素治疗成功率低的一个原因。因此,对于有医疗植入物的MRCNS血流感染患者,若万古霉素MIC值已达2 mg/L,应考虑选择其他抗革兰阳性葡萄球菌的药物治疗,避免延误治疗时机。
本组6例患者万古霉素AUC/MIC和谷浓度间未见明显相关性(r=0.36),与Gawronski等[19]的研究结果相仿。万古霉素常规剂量时平均AUC/ MIC为152±39,大剂量时为197±44。比较治疗成功和失败者的平均AUC/MIC发现;治疗成功者平均AUC/MIC为195±48,而失败者平均AUC/ MIC为161±33。虽然目前还没有权威的机构对MRCNS血流感染设定目标AUC/MIC值,但可见其远低于金葡菌的目标值400,且成功者和失败者间也存在差异,故在不具备检测万古霉素谷浓度的情况下,也可通过计算患者的AUC/MIC来预测疗效,但其具体折点还需更多研究数据来探究。
万古霉素具有一定的肾毒性,尽管常规剂量(1 g,每12小时1次给药)使用时肾毒性发生率很低,但是大剂量、长疗程或合并应用其他肾毒性药物时,肾毒性的风险则明显增加,故2011年IDSA推荐万古霉素疗程超过3~5 d的患者应常规监测血药浓度[3]。有文献报道当万古霉素谷浓度>15 mg/L时肾毒性的发生率增加3倍[5]。也有研究数据表明,万古霉素剂量≥4 g/d显著增加肾毒性的发生率[6],但该研究没有评价2~4 g/d的万古霉素剂量与肾毒性的关系。本组6例患者调整剂量后万古霉素的用量均达到了3 g/d,仅有1例联合使用强利尿剂和他克莫司的长疗程治疗(大剂量治疗23 d)患者发生了万古霉素相关肾毒性。文献报道,联用肾毒性药物[20]或万古霉素治疗时间≥14 d[6]均会增加万古霉素肾毒性发生率。因此,应用万古霉素时需谨慎选择联用药物,且治疗时间不宜超过14 d。
万古霉素的药理作用与血药浓度之间存在一定的相关性。血药浓度是药物作用的重要监测指标,因此,治疗中及时监测血药浓度,并根据患者的具体情况调整给药方式和剂量,使血药浓度维持在安全、有效范围内十分必要。本研究结果显示;①常规剂量(2 g/d)不能达到≥10 mg/L的谷浓度,略高于常规剂量(3 g/d)可达到或接近谷浓度10 mg/L以上;②可达到或接近谷浓度10 mg/L的3例患者均获得治愈,未达到者均失败;③出院时仍有肾损害的1例患者谷浓度达到18.23 mg/L,且联用其他肾毒性药物。因此万古霉素治疗肾功能正常的 MRCNS血流感染时,建议在治疗药物浓度监测下调整患者个体化的给药方案,以达到目标治疗浓度。对MRCNS MIC≥2 mg/L且临床疗效不佳的血流感染患者应考虑换用其他抗生素治疗。
需要提出的是本研究还存在一些不足。首先,本研究病例样本量小,不能准确反映人群情况。其次,本研究入选的患者均为18~65岁的正常体重患者,故对于65岁以上的老年人和18岁以下的未成年人及肥胖和消瘦患者本研究结果未必适用。此外,由于万古霉素的药动学参数受肾功能影响,故不推荐对肾功能异常的患者应用超过常规剂量的万古霉素。
[1] Moravvej Z,Estaji F,Askari E,et al.Update on the global number of vancomycin-resistantStaphylococcus aureus(VRSA)strains[J].Int J Antimicrob Agents,2013,42(4);370-371.
[2] American Thoracic Society;Infectious Diseases Society of America.Guidelines for the management of adults with hospitalacquired,ventilator-associated,and healthcare-associated pneumonia[J].Amer JRespir Crit Care Med,2005,171(4);388-416.
[3] Martin JH,Norris R,Barras M,et al.Therapeutic monitoring of vancomycin in adult patients;a consensus review of the American Society of Health-System Pharmacists,the Infectious Diseases Society of America,and the Society of Infectious Diseases Pharmacists[J].Clin Biochem Rev,2010,31(1);21-24.
[4] Liu C,Bayer A,Cosgrove SE,et al.Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistantStaphylococcus aureusinfections in adults and children[J].Clin Infect Dis,2011,52(3);285-292.
[5] Bosso JA,Nappi J,Rudisill C,et al.Relationship between vancomycin trough concentrations and nephrotoxicity;a prospective multicenter trial[J].Antimicrob Agents Chemother,2011,55(12);5475-5479.
[6] Jeffres MN,Isakow W,Doherty JA,et al.A retrospective analysis of possible renal toxicity associated with vancomycin in patients with health care-associated methicillin-resistantStaphylococcus aureuspneumonia[J].Clin Therap,2007,29(6);1107-1115.
[7] Lodise TP,Lomaestro B,Graves J,et al.Larger vancomycin doses(at least four grams per day)are associated with an increased incidence of nephrotoxicity[J].Antimicrob Agents Chemother,2008,52(4);1330-1336.
[8] 黄仲义,肖永红,张菁.万古霉素临床应用中国专家共识(2011版)[J].中国新药与临床杂志,2011,30(8);561-573.
[9] Holmes NE,Turnidge JD,Munckhof WJ,et al.Vancomycin AUC/MIC ratio and 30-day mortality in patients withStaphylococcus aureusbacteremia[J].Antimicrob Agents Chemother,2013,57(4);1654-1663.
[10] Rogers KL,Fey PD,Rupp ME.Coagulase-negative staphylococcal infections[J].Infect Dis Clin North Amer,2009,23(1);73-98.
[11] Mack D,Rohde H,Harris LG,et al.Biofilm formation in medical device-related infection[J].Int J Artifi Organs,2006,29(4);343-359.
[12] Girard LP,Ceri H,Gibb AP,et al.MIC versus MBEC to determine the antibiotic sensitivity ofStaphylococcus aureusin peritoneal dialysis peritonitis[J].Perit Dial Int,2010,30 (6);652-656.
[13] Sakoulas G,Moise-Broder PA,Schentag J,et al.Relationship of MIC and bactericidal activity to efficacy of vancomycin for treatment of methicillin-resistantStaphylococcus aureusbacteremia[J].J Clin Microbiol,2004,42(6);2398-2402.
[14] Mavros MN,Tansarli GS,Vardakas KZ,et al.Impact of vancomycin minimum inhibitory concentration on clinical outcomes of patients with vancomycin-susceptibleStaphylococcus aureusinfections;a meta-analysis and metaregression[J].Int J Antimicrob Agents,2012,40(6);496-509.
[15] Casapao AM,Leonard SN,Davis SL,et al.Clinical outcomes in patients with heterogeneous vancomycin-intermediateStaphylococcus aureush VISA bloodstream infection[J].Antimicrob Agents Chemother,2013,57(9);4252-4259.
[16] Sun W,Chen H,Liu Y,et al.Prevalence and characterization of heterogeneous vancomycin-intermediateStaphylococcus aureusisolates from 14 citiesin China[J].Antimicrob Agents Chemother,2009,53(9);3642-3649.
[17] Park YJ,Jun Park J,Lee SO,et al.Low-level resistance to glycopeptides amongstStaphylococcusspecies;surveillance in a university hospital and evaluation of a vancomycin screening agar[J].Diagn Microbiol Infect Dis,2001,41(3);155-159.
[18] van den Braak N,van Belkum A,te Witt R,et al.Glycopeptide resistance amongstStaphylococusspp[J].J Antimicrob Chemother,1998,42(5);673-675.
[19] Gawronski KM,Goff DA,Brown J,et al.A Stewardship program's retrospective evaluation of vancomycin AUC24/ MIC and time to microbiological clearance in patients with methicillin-resistantStaphylococcus aureusbacteremia and osteomyelitis[J].Clin Ther,2013,35(6);772-779.
[20] Hidayat LK,Hsu DI,Quist R,et al.High-dose vancomycin therapy for methicillin-resistantStaphylococcus aureusinfections;efficacy and toxicity[J].Arch Intern Med,2006,166(19);2138-2144.
Report of 6 cases of vancomycin-treated blood stream infection under therapeutic drug monitoring
ZHANG Huifang,TANG Rong,SHU Wen,WANG Ruilan,LIANG Xiaoyu,YANG Yang,WU Jufang,ZHANG Jing.(Department of Critical Care,First People's Hospital Affiliated to Shanghai Jiao Tong University,Shanghai 201620,China)
;ObjectiveThis report aims to explore the outcome of blood stream infection following high dose vancomycin treatment under therapeutic drug monitoring.MethodsThis is an observational research.The patients satisfying the following criteria were included from July 1,2013 to December 31,2013;18-65 years of age;non-neutropenic with normal renal function;confirmed blood stream infection due to gram-positive bacteria;at least one observation of serum vancomycin concentration.Vancomycin dose was adjusted according to patient's clinical response and serum vancomycin concentration.ResultsAll the pathogens isolated from blood stream were meticillin-resistant coagulase-negativeStaphylococcus(MRCNS).The minimum inhibitory concentration(MIC)of vancomycin was 2 mg/L,except one strain ofStaphylococcus hominis(1 mg/L).The mean serum concentration of vancomycin was 3.84±1.42 mg/L following standard therapy(1 g,q12h or 0.5 g,q8h),and 9.13±4.88 mg/L following high dose therapy.The mean ratio of area under curve and minimum inhibitory concentration(AUC/MIC)was 152±39.The ratio was 197±44 with high dose therapy.One case of nephrotoxicity was reported due to longer duration of treatment(total 48 d,and 23 d with high dose therapy).Renal dysfunction was observed in one of the six patients.Three(50%,3/6)patients were clinically and bacteriologically cured after vancomycin treatment.ConclusionsWhen vancomycin is used to treat patients with blood stream infection,the dose should be adjusted according to therapeutic drug monitoring for individualized therapy and the best target therapy concentration.
; therapeutic drug monitoring; blood stream infection; vancomycin; minimum inhibitory concentration; nephrotoxicity
R978
A
1009-7708(2015)02-0149-06
2014-04-28
2014-08-22
2010年度国家重点专科卫生部抗生素临床药理重点实验室建设项目。
1.上海交通大学附属第一人民医院危重病科,上海201620;*检验科。2.复旦大学附属华山医院抗生素研究所。
张慧芳(1989—),女,在读硕士研究生,主要从事危重病患者血药浓度监测。
王瑞兰,E-mail;wangyusun®hotmail.com。
