蛇床子素对小鼠湿疹肥大细胞及其STAT5基因和蛋白表达的影响*
2015-01-05熊健钟振东傅荣熊巍
熊健,钟振东,傅荣,熊巍
(四川省医学科学院、四川省人民医院皮肤科,成都 610072)
·皮肤性病用药专栏·
蛇床子素对小鼠湿疹肥大细胞及其STAT5基因和蛋白表达的影响*
熊健,钟振东,傅荣,熊巍
(四川省医学科学院、四川省人民医院皮肤科,成都 610072)
目的探讨蛇床子素对小鼠湿疹肥大细胞及其信号转导和转录活化蛋白5(STAT5)基因和蛋白表达的影响。方法采用被动皮肤变态反应复制小鼠湿疹模型,致敏后分离腹腔肥大细胞,采用卵蛋白诱发肥大细胞过敏,致敏后的肥大细胞分为空白对照组、蛇床子素大剂量组及小剂量组。药物干预24 h后,采用免疫荧光法检测3组肥大细胞形态,噻唑蓝法检测药物对肥大细胞增殖的影响,RT-PCR及Western blot法检测各组细胞中STAT5基因及蛋白的表达水平。结果与空白对照组比较,给药组肥大细胞数量明显减少,细胞体积明显缩小,细胞核体积缩小,部分细胞凋亡;细胞抑制率随药物浓度显著上升(P<0.01);与空白对照组(2.16±0.57)比较,蛇床子素大剂量组(0.59±0.12)和小剂量组(0.82±0.13)STAT5基因表达水平均有极显著降低(P<0.01);与空白对照组比较,蛇床子素大剂量组及小剂量组STAT5蛋白表达水平均有极显著降低(P<0.01)。结论蛇床子素可抑制致敏肥大细胞的增殖,并下调STAT5基因和蛋白的表达。
蛇床子素;湿疹;肥大细胞;信号转导和转录活化蛋白5
湿疹是临床皮肤科常见炎症性皮肤疾病。目前已被证实,肥大细胞脱颗粒病变在湿疹的发病过程中起着决定性作用。Toshiaki及其研究团队在人类皮肤上皮细胞样本中证实,肥大细胞是引起湿疹的罪魁祸首,而肥大细胞中的信号转导和转录活化蛋白5(signal transduction and activator of transcription5,STAT5)在湿疹的发病过程中具有关键性作用,可以大大增加肥大细胞的数量[1]。该研究展示了肥大细胞和STAT5驱动湿疹发展的关键性作用,同时该成果也为开发治疗湿疹的药物提供了重要的靶点。蛇床子素,又名甲氧基欧芹酚或欧芹酚甲醚,主要存在于伞形科14 个属植物中和芸香科17个属的植物中,目前已证实其具有抗菌、抗氧化、抗变态反应等药理活性[2-3]。蛇床子软膏是四川省人民医院以蛇床子素为原料制备的一种外用擦剂,广泛用于各种急、慢性湿疹和小儿尿布疹等的治疗,其疗效显著,且安全无毒副作用。笔者在本实验中,在临床疗效基础上,以蛇床子素单体为研究对象,研究其对肥大细胞及其关键基因和蛋白的影响,旨在探究该品种治疗湿疹的作用机制,为该品种的新药开发奠定基础。
1 材料与方法
1.1 动物 6周龄雌性BALB/c小鼠,SPF级,体质量18~22 g,由成都达硕生物科技有限公司提供,实验动物使用许可证号:SYXK(川)2009-0124。生产许可证号:SCXK(川)2008-0024。饲养条件:四川省人民医院实验动物观察室。动物自由进食饮水,环境温度22~24 ℃,相对湿度45%~75%,通风条件良好,环境相对安静,每日光照12 h,每笼5只。
1.2 试药 蛇床子素,含量:99.5%,批号:R-140228,购自中国科学院成都生物所。卵蛋白(ovalbumin,OVA,批号:S0123)、溴化噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT,批号:K1208)为Sigma公司产品。Trizol Kit(批号:S130928)、RNAiso Plus Kit(批号:BK3303)、PrimeScript RT reagent Kit(批号:BK501)、SYBR Premix Ex Taq Ⅱ Kit(批号:BK402)均为美国Amresco公司产品。兔抗人STAT5多克隆抗体、辣根过氧化酶标志山羊抗兔抗体、DAB 显液试剂盒(批号:BK130922)均购自北京博奥森生物科技公司。STAT5和β-actin引物均由北京博奥森生物科技公司合成。
1.3 仪器 BSA224S电子天平(赛多利斯科学仪器有限公司,感量:0.1 mg);PIKORed96 RT-PCR扩增仪(美国ThermoFisher仪器有限公司);UK-33垂直电泳槽(美国Bio-RAD 公司);DYY-6C电泳仪(北京六一仪器厂);化学发光凝胶成像仪(美国Bio-RAD 公司)。
1.4 小鼠致敏模型的建立与血清样本收集 采用被动皮内变态反应复制小鼠湿疹模型,经腹腔注射卵蛋白过敏原和氟氧化铝佐剂致敏BALB/c小鼠,筛选致敏成功的小鼠,眼球采血,收集血液,3 000 r·min-1(r=3 cm)离心10 min,分离血清,等量混合制备血清池,-80 ℃贮存备用[4]。
1.5 BALB/c小鼠腹腔肥大细胞(mice peritoneal mast cells,MPMC)的制备 参照文献[5]方法,处死小鼠,立即用去钙镁离子的Hank’s平衡盐溶液(Hank's balanced salt solution,HBSS)进行腹腔注射,轻抚小鼠腹部3~4 min后打开腹腔,抽取各组小鼠腹腔洗液,低温离心5 min,收集沉淀细胞,反复清洗3次后吹打成细胞悬液,缓慢加入到30:80的percoII梯度分离液中,低温离心5 min,用HBSS溶液洗3次,收集界面细胞,镜下计数,调整细胞密度至5×1011·L-1。分别用锥虫蓝和甲苯胺蓝染色法进行细胞染色,镜下观察,鉴定细胞活力和细胞纯度(甲苯胺蓝染色能与肥大细胞中的肝素结合成特异性紫红色,可用于肥大细胞鉴定与脱颗粒检测,它将胞核染成蓝色,故可见细胞中间有蓝色细胞核)。取活力和纯度均>95%的肥大细胞置RPMI 1640培养液中培养4 h。
1.6 肥大细胞体外致敏和激发实验 取“1.5”项下分离培养的肥大细胞,于37 ℃条件下,与钙离子浓度为5 mmol·L-1的不同浓度致敏血清共孵育2 h,4 ℃终止反应,用预冷的HBSS洗涤,去上清液,在细胞悬液中加入卵蛋白过敏原溶液终浓度为100 μg·L-1进行激发,孵育60 min。
1.7 药物干预 取激发后的肥大细胞,用磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗,取含5×104~6 ×104的细胞悬液170 μL接种于96孔培养板,加入蛇床子素溶液,使其终浓度分别为5.0,1.0 mg·mL-1,分别作为药物大剂量组及小剂量组,加RPMI-1640培养液至200 μL。空白对照组只加细胞悬液170 μL,加培养液至200 μL。每种浓度均作10个平行孔,混匀后放入二氧化碳孵箱中培养。药物干预24 h后,于4 ℃下终止反应,用预冷的HBSS洗涤,收集细胞和上清液待测。
1.8 检测指标
1.8.1 肥大细胞形态学观察 采用免疫荧光技术对3组肥大细胞进行染色,并用荧光显微镜观察细胞形态。
1.8.2 肥大细胞细胞抑制率 药物干预24 h后,进行MTT实验,实验根据公式:抑制率(%)=(对照孔A值-用药孔A值)/对照孔A值×100%,计算抑制率,同时用免疫荧光法对细胞形态进行检测。
1.8.3 STAT5 mRNA检测 取药物干预24 h后的肥大细胞,Trizol法提取细胞总RNA,采用两步法PCR 反应,反应条件:(95 ℃预变性10 min,95 ℃预变性30 s)×40个循环,95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,得到每个样品的Ct值,以β-actin作为内参照基因进行校准,采用2-ΔΔCt法计算目的基因的表达量,ΔΔCt=(Ct目的基因-Ct内参)实验组-(Ct目的基因-Ct内参)空白对照组,STAT5 mRNA和β-actin基因引物信息见表1。
1.8.4 STAT5蛋白检测 取药物干预24 h后的肥大细胞,细胞裂解法提取细胞总蛋白,Lowry法蛋白定量,聚丙烯酰氨凝胶电泳凝胶电泳(polyacrylamide gel electrophoresis,PAGE),Western blot蛋白质印迹。应用Tanon-2500R型全自动数码凝胶成像系统成像,使用ScionImage软件对蛋白电泳带进行灰度值分析,以β-actin作为内参照蛋白进行校准,采用目标蛋白条带灰度值/β-actin条带灰度值来表示STAT5的相对蛋白表达水平。

表1 STAT5和β-actin引物 Tab.1 Primer of STAT5 and β-action
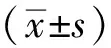
2 结果
2.1 蛇床子素对肥大细胞形态的影响 药物干预后,肥大细胞数量明显减少,细胞体积明显缩小,细胞核体积缩小,核固缩,无核仁;部分凋亡细胞可见核碎裂,碎裂的核由胞膜包裹并突起于细胞表面形成凋亡小体。见图1。

A.空白对照组;B.蛇床子素大剂量组;C.蛇床子素小剂量组
A.blank control group;B.high-dose osthole group;C.low-dose osthole group
Fig.1 Fluorescence images of three groups of mast cells(×100)
2.2 蛇床子素对肥大细胞增殖的影响 蛇床子素作用于肥大细胞24 h后,蛇床子素大剂量组及小剂量组肥大细胞抑制率为(87.9±8.2)%,(78.6±7.5)%,与空白对照组(0.0±0.0)%比较,均差异有统计学意义(P<0.01),其抑制率与作用浓度呈显著正相关。
2.3 蛇床子素对STAT5 mRNA表达的影响
2.3.1 熔解曲线分析 由图2可知,内参β-actin和STAT5基因的Tm值分别为86.07和85.24 ℃,说明所得扩增产物均是目标产物,无引物二聚体及非特异产物。
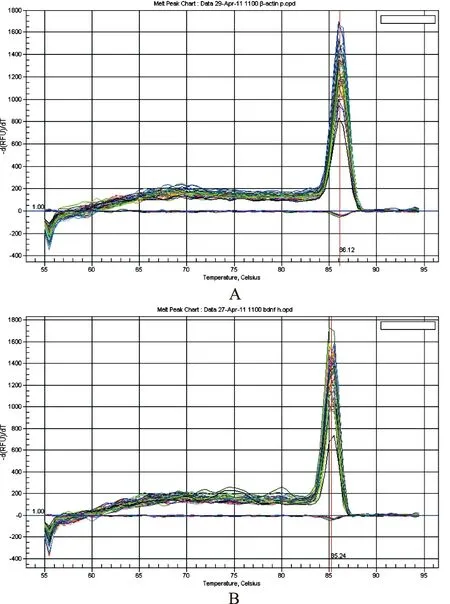
图2 内参β-actin(A)及STAT5(B)Real-Time PCR产物熔解曲线
Fig.2 Melting curves of PCR product from β-actin(A) and STAT5(B)
2.3.2 扩增曲线分析 由图3可知,内参β-actin和STAT5的Ct值均在20~35范围内,表明PCR反应体系和反应程序设置合理。
2.3.3 蛇床子素对STAT5 mRNA表达的影响 蛇床子素大剂量组及小剂量组肥大细胞中STAT5 mRNA表达为(0.59±0.12),(0.82±0.13),与空白对照组(2.16±0.57)比较,差异有统计学意义(P<0.01),表明蛇床子素可显著下调肥大细胞中STAT5基因的表达。
2.4 蛇床子素对STAT5蛋白表达的影响 由图4可知,与空白对照组比较,蛇床子素大剂量组及小剂量组肥大细胞中STAT5蛋白表达均差异有统计学意义(P<0.01),表明蛇床子素可显著下调肥大细胞中STAT5蛋白的表达。
3 讨论
湿疹是严重影响人类健康的常见变态反应疾病,其发病率高,容易迁延,多种炎症细胞参与其发生、发展,尤其是肥大细胞及其介质在变态反应过程中起到了非常重要的作用。肥大细胞是人类速发型变态反应的初级效应细胞,主要分布在皮肤、呼吸道、胃肠道及泌尿生殖系统黏膜下层,其激活直接影响次级效应细胞——嗜酸粒细胞和中性粒细胞的募集和激活[6-7]。可见肥大细胞及其介质在变态反应过程中起着重要作用,控制或抑制肥大细胞的过度增生是治疗变态反应的中心环节。
Toshiaki团队在动物实验中发现,敲除STAT5基因后,小鼠拥有了对湿疹的抵抗力,表明肥大细胞中的STAT5通路对于湿疹的重要性。进一步采用 STAT5抑制药后发现,湿疹小鼠肥大细胞数量明显减少,此研究结果表明变态反应过程中,肥大细胞的异常增生可能与STAT5基因和蛋白的过表达有关[1]。笔者在本实验中研究表明,蛇床子素对致敏后肥大细胞的过度增生具有明显的抑制作用,与此同时,蛇床子素可显著降低致敏肥大细胞中STAT5基因和蛋白的表达,这可能是蛇床子素治疗湿疹的内在机制。
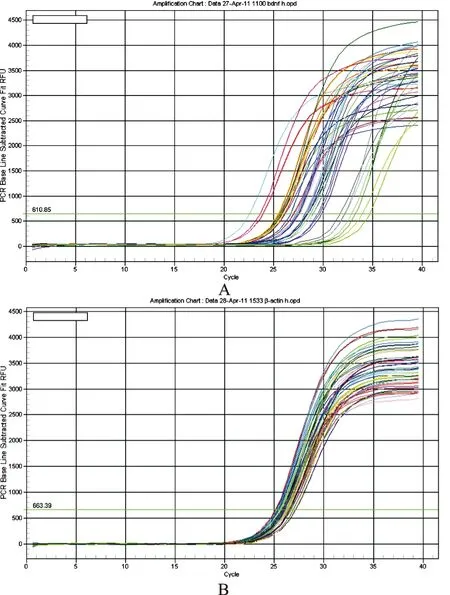
图3 内参β-actin(A)及STAT5(B)Real-Time PCR扩增曲线
Fig.3 Amplification curves of β-actin(A) and STAT5(B) by real-time PCR

A.电泳图;B.矩形图;与空白对照组比较,*1P<0.01
图4 蛇床子素对肥大细胞STAT5蛋白表达的影响
A.electrophotogram;B.histogram;compared with blank control group,*1P<0.01
Fig.4 Effect of osthole on the expression of STAT5 protein in mast cells
[1] ANDO T,XIAO W B,GAO P S,et al.Critical role for mast cell Stat5 activityin skin inflammation[J].Cell Rep,2014,30(6):366-376.
[2] 张晓平,陈新梅,崔清华,等.蛇床子素药理作用及其相关机制研究进展[J].中国执业药师,2013,23(11):28-32.
[3] 郑立卿,张力,董晓华,等.蛇床子素药理作用研究进展[J].神经药理学报,2013,11(6):29-35.
[4] SAMEE H,KHALID J.Studies on the specific degranulation of mast cell sensitized by several allergensinvitro[J].Cell Mol Immunol,2009,21(2):149-153.
[5]KIM S H.Inhibitory effect of persimmon on mast cell-mediated allergic inflammation[J].Asian Pac J Trop Med,2012,11(4):1254-1259.
[6] 杨岚,李蕾,陈国千.肥大细胞功能和介质释放机制的研究进展[J].国际检验医学杂志,2010,23(8):834-836.
[7] 吴景良,张理涛.肥大细胞免疫生物学研究进展[J].中国中西医结合皮肤性病学杂志,2008,17(1):60-63.
Effect of Osthole on Mast Cells and Expression of STAT5 Gene and Protein in Mice with Eczema
XIONG Jian,ZHONG Zhendong,FU Rong,XIONG Wei
(SichuanAcademyofMedicalSciences,DepartmentofDermatology,SichuanProvincialPeople'sHospital,Chengdu610072,China)
Objective To explore the effect of osthole on mast cells and expression of STAT5 gene and protein in them. Methods Passive cutaneous anaphylaxis was made in mice to copy eczema model, then the allergic mast cells were separated, and the ovalbumin was used to induce allergy of mast cells.Different concentrations of osthole were used to intervene the sensitized mast cells.Then the sensitized mast cells were divided into blank control group, osthole high-dose group and low-dose group.At the end of the experiment, morphology of the mast cells was detected by immunofluorescence technology.MTT assay was used to detect the influence of drugs on mast cells proliferation.RT-PCR and Western blotting were used to detect the expression of STAT5 gene and protein. Results As compared with blank control group, the number of mast cells in the osthole groups was significantly reduced, cells and nuclei obviously shrank, even apoptosis of some cells could be observed; the inhibition rate of mast cells in osthole groups was significantly increased in concentration-dependent manner (P<0.01).As compared with blank control group (2.16±0.57), gene expression of STAT5 was significantly decreased in osthole high-dose group (0.59±0.12) and low-dose group (0.82±0.13) (P<0.01).The protein expression of STAT5 was also significantly decreased in osthole high-dose group and low-dose group as compared with blank control group (P<0.01). Conclusion Osthole can inhibit the proliferation of sensitized mast cells, and reduce the expression of STAT5 gene and protein.
Osthole; Eczema; Mast cells; Signal transduction and activator of transcription 5
2014-07-18
2014-09-11
*国家自然科学基金资助项目(81301075)
熊健(1976-),男,四川成都人,学士,研究方向:皮肤病学。电话:(0)18080463709,E-mail:1505214952@qq.com。
钟振东(1974-),男,四川成都人,助理研究员,硕士,从事实验动物病理学工作。电话:(0)13568922768,E-mail:511738602@qq.com。
R285.5;R751
A
1004-0781(2015)12-1584-04
10.3870/j.issn.1004-0781.2015.12.009
