TiO2纳米管限域Fe2O3的可见光分解水制氢性能*
2015-01-04王文博吴梁鹏李新军
王文博,吴梁鹏,李新军†
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院大学,北京 100049)
TiO2纳米管限域Fe2O3的可见光分解水制氢性能*
王文博1,2,吴梁鹏1,李新军1†
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院大学,北京 100049)
通过真空−超声辅助的等体积浸渍法制备了TiO2纳米管限域Fe2O3催化剂,考察了其可见光分解水制氢性能。由于TiO2纳米管的限域效应,导致Fe2O3颗粒减小,分散度提高,能隙增大,光生载流子得到有效分离,提高了其光解水制氢活性。
限域效应;光解水制氢;TiO2纳米管;Fe2O3
0 引 言
太阳能是取之不尽用之不竭的清洁可再生能源,直接有效地利用太阳能被认为是可以从根本上解决能源枯竭和环境问题的重要途径之一[1]。太阳能光化学能转换是继光伏、光热技术之后的新利用方式,其中利用太阳能光催化分解水制氢被称为“21世纪梦的技术”[2]。
20世纪70年代初,日本东京大学Fujishima等[3]发现利用TiO2(TiO2)半导体单晶电极可发生光催化分解水生成氢气和氧气。但TiO2作为一种宽禁带的半导体,其禁带宽度为3.2 eV,只能被波长小于387 nm的紫外光激发(太阳光谱中紫外光约占4%,可见光约占43%),限制了其在太阳能方面的实际应用[4]。2001年,邹志刚等[5]制备了利用可见光分解水制氢的新型氧化物半导体(In1-xNixTaO4),由此引起了此类可见光催化剂的研究热潮,可见光催化剂的研究引起了人们的广泛关注。采用窄带隙可见光响应材料(染料、CdS等)敏化宽带隙半导体(TiO2或ZnO)可以进一步提高可见光光催化活性[6,7]。近年来氧化物半导体(CoO、Fe2O3等)光分解水制氢的研究再次受到高度重视。
Fe2O3是地球上常见的氧化物之一,其较窄的禁带宽度使其能够吸收利用绝大多数的太阳光[8],是一种理想的光电化学分解水材料,其理论上能够达到的最大光电化学分解水效率为12.9%,目前正逐渐成为光催化领域的研究热点之一[9]。但是其光吸收系数低,导电性差,光分解水时产生的激发态寿命短,空穴扩散路程短(约2~4 nm),导致其效率远低于理论值[10-13]。目前,研究者主要有通过形貌控制、掺杂、表面修饰和与其他半导体复合等方法来提高纳米Fe2O3光电化学分解水性能[14]。
近年来,限域催化的研究得到了广泛关注。包信和等[15-18]制备了碳纳米管限域的铁基催化剂,显示出较好的费托催化性能。Nishijima等[19]将Pt装入TiO2纳米管内,并发现其光催化氧化乙醛的活性相比管外催化剂有所提高。Oshima等[20]制备了担载Pt纳米颗粒的KCa2Nb3O10多层堆叠结构,展现出较好的太阳光分解水制氢性能。本课题组也在制备CdS、Pt、Pd等纳米颗粒限域于TiO2纳米管内以及其催化性能方面进行了一系列工作,并取得了较好的结果[21-23]。本文采用真空−超声辅助的等体积浸渍法制备TiO2纳米管限域三氧化二铁的可见光催化剂,并考察TiO2纳米管限域效应对光解水制氢性能的影响。
1 实验部分
1.1 催化剂的制备
1.1.1 TiO2纳米管载体的制备
首先通过水热法制备钛酸纳米管,将8 g P25型TiO2粉末放入聚四氟乙烯细口瓶中,倒入160 mL浓度为10 mol·L−1的NaOH溶液,在125℃下加热搅拌24 h,得到白色胶状产物,在去离子水中分散并水洗至pH=7;随后在0.1 mol·L−1的HCl中浸泡5 h左右;接下来再用去离子水洗至滤液电导率小于5 μS·m−1。过滤并将沉淀物在50℃烘干,得到白色的钛酸纳米管(HTNT)粉末。将钛酸纳米管在350℃焙烧1 h,获得的TiO2纳米管标记为TNT。
1.1.2 TiO2纳米管限域Fe2O3催化剂的制备
称取1.63 g Fe(NO3)3·9H2O并溶解于1.5 mL去离子水中。将上述硝酸铁水溶液缓慢滴入含1.5 g TNT的三角烧瓶中,并不断搅拌确保分散均匀,随后将烧瓶在真空−超声辅助下浸渍1 h。将制备的催化剂在200℃下焙烧2 h,获得TiO2纳米管限域Fe2O3催化剂,标记为Fe2O3-in-TNT。采用简单浸渍法制备TiO2纳米管负载Fe2O3催化剂(Fe2O3-out-TNT)与Fe2O3-in-TNT进行性能对比。
1.2 催化剂的表征
催化剂的形貌表征采用高分辨日立S-4800场发射扫描电子显微镜(FESEM)和日本电子株式会社JEM-2010HR型200 kV透射电子显微镜(HRTEM)。利用X’Pert-PRO, PANalytical型X射线衍射仪(X-Ray Diffraction, XRD)进行样品的晶型与结构组分分析。利用ThermoFisher Scientific ESCALAB 250Xi型X射线光电子能谱仪(X-ray photoelectron spectroscopy, XPS)进行样品的表面元素构成以及电子态的分析。利用Lambda750 PerkinElmer 紫外/可见/近红外分光光度计进行样品的紫外−可见光漫反射分析(UV-Vis Diffuse Reflectance Spectra, UV-Vis DRS)。
1.3 催化剂光解水制氢性能表征
催化剂性能表征通过实验室自制的光催化制氢装置进行。用300 W氙灯作为反应光源,并用420 nm滤光片除去紫外光。取50 mg催化剂粉末倒入受光面积为5 cm × 5 cm的石英玻璃光反应制氢装置,并加入80 mL去离子水,超声振荡15 min后搅拌30 min。随后缓慢滴加0.35 mL浓度为0.007 7 mol·L−1的氯铂酸水溶液。先进行15 min的光还原过程,随后在可见光照射下开始收集气体,每10 min记录一次气体产物体积。
2 结果与讨论

图1 钛酸纳米管(a),Fe2O3-in-TNT(b)和Fe2O3-out-TNT(c)的SEM图像Fig. 1 SEM images of TNT (a), Fe2O3-in-TNT (b) and Fe2O3-out-TNT (c)
图1为钛酸纳米管(a)、Fe2O3-in-TNT(b)和Fe2O3-out-TNT(c)的SEM图,水热法合成的钛酸纳米管有良好的纳米管形貌和较大的长径比。350℃热处理对纳米管的管状形貌几乎没有影响。从图1b和1c看出,TiO2纳米管限域Fe2O3(Fe2O3-in-TNT)和负载Fe2O3(Fe2O3-out-TNT)后仍然保持了良好的管状形貌。图2为催化剂样品Fe2O3-in-TNT(a)和Fe2O3-out-TNT(b)的TEM图。由于TiO2与Fe2O3的图像在TEM中的衬度较为接近,以TiO2纳米管为载体的Fe2O3催化剂的图像较为模糊,且Fe2O3颗粒不易分辨。由图2a仍可以看出,通过真空−超声辅助等体积浸渍法制备的限域型催化剂(Fe2O3-in-TNT)中大部分的Fe2O3颗粒附着于纳米管的内壁。而Fe2O3-out-TNT催化剂中大部分的Fe2O3颗粒担载于纳米管外壁(如图2b所示)。

图2 Fe2O3-in-TNT(a)和Fe2O3-out-TNT(b)的TEM图Fig. 2 TEM images of catalysts of Fe2O3-in-TNT (a) and Fe2O3-out-TNT (b)
图3为钛酸纳米管、Fe2O3-in-TNT和Fe2O3-out-TNT的XRD图。从图中钛酸纳米管的XRD衍射峰位来看,其在2θ=9.9°有一个明显特征峰,对应于H2Ti3O7的d200晶面[24]。在350℃热处理下,钛酸纳米管转变为TiO2纳米管,其衍射峰位与锐钛矿TiO2(JCPDS卡片号:74~1 940)的标准峰位相一致。图中用黑色垂线标注了标准谱图的峰位。Fe2O3-in-TNT和Fe2O3-out-TNT的XRD图显示锐钛矿TiO2的特征峰没有发生变化,而Fe2O3的特征峰很弱或没有显示,可能是由于Fe2O3在TiO2纳米管上具有较高的分散性,这与文献[25]一致。
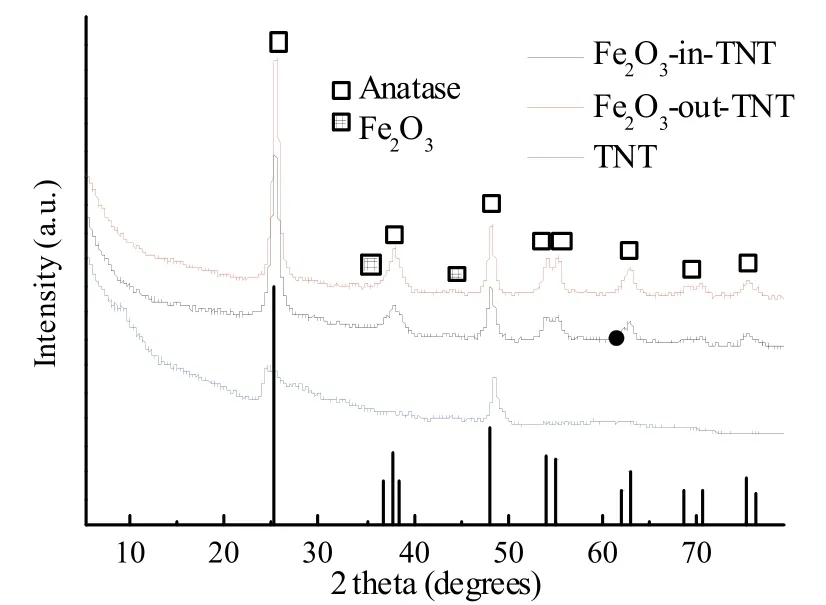
图3 钛酸纳米管、Fe2O3-in-TNT和Fe2O3-out-TNT的XRD图Fig. 3XRD patterns of HTNTs, Fe2O3-in-TNT and Fe2O3-out-TNT
采用XPS分析进一步确定催化剂Fe2O3-in-TNT和Fe2O3-out-TNT的元素组成及各种元素存在状态。图4是Fe2O3-in-TNT和Fe2O3-out-TNT催化剂的全谱分析图和Ti、O、Fe元素的高分辨率分析图。图4a表明两种催化剂中均含有Ti、O、Fe和C元素,C元素可能是XPS仪器本身不可避免的油污所产生[26]。在图4b中,由于电子的自旋−轨道耦合,使Ti 2p能级分裂为两个能级分别为Ti 2p1/2和Ti 2p3/2,样品中Ti 2p1/2和Ti 2p3/2结合能分别为464.0 eV和468.3eV。图4d是O 1s的高分辨谱图,结合能为529.7 eV[27]。图4b为Fe 2p区域的高分辨XPS谱图,位于711.1 eV和724.7 eV的峰分别为Fe 2p1/2和Fe 2p3/2区域的特征峰。值得关注的是,Fe2O3-in-TNT中Fe元素的结合能明显高于Fe2O3-out-TNT中Fe元素,说明管内形成Fe2O3的电子云密度较低,更有利于电子从Fe2O3转移至TiO2纳米管[28]。
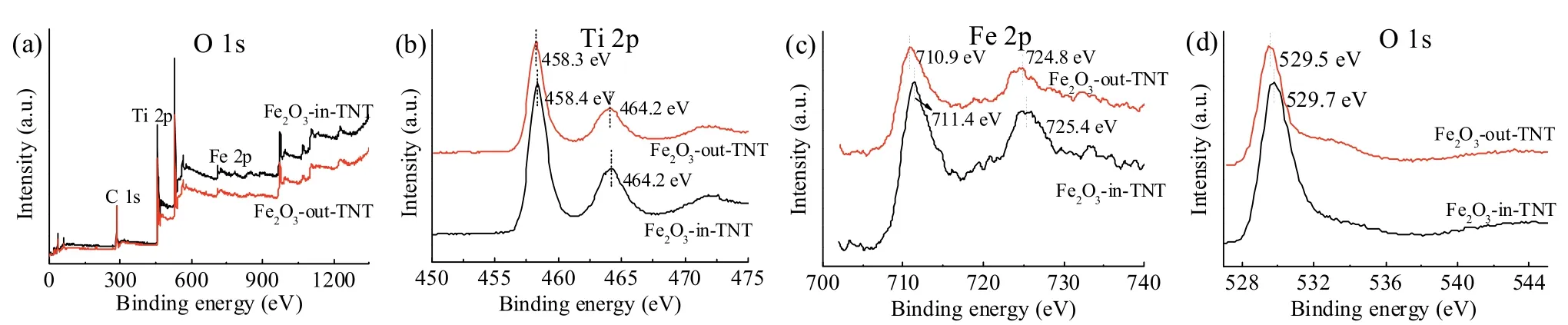
图4 Fe2O3-in-TNT和Fe2O3-out-TNT催化剂的XPS谱图:(a)全谱;(b)Ti 2p;(c)Fe 2p;(d)O1sFig. 4 XPS spectra of Fe2O3-in-TNT and Fe2O3-out-TNT: (a) full spertra ; (b) Ti 2p; (c) Fe 2p; (d) O1s
图5为TNT、Fe2O3-in-TNT和Fe2O3-out-TNT的紫外−可见吸收光谱图。由图可知,TNT样品的吸收带边约为380 nm。而Fe2O3-in-TNT和Fe2O3-out-TNT的吸收带边发生明显的红移,到达可见光区域,分别位于665 nm与681 nm。相对于Fe2O3-out-TNT而言,Fe2O3-in-TNT的吸收带边发生了轻微的蓝移,这可能是由于Fe2O3限域于TiO2纳米管内,限域空间使得Fe2O3具有较小的颗粒尺寸所引起的量子效应。
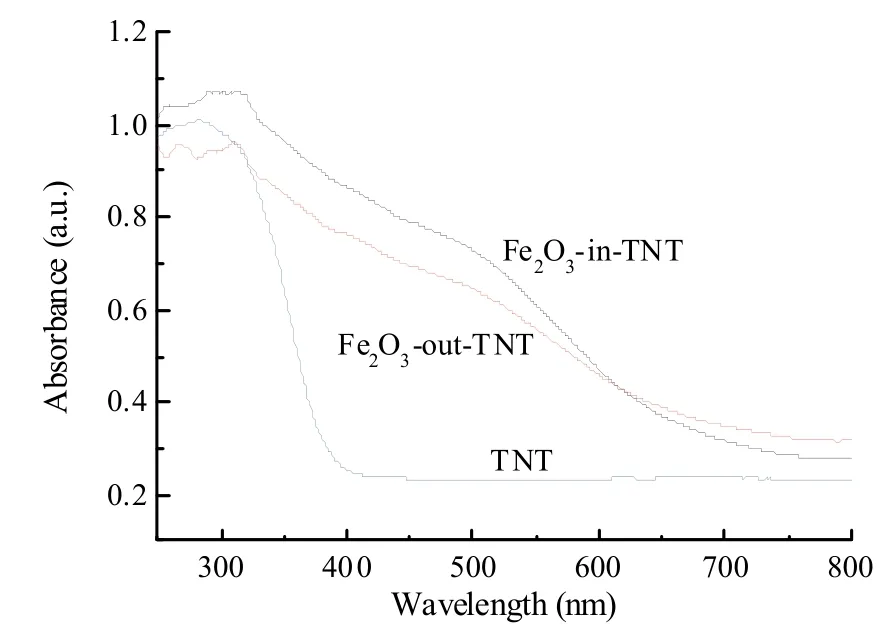
图5 TNT、Fe2O3-in-TNT和Fe2O3-out-TNT的紫外−可见吸收光谱Fig. 5 UV-Vis DRS of TNT, Fe2O3-in-TNT and Fe2O3-out-TNT
图6为Fe2O3-in-TNT和Fe2O3-out-TNT催化剂的产氢量随时间变化示意图。由图中可以看出,在1 h内,Fe2O3-in-TNT的产氢量约为0.7 mL,Fe2O3-out-TNT的产氢量约为0.4 mL,Fe2O3-in-TNT比Fe2O3-out-TNT具有更好的产氢活性。但60 min后Fe2O3-in-TNT和Fe2O3-out-TNT催化剂的制氢效率均有所下降,这可能是由于催化剂表面光解水产生的氢和氧离子重新生成水所引起的“表面逆反应(surface back reaction, SBR)”现象[29]。同时,从图6可以看出,TiO2纳米管限域催化剂由于能够促进光生载流子的有效分离,可有效地抑制光解水过程的SBR效应。
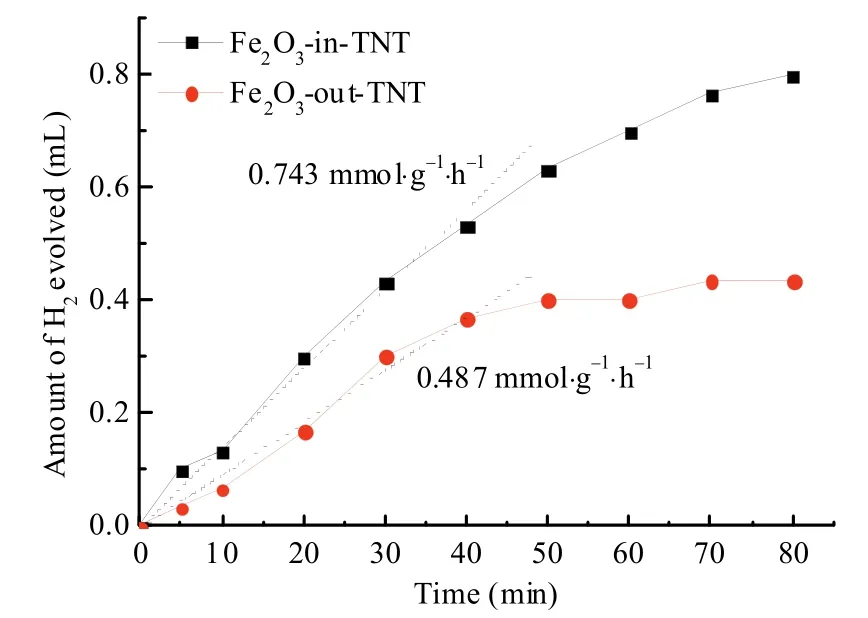
图6 Fe2O3-in-TNT和Fe2O3-out-TNT催化剂的氢气产量随光照时间的变化示意图Fig. 6 Total hydrogen evolved upon time for the catalysts of Fe2O3-in-TNT and Fe2O3-out-TNT
对于TiO2纳米管与Fe2O3复合的催化剂,其光解水制氢的反应历程如图7所示。在可见光照射下,Fe2O3被激发产生光生载流子,光生空穴与水作用产生氧气和质子。由于Fe2O3的导带高于TiO2的导带,光生电子能够从Fe2O3的导带传输到TiO2的导带[30]。Pt沉积在TiO2纳米管表面,进一步提高了TiO2纳米管的电荷转移能力,TiO2导带的电子转移至金属Pt并与氢质子反应生成氢气。
TiO2纳米管限域Fe2O3能进一步提高光解水制氢性能,其原因可能有两个:(1)TiO2纳米管长度高达数百纳米,但其具有较小管径(约8~10 nm),构成了一个特殊的一维纳米限域空间。将Fe2O3限域于TiO2纳米管,可能使得Fe2O3具有较小颗粒尺寸和较高的分散度。由于量子尺寸效应,导致能带变宽[31],吸收带边蓝移,导带更负,提高电子由TiO2向Fe2O3传递的驱动力。(2)TiO2纳米管的限域效应对催化剂活性位与载体的电荷转移作用的影响。Fe2O3-in-TNT的结合能明显高于Fe2O3-out-TNT,导致管内形成Fe2O3的电子云密度较低,更有利于电子从Fe2O3转移至TiO2纳米管。另外TiO2纳米管的一维结构能够提供有效的电子传输通道,促进复合光催化剂中光生载流子的有效分离,进一步提高光催化活性[32]。
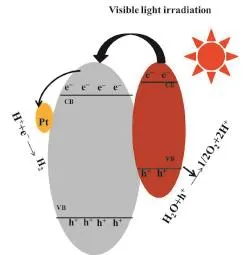
图7 可见光照射下Fe2O3、TiO2和Pt间的电子传输示意图Fig. 7 Suggested electronic transition among Fe2O3, TiO2and Pt under visible light irradiation
3 结 论
采用真空−超声辅助等体积浸渍法制备了TiO2纳米管限域Fe2O3催化剂,相比于简单浸渍法制备的TiO2纳米管负载Fe2O3催化剂,其具有较高的可见光光解水制氢效率。这可能是因为TiO2纳米管的限域效应导致Fe2O3颗粒减小,分散度提高,能隙增大,同时TiO2纳米管的一维结构提供有效的电子传输通道,促进复合光催化剂中光生载流子的有效分离,提高了其光催化制氢活性。
[1] Dresselhaus M S, Thomas I L. Alternative energy technologies[J]. Nature, 2001, 414(6861): 332-337.
[2] Tong H, Ouyang S X, Bi Y P, et al. Nano-photocatalytic materials: possibilities and challenges[J]. Advanced Materials, 2012, 24(2): 229-251.
[3] Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37-38.
[4] Gordon T R, Cargnello M, Paik T, et al. Nonaqueous synthesis of TiO2nanocrystals using TiF4to engineer morphology, oxygen vacancy concentration, and photocatalytic activity[J]. Journal of the American Chemical Society, 2012, 134(15): 6751-6761.
[5] Zou Z G, Ye J H, Sayama K, et al. Direct splitting of water under visible light irradiation with an oxide semiconductor photocatalyst[J]. Nature, 2001, 414(6864): 625-627.
[6] Kilic C, Zunger A. N-type doping of oxides by hydrogen[J]. Applied Physical Letters, 2002, 81(1): 73-75.
[7] 靳治良, 吕功煊. 光催化分解水制氢研究进展[J]. 分子催化, 2004, 18(4): 310-324.
[8] Sun J W, Zhong D K, Gamelin D R. Composite photoanodes for photoelectrochemical solar water splitting[J]. Energy& Environmental Science, 2010, 3(9): 1252-1261.
[9] Murphy A B, Barnes P R F, Randeniya L K, et al, Efficiency of solar water splitting using semiconductor electrodes[J]. International Journal of Hydrogen Energy, 2006, 31(14): 1999-2017.
[10] Sivula K, Formal F L, Gratzal M. WO3-Fe2O3photoanodes for water splitting: a host scaffold, guest absorber approach[J]. Chemistry of Materials, 2009, 21(13): 2862-2867.
[11] Cesar I, Sivula K, Kay A, et al. Influence of feature size, film thickness, and silicon doping on the performance of nanostructured hematite photoanodes for solar water splitting[J]. The Jouranl of Physical Chemistry C, 2009, 113(2): 772-782.
[12] Sivula K, Zboril R, Le Formal F, et al. Photoelectrochemical water splitting with mesoporous hematite prepared by a solution-based colloidal approach[J]. Journal of American Chemical Society, 2010, 132(21): 7436-7444.
[13] Cherepy N J, Liston B, Lovejoy J A, et al. Ultrafast studies of photoexcited electron dynamics in γ- and α-Fe2O3semiconductor nanoparticles[J]. The Jouranl of Physical Chemistry B, 1998, 102(5): 770-776.
[14] Gao L, Hu H, Li G J, et al. Hierarchical 3D TiO2@Fe2O3nanoframework arrays as high-performance anode materials[J]. Nanoscale, 2014, 6(12): 6463-6467.
[15] Guo S J, Pan X L, Gao H L, et al. Probing the electronic effect of carbon nanotubes in catalysis: NH3synthesis with Ru nanoparticles[J]. Chemistry-A European Journal, 2010, 16(18): 5379-5384.
[16] Pan X L, Fan Z L, Chen W, et al., Enhanced ethanol production inside carbon-nanotube reactors containing catalytic particles[J]. Nature materials, 2007, 6(7): 507-511.
[17] Fu Q, Li W X, Yao Y X, et al. Interface-confined ferrous centers for catalytic oxidation[J]. Science, 2010, 328(5982): 1141-1144.
[18] Deng D H, Yu L, Chen X Q, et al. Iron encapsulated within pod-like carbon nanotubes for oxygen reduction reaction[J]. Angewandte Chemie International Edition, 2013, 125(1): 389-393.
[19] Nishijima K, Fukahori T, Murakami N, et al. Development of a titania nanotube (TNT) loaded site-selectively with Pt nanoparticles and their photocatalytic activities[J]. Applied Catalysis A: General, 2008, 337(1): 105-109.
[20] Oshima T, Lu D L, Ishitani O, et al. Intercalation of highly dispersed metal nanoclusters into a layered metal oxide for photocatalytic overall water splitting[J]. Angewandte Chemie International Edition, 2015, 54(9): 2698-2702.
[21] Yang X, Yu X, Long L Z, et al. Pt nanoparticles entrapped in titanate nanotubes (TNT) for phenol hydrogenation: the confinement effect of TNT[J]. Chemical Communications, 2014, 50(21): 2794-2796.
[22] Yang X, Wu L P, Du L, et al. High performance Pd catalyst using silica modified titanate nanotubes (STNT) as support and its catalysis toward hydrogenation of cinnamaldehyde at ambient temperature[J]. RSC Advances, 2014, 4(108): 63062-63069.
[23] Long L Z, Yu X, Wu L P, et al. Nano CdS confined within titanate nanotubes for efficient photocatalytic hydrogen production under visible light illumination[J]. Nanotechnology, 2014, 25(3): 035603.
[24] Chen Q, Du G H, Zhang S, et al. The structure of trititanate nanotubes[J]. Acta Crystallographica Section B Structural Science, 2002, 58(1): 587-593.
[25] Qin L, Pan X X, Wang L, et al. Facile preparation of mesoporous TiO2(B) nanowires with well-dispersed Fe2O3nanoparticles and their photochemical catalytic behavior[J]. Applied Catalysis B: Environmental, 2014, 150-151: 544-553.
[26] Wu L P, Qiu Y, Xi M, et al. Fabrication of TiO2nanotubes-assembled hierarchical microsphere with enhanced photocatalytic degradation activity[J]. New Journal of Chemistry, 2015, DOI: 10.1039/C5NJ00373C. [27] Ohtsu N, Masahashi N, Mizukoshi Y, et al. Hydrocarbon decomposition on a hydrophilic TiO2surface by UV Irradiation: spectral and quantitative analysis using in-situ XPS technique[J]. Langmuir, 2009, 25(19): 11586-11591.
[28] Armelao L, Bertoncello R, Crociani L, et al. XPS and UV-VIS study of high-purity Fe2O3thin films obtained using the sol-gel technique[J]. J. Mater. Chem., 1995, 5(1): 79-83.
[29] Ismail A, Bahnemann D. Photochemical splitting of water for hydrogen production by photocatalysis: A review[J]. Solar Energy Materials & Solar Cells, 2014, 128: 85-101.
[30] Xia Y B, Yin L W. Core-shell structuredα-Fe2O3@TiO2nanocomposites with improved photocatalytic activity in the visible light region[J]. Physical Chemistry Chemical Physics, 2013, 15(42): 18627-18634.
[31] Wu Q, Ouyang J, Xie K, et al. Ultrasound-assisted synthesis and visible-light-driven photocatalytic activity of Fe-incorporated TiO2nanotube array photocatalysts[J]. Journal of Hazardous Materials, 2012, 199-200: 410-417.
[32] Baker D R, Kamat P V. Photosensitization of TiO2nanostructures with CdS quantum dots: Particulate versus tubular support architectures[J]. Advanced Functional Materials, 2009, 19(5): 805-811.
Fe2O3Confined within Titanium Nanotubes for Photocatalytic Hydrogen Production under Visible Light Illumination
WANG Wen-bo1,2, WU Liang-peng1, LI Xin-jun1
(1. Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China;2. University of Chinese Academy of Sciences, Beijing 100049, China)
A novel confinement catalyst, Fe2O3encapsulated in TiO2nanotubes (TNTs), was prepared by vacuum-assisted impregnation. Its photocatalytic activity towards hydrogen production under visible light illumination was evaluated. Fe2O3confined within TNT has the high dispersion, the smaller particle with larger bandgap compared with the catalyst loaded on the outside surface. And it exhibits enhanced photocatalytic activity for hydrogen evolution. It is attributed to the due to the effective separation of the photogenerated carriers as a result of the spatial confinement effect of TiO2nanotube.
confinement effect; water splitting towards hydrogen production; TiO2nanotubes; Fe2O3
TK01;O643.36
A
10.3969/j.issn.2095-560X.2015.03.013
2095-560X(2015)03-0239-06
王文博(1991-),男,硕士研究生,主要从事纳米催化材料的研究。
吴梁鹏(1983-),男,硕士,研究助理,主要从事能量转换材料、环境功能材料的研究。
李新军(1967-),男,博士,研究员,主要从事能量转换材料、环境功能材料的研究。
2015-05-12
2015-05-15
广州市科技计划项目(2013J4300035);广东省科技计划项目(2013B050800002);广东省水与大气污染防治重点实验室基金项目(2011A060901002)
† 通信作者:李新军,E-mail:lixj@ms.giec.ac.cn
