纤维质原料高浓度酶解技术研究现状及机理分析*
2015-01-04刘云云许敬亮孙永明袁振宏何敏超庄新姝
刘云云,张 宇,许敬亮,孙永明,袁振宏†,谢 君,何敏超,庄新姝
(1. 中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广州 510640;2. 华南农业大学生命科学学院,生物化学与分子生物学实验室,广州 510642)
纤维质原料高浓度酶解技术研究现状及机理分析*
刘云云1,2,张 宇1,许敬亮1,孙永明1,袁振宏1†,谢 君2†,何敏超1,庄新姝1
(1. 中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广州 510640;2. 华南农业大学生命科学学院,生物化学与分子生物学实验室,广州 510642)
高浓度酶解体系能够获得高糖浓度,显著提高单位设备利用率,减少酒精蒸馏等生产成本,具有较好的应用价值。本文在介绍高固含量底物酶解技术相关研究基础上,主要对高底物浓度水解体系下抑制因素进行了分析,同时对高浓高效酶解反应器的设计及开发进行探讨。高浓度酶解体系伴随水解液中高糖浓度和高的酒精得率,但是酶解转化率随着底物浓度增加而降低,这种抑制效应的出现受多种因素的影响,包括纤维素酶吸附量的下降、产物抑制、搅拌不均使传质传热受限体系粘度增大、水与底物的作用等,可通过改变反应温度、搅拌方式、添加表面活性剂、利用分批补料等酶解技术以改善体系酶解效率,使底物高效转化同时提高产物乙醇浓度,节约燃料乙醇生产成本。
纤维质原料;高浓度;酶解;抑制因素;固体效应;酶解反应器
0 引 言
木质纤维素原料是地球上最丰富的可再生资源,其纤维素含量可观,且大部分未被开发利用,通过热化学或生物法将其转化为绿色能源被认为是寻找替代石油、发展环境友好型新能源的最佳选择。纤维乙醇生产通常需要经过预处理、酶解和发酵过程的转化,而生产过程中的酶解糖化工艺直接关系糖产量和最终乙醇产率。
为了提高纤维乙醇的生产效率,国际上普遍采用酶解过程提高底物浓度的方法。高浓度底物水解已被证实能显著提高单位设备的生产效率,节约能耗,降低生产和设备成本[1,2]。但在底物浓度增加过程,反应体系粘度提高,出现传质及搅拌困难,再者,随着反应时间延长,酶分子易因搅拌在反应器中发生剪切失活等,导致酶解效率下降,低的原料转化率部分抵消了高浓度水解体系的优势[3]。改善高浓体系酶解率需降低其抑制因素的抑制作用,同时选择和设计新型低能耗高效率的酶解反应器。本文主要对高浓度底物酶解技术及其反应过程可能的抑制因素进行探讨,同时介绍了应用高固含量酶解技术相关中试及以上水平研究成果,并讨论了高效酶解反应器的开发和设计。
1 高浓度底物酶解过程抑制因素
高固体浓度对应在含水量低的水解体系进行酶解,通过增加底物含量获得高浓度糖液最终提高乙醇浓度,降低产物分离过程酒精的蒸馏成本。在低含水量条件下,系统容量增加,可减少能耗和热量消耗、混合物的冷却成本及废水产生量[4]。国外有报道评估:底物浓度从5%增加至8%时,乙醇生产总成本减少近20%[2]。继续增加底物浓度能进一步节约成本,但是研究表明,在底物浓度高于10%时纤维质原料开始不能有效转化,一次加料上限为12%~15%[2]。可能原因为,随着底物含量增加,终产物和抑制物相应增多,浆料粘度增大,底物得不到有效搅拌导致酶不能充分接触,高浓度的抑制作用逐渐增强,纤维素转化率随之下降[5]。
有学者通过建模分析对水解过程抑制机制做了探讨[6,7]。目前,低效转化率伴随的可能抑制因素包括产物抑制、其他化合物像半纤维素衍生的抑制剂和木质素等、传质限制或其他相关不溶性固体物质含量增加而对酶吸附产生影响、纤维素酶用量等(图1)。

图1 高浓度底物酶解过程可能的抑制因素Fig. 1 Factors limiting high solids enzymatic hydrolysis
2 高浓底物酶解技术
2.1 补料酶解
高浓度水解体系中由于抑制作用增强,酶解转化率随着底物浓度增加而下降。研究者们通过改变加料方式利用补料分批次操作将水解底物加入反应体系,即在初始底物水解一定时间后再补加进新鲜物料以减少一次加料引起的混合不均和搅拌等抑制问题,提高最终固体浓度[7]。分批补料的关键是确定反应过程补料时间和加料方式以及酶的添加次序以获得高的转化率[8]。补料过程部分底物和酶的不同添加方式见表1。
Hodge等[6]利用分批补料方式酶解25%(底物浓度)预处理后的玉米秸杆,在酶用量为10.7 FPU/g底物条件下,纤维素转化率达到80%,但是反应时间增加了一倍(168 h)。通过增加酶用量或者使用耐高糖浓度的酶可以缩短反应时间,Yang等[8]在酶用量为20 FPU/g底物、反应时间为30 h条件下分批补料酶解30%的底物,酶解转化率达70.6%。Ma等[9]分批酶解25%稀酸预处理后的木薯渣,分批加酶情况下底物转化率可达84%,而一次加料的转化率仅为50%。可见,高浓度底物分批补料酶解是提高原料转化率的有效方法。Rosgaard等[7]也对各种补料及加酶方式进行了研究,得出分批加料、一次加酶在最初反应过程可获得更高的糖含量,且葡萄糖最终浓度与加酶方式关系不大。另外,Chandra等[10]的研究表明,低浓底物酶解不适宜用分批补料。试验酶解10%汽爆后的玉米秸秆,酶用量为5 FPU/g和60 FPU/g底物,在一次加料情况下,葡萄糖得率分别为66%和90%,当底物分批加入后葡萄糖得率降为55%和80%,水解速率也相应降低。葡萄糖得率和反应速率下降可能是由于酶与木聚糖和木质素的无效结合或者纤维素酶无法从水解产物中解附而引起的。
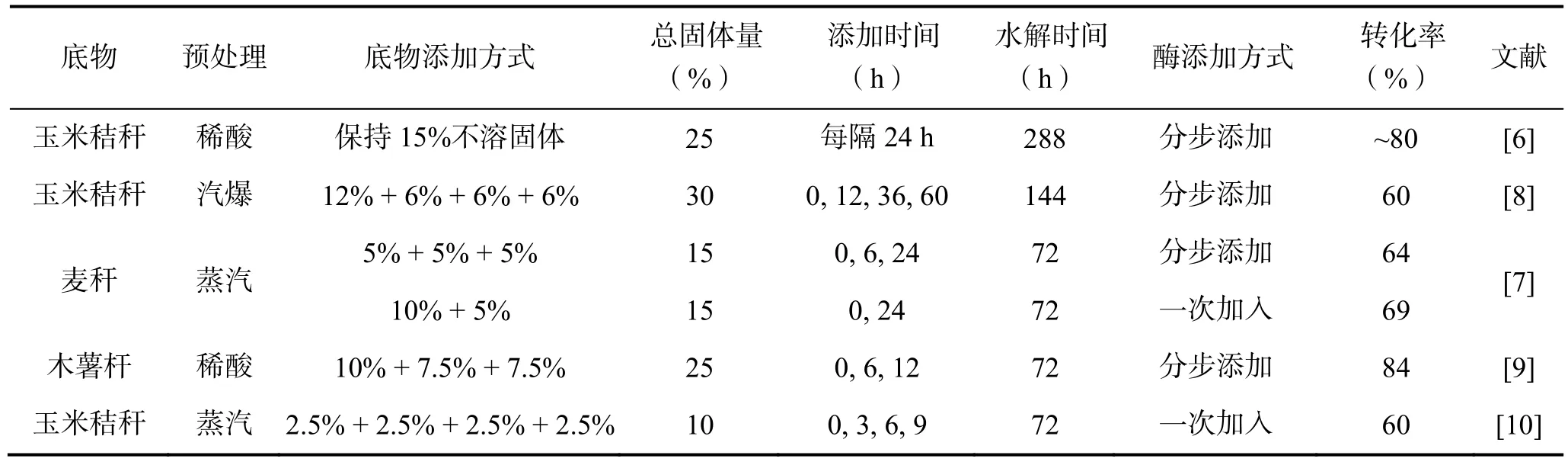
表1 分批补料酶解过程底物和酶的添加方式Table 1 Substrates and enzyme adding mode in fed-batch hydrolysis
2.2 水解酶类对高浓体系的影响
高浓度底物酶解过程原料转化率低主要是由于主产物糖部分以低聚物和聚合物的形式存在,不能用于后续发酵过程。研究者们从酶学角度进行分析实验,以多酶组合复配和替代酶进行研究。Lau等[11]利用除纤维素酶和β-葡萄糖苷酶之外的木聚糖酶和果胶酶以减少半纤维素对纤维素水解的阻碍作用。Xue等[1]将纤维素酶、β-葡萄糖苷酶和木聚糖酶进行组合水解蒸汽爆破麦秆,三者组合提高了纤维素转化率,尤其是对低浓和初始水解反应过程,混合酶的选用及组合比例对优化糖得率非常重要。
除了酶的添加机制和酶用量外,酶的类型对原料液化也有很大影响。商业用纤维素酶是粗酶混合物,如里氏木霉纤维素酶是纤维二糖酶、纤维内切酶、木聚糖酶和β-葡萄糖苷酶的混合物。这些酶可以协同作用或者分开使用。Sjizarto等[12]评估了酶对热化学法预处理麦秆的液化能力,结果显示纤维内切酶在纤维素糖化过程起关键作用,其单独使用可使系统粘度降低90%。纤维二糖酶和木聚糖酶对粘度降低几乎没有作用,即使在相同条件下糖得率和纤维内切酶相似。
里氏木霉纤维素酶系是研究中最常用的酶系,其他微生物在特定条件下也可能产生高性能的水解酶。Matano等[13]利用部分纯化的耐热芽孢杆菌产生的纤维素酶进行水解实验,快速酶解36 h后,芽孢杆菌纤维素酶与商业纤维素酶效果相当。用这种酶水解10%预处理后的牧草,96 h后葡萄糖收率在46.2%~48.7%之间。商业纤维素酶的成本很高,研究使微生物能同时产酶并糖化发酵纤维质底物是节约成本的有效途径。
3 固体效应分析
高浓度水解体系在获得高糖含量的同时,酶解转化率随固体浓度增加而呈下降趋势。Kristensen等[14]对这种固体效应产生的机制进行了分析,可能影响因素包括:底物成分和基质效应、产物抑制、水含量和纤维素酶的吸附。以滤纸为底物,当水解体系底物浓度增加时,酶解转化率与木质纤维素原料呈现相同的下降趋势。由此推断,木质素可能不是造成固体效应的因素。底物浓度在5%和20%体系中,酶解48 h考察产物抑制时发现完全不同的葡萄糖转化效果(64.5%和38.6%或者30 g/L和86 g/L)。但在以上两个体系都同时加入50 g/L的葡萄糖液底物最终转化率几乎相似(底物转化率分别为29.7%和26.3%或者64 g/L和109 g/L)。以上实验并没有解释出现相似转化率的原因,但可推测水解体系中有其他成分充当了产物抑制的角色或者葡萄糖浓度达到一定值后酶的活动都会被限制。
高效糖化的关键是酶与底物的有效接触,系统含水量过低,可能会直接影响酶的性能。在酶解过程中,溶剂水不仅作为底物和酶接触作用的先决条件,而且对整个反应过程中酶的运输机制和中间产物和终产品之间的质量传递机制至关重要。水可以增加底物表面润滑性,在给定剪切速率下降低所需的剪切应力进而降低体系粘度。不同物料的吸水性不同,当底物浓度达到20%时,只有少量游离水存在,底物表观粘度增加,搅拌和混合更加困难。含水量少、固体浓度过高可能直接影响酶的功能与酶解效率。
Kristensen等[14]研究了水含量对酶解体系的影响。乙醇可以维持体系粘度,以油醇替代体系中25%的自由水,减少水含量后酶解固液比发生变化,此时葡萄糖得率降低了5%。但是当底物浓度由20%增加到25%(相当于减少25%的水分),葡萄糖得率减少了12%。Kristensen等认为这种葡萄糖得率下降的差异表明含水量显然不是固体效应出现的限制因素。纤维素酶的吸附实验结果表明,当底物含量由5%增加至25%时,纤维素酶的吸附量由40%减少至17%,同时底物转化率由~60%降至<50%。底物转化率下降与酶的吸附量相关,表明纤维素酶没有有效吸附到底物上而导致葡萄糖得率下降。水解液中产物葡萄糖和纤维二糖的增加阻碍了纤维素酶的吸附,高浓度底物水解体系产物抑制机制和酶的吸附抑制机制研究是提高其整个水解过程转化效率的关键。
Roberts等[15]研究了在高浓度酶解过程体系粘度变化情况下水与底物的相互作用情况,将过量的葡萄糖和甘露糖添加到5%固含量的反应体系,其酶解效率下降至与15%固体浓度时相似。Roberts等认为水解率下降是由水被约束引起的,与单糖对酶活力的影响截然相反,很可能缺水限制了协同酶的均匀分布,进而影响了酶解速率。与Kristensen等的研究结论相反,Roberts等认为水(或者缺水)对整个酶解速率都有很大影响,前面研究中以油醇替代水来维持缺水条件下体系粘度不变,均衡的粘度使底物得到充足混合,因此不会影响整个环境酶的扩散与作用。但是这些研究结果与水对木质纤维素转化过程的影响相矛盾,他们强调了过程的有效搅拌。前期研究中通过油醇改善了高浓水解体系的粘度问题,底物即使在缺水条件下仍得到了充足搅拌,后期简单降低了液固比而未考虑体系的粘度。这些研究都突出了量化高浓度底物酶解过程单一抑制因素(缺水、高粘度、足够的搅拌等),而所有这些因素都是相互影响相互作用的。
4 体系粘度对底物混合的影响
在高浓水解体系中,由于底物得不到充分搅拌,水解产物和抑制物积累而使体系传质传热受到限制,使用粘度调节剂可以改善纤维底物的液化性能。Knutsen等[16]对18种不同化学添加剂对浆料流变性能和水解速率的影响进行了评估研究,一些表面活性剂如CPCL、CTAB、十二烷基苯磺酸钠(NaDBS)和十二烷基磺酸钠(SDS)等,在纤维浆料中的添加量为2%时,能明显影响浆料的流变性能,使体系粘度较不添加化学品的浆料粘度降低近4倍。Ma[9]等研究了表面活性剂Tween-80对酶解效果的影响,发现10%底物浓度时其并未显著提高酶解效率,但当底物浓度增加至25%时,添加2 g/L的Tween-80使酶解效率提高了30%。这些研究虽改善了体系粘度,但是作用机制和经济价值还有待进一步讨论。
提高水解反应温度是降低粘度的另一途径,因此耐高温纤维素酶是关键。Szijarto等[17]研究发现,来自耐热生物的EGs酶能较好降低纤维浆料的粘度。嗜热木霉EG酶在温度高达75℃时仍能继续降低体系粘度。不同来源纤维素酶的反应条件不同,温度、酶的组成及底物浓度都需要优化。
底物搅拌对纤维原料的转化有很大影响。Zhang等[18]发现在桩式搅拌反应器中酶解高浓度底物(17%~20%)的原料液化时间相对摇瓶大大缩短。混合搅拌器可使底物浓度达到35%,酶解反应1 h后底物开始液化,而在摇瓶中至少需要40 h。液化时间减少是由于反应器中底物及时得到有效的搅拌,同时大的纤维束被打断。反应器是节约能耗、解决搅拌问题的有效途径。高浓度底物节约了反应器数量,使单位反应器效率大大提高,但原料转化率随之降低,在给定条件下需要对系统运行的技术经济性做出分析。
5 高浓度底物酶解反应器的设计
目前高浓底物酶解主要采用水平反应器[19-21],底物在重力或自由下落过程通过划桨搅拌,使得颗粒沉淀和反应产物局部积聚减少至最小,同时保证酶的均匀分布。该反应器较易在实验室规模上进行放大,在相同搅拌条件下比立式搅拌器能量需求少[21]。
丹麦Dong能源公司现具有不同规模的水平反应器用于实验室和放大规模研究,并已成功研制工业化规模11 000 L容量的反应器[2,20]。这些反应器通常使用40%固含量的底物反应体系,纤维质大颗粒在机械搅拌下会被切割成细小纤维[20],这种剪切作用提高了底物的表面积,使酶与底物混合度提高。
叶轮的几何构型可影响酶解效率,Zhang等[18]研究了螺旋叶桨立式反应器酶解底物情况。与典型的Rushton叶轮划桨相比(图2a~2b),螺旋形叶轮桨更适于高粘度、非牛顿流体的搅拌,其各项性能都比Rushton叶轮桨好。其他几何学搅拌桨包括板框式叶轮搅拌器和双弯刀叶轮搅拌器(图2c~2d),都具有高效的转化率,其中板框式叶轮桨比双弯刀叶轮桨酶解转化率高近18%,板框式叶轮搅拌桨在反应器的每一深度具有更一致的搅拌混合机制,而轴向流双弯刀叶轮搅拌桨在轴与单片之间存在距离。
另一桩式搅拌桨反应器如图2e所示,其旋转轴配备有放射延伸状挂钩。在其9 L中试反应器中,水解20%(w/w)未漂白硬木木浆,浆料液化时间仅为1 h,较摇瓶40 h大为减少。此搅拌桨反应器已被证实对高浓纤维素原料有较好的糖化效果。
以上带不同类型搅拌桨的酶解反应器提供了提高高粘度浆料混合性能的不同方式。一个有效的混合机制较大程度由叶轮桨片的几何构型决定,在反应器中不同叶轮对浆料的作用依搅拌桨形状主要区别在搅拌速率和剪切效果上[22],以上这些研究在不同原料转化的实际应用中还需进一步探讨。
6 中试和示范工程
一些在中试水平运行的工厂不断上线,这些试点将为改善实验过程不能发现的难点问题提供有用价值。2010年,丹麦Dong能源公司下一子公司成立了年产530万L酒精的示范规模酒精厂,酶解过程中体系的底物浓度在25%~30%(w/w),酶用量较低为3~6FPU/gDM。但是其过程的每条线路都具备处理40%(w/w)底物浓度的能力[20,23],为扩大发展需要,该厂具有400 L~11 000 L等不同规模的反应器。另外,预处理和发酵过程底物浓度分别在20%~40%和~18%范围内,反应结束后,剩余富含木质素的底物(40%~95%)将被燃烧以热能和电能的形式回收利用在原料糖化过程。
美国国家可再生能源实验室最近将反应器容量扩增到4 000 L,用于底物浓度 ≥20%(w/w)的酶解体系[24]。转化过程设计为半连续运行,预处理在带划桨的水平反应器中进行,在液化24~30 h后,浆料加入立式搅拌槽进行酶水解反应。采用这种方式每天可将0.5~1 t干基生物质转化为乙醇。
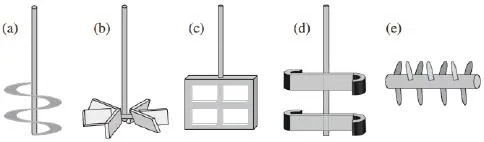
图2 用于高浓底物酶解的不同类型搅拌桨 (a) 水平搅拌桨, (b) 拉什顿搅拌桨, (c) 板框式搅拌桨, (d) 双弯刀搅拌桨, (e) 桩式搅拌桨Fig. 2 Different types of impellers used in high-solids enzymatic hydrolysis: (a) helical impeller; (b) rushton impeller; (c) plate-and-frame impeller; (d) double-curved-blade impeller; (e) peg mixer
7 燃料乙醇生产成本
燃料乙醇商业化发展主要依靠生产成本的降低。据彭博新能源财经报道,2012年,纤维素乙醇生产成本为0.94 $/L(3.56 $/gal),随着技术不断革新,有望在2016年与玉米乙醇生产成本持平降至0.67 $/L(2.54 $/gal)。据目前已有的半商业化工厂生产情况,燃料乙醇可以盈利的最低售价为0.94 $/L,比2008年小试规模成本1.75 $/L减少了46%。乙醇最低售价主要由生产成本决定,生产成本占总成本的41%,原料和酶分别占27%和16%。美国杰能科公司已成功将纤维素酶的生产成本降低至0.026~0.053 $/L,到2016年,通过不断研发,纤维素酶的成本有望降低到0.021 $/L[25]。加拿大Iogen公司合资投产了1.5万t/a的谷物转化装置,乙醇产量达到400万L/a,其采用新开发的酶和发酵技术可使乙醇生产成本降低至0.238 $/L,目前该公司谷物乙醇生产成本为0.291 $/L[26]。
提高乙醇得率可以减少成本,据彭博财经报道,每千吨玉米秸秆的最大理论乙醇产量为427 L。2008年,乙醇得率达到58%,2012年增加至66%,乙醇产率的提高使其最低售价降低了28%。以高底物浓度获得高产量的乙醇,在补料技术及相关机理研究基础上,不断改进酶解发酵过程,使底物高效转化同时提高产物乙醇浓度。据估计至2016年,乙醇得率有望最大可超过75%,2025年提高至96%[25]。
8 总 结
本文在介绍高浓底物酶解技术研究进展的基础上,对高浓酶解系统可能出现的抑制因素、固体效应出现的原因进行了分析,并讨论了相关反应器的设计,主要结论总结如下:
(1)分批补料系统能有效提高底物转化率,已被广泛应用于高浓度底物的转化过程;使用表面活性剂能改善底物粘度并已在实验室得到成功应用,但其经济性还有待研究。高浓度糖生产伴随低的原料转化率,水对整个反应过程的作用仍有争议,酶的成本居高不下,复合酶的添加能促进聚糖降解其添加方式需进一步优化;
(2)固体效应出现有很多影响因素,包括纤维素酶吸附量的下降,产物抑制,搅拌不均使传质传热受限体系粘度增大,水与底物的作用等,可通过改变反应温度、搅拌方式添、添加表面活性剂等改善体系的酶解效率;不同类型搅拌桨提供了改善底物粘度的不同方式,水平式混合反应器有较好的酶解效果,目前已被广泛应用至高浓底物酶解和其他工业过程。
(3)高浓度酶解体系伴随水解液中高糖浓度和高的酒精得率,节约了生产成本并降低能量消耗,相对中低浓度的反应系统其更具有应用价值。尽管高浓度底物酶解已经在中试规模得到成功应用,但是其低含水量、高粘度使得搅拌和传质过程受到限制,产物抑制物的增加使得反应时间延长、增加酶的成本等问题在其工厂化推广过程还需进一步讨论。
[1] Xue Y, Jameel H, Phillips R, et al. Split addition of enzymes in enzymatic hydrolysis at high solids concentration to increase sugar concentration for bioethanol production[J]. J Ind Eng Chem, 2012, 18: 707-707.
[2] Jorgensen H, Kristensen J B, Felby C. Enzymatic conversion of lignocellulose into fermentable sugars: challenges and opportunities[J]. Biofuels Bioproducts & Biorefining-Biofpr, 2007, 1(2): 119-134.
[3] Roche C M, Dibble C J, Knutsen J S, et al. Particle concentration and yield stress of biomass slurries during enzymatic hydrolysis at high-solids loadings[J]. Biotechnol Bioeng, 2009, 104(2): 290-300.
[4] Georgieva T I, Hou X R, Hilstorm T, et al. Enzymatic hydrolysis and ethanol fermentation of high dry matter wet-exploded wheat straw at low enzyme loading[J]. Applid Biochem. Biotech. 2008, 148(1/3): 35-44.
[5] Tolan J S. Logen’s process for producing ethanol from cellulosic biomass[J]. Clean Technologies and Environmental Policy, 2002, 3: 339-345.
[6] Hodge D B, Karim M N, Schell D J, et al. Model-based fed-batch for high-solids enzymatic cellulose hydrolysis[J]. Appl Biochem Biotechnol, 2009, 152(1): 88-107.
[7] Rosgaard L, Andric P, Dam-Johansen K, et al. Effects of substrate loading on enzymatic hydrolysis and viscosity of pretreated barley straw[J]. Appl Biochem Biotechnol, 2007, 143(1): 27-40.
[8] Yang J, Zhang X P, Yong Q A, et al. Three-stage enzymatic hydrolysis of steam-exploded corn stover at high substrate concentration[J]. Bioresource Technology, 2011, 102(1): 4905-4912.
[9] Ma X X, Yue G J, Yu J L, et al. Enzymatic hydrolysis of cassava bagasse with high solid loading[J]. J Biobased Mater Bioenergy, 2011, 5: 275-281.
[10] Chandra R P, Au-Yeung K, Chanis C, et al. The influence of pretreatment and enzyme loading on the effectiveness of batch and fed-batch hydrolysis of corn stover[J]. Biotechnol Prog, 2011, 27: 77-85.
[11] Lau M W, Gunawan C, Balan V, et al. Comparing the fermentation performance of Escherichia coliKO11, Saccharomyces cerevisiae424A (LNH-ST) and Zymomonas mobilis AX101 for cellulosic ethanol production[J]. Biotechnol Biofuels, 2010, 3: 11-11.
[12] Szijarto N, Siika-aho M, Sontag S T, et al. Liquefaction of hydrothermally pretreated wheat straw at high-solids content by purified Trichoderma enzymes[J]. Bioresource Technology, 2011, 102(1): 1968-1975.
[13] Matano Y, Hasunuma T, Kondo A. Display of cellulases on the cell surface of Saccharomyces cerevisiae for high yield ethanol production from high-solid lignocellulosic biomass[J]. Bioresource Technology, 2012, 108: 128-133. [14] Kristensen J B, Felby C, Jorgensen H. Yield-determining factors in high-solids enzymatic hydrolysis of lignocellulose[J]. Biotechnol Biofuels. 2009, 2: 11-11.
[15] Roberts K M, Lavenson D M, Tozzi E J, et al. The effects of water interactions in cellulose suspensions on mass transfer and saccharification efficiency at high solids loadings[J]. Cellulose, 2011, 18: 759-767.
[16] Knutsen J S, Liberatore M W. Rheology modification and enzyme kinetics of high solids cellulosic slurries[J]. Energy & Fuels, 2010, 24: 3267-3274.
[17] Szijarto N, Horan E, Zhang J H, et al. Thermostable endoglucanases in the liquefaction of hydrothermally pretreated wheat straw[J]. Biotechnol Biofuels, 2011, 4: 2-8.
[18] Zhang X, Qin W J, Paice M G, et al. High consistency enzymatic hydrolysis of hardwood substrates[J]. Bioresource Technology, 2009, 100: 5890-5897.
[19] Jorgensen H, Vibe-Pedersen J, Larsen J, et al. Liquefaction of lignocellulose at high-solids concentrations[J]. Biotechnol Bioeng, 2007, 96: 862-870.
[20] Larsen J, Petersen M O, Thirup L, et al. The IBUSprocesse lignocellulosic bioethanol close to a commercial reality[J]. Chem Eng Technol, 2008, 31: 765-772.
[21] Dasari R K, Dunaway K, Berson R E. A scraped surface bioreactor for enzymatic saccharification of pretreated corn stover slurries[J]. Energy & Fuels, 2009, 23: 492-497.
[22] Cao Y, Tan H M. The effect of shear field on the hydrolysis of cellulose[J]. J Macromolecular Science-Physics, 2004, 43: 1115-1121.
[23] Di Risio S, Hu C S, Saville B A, et al. Large-scale, high-solids enzymatic hydrolysis of steam-exploded poplar[J]. Biofuels Bioproducts & Biorefining-Biofpr, 2011, 5: 609-620.
[24] Tao L, Schell D, Davis R. NREL 2012 achievement of ethanol cost targets: biochemical ethanol fermentation via dilute-acid pretreatment and enzymatic hydrolysis of corn stover[R]. US: NREL, 2014.
[25] Erin V. Survey: cellulosic ethanol will be cost competitive by 2016[N]. Ethanol. 2013-3-18.
[26] Extensive coverage of refining industry news in the US-Americas, Europe/Middle East/Africa, and Asia-Pacific regions[R]. US: Worldwide refining business digest weekly, 2015.
Study on Enzymatic Hydrolysis Technology and Mechanism Based on High Solids Cellulose Substrate
LIU Yun-yun1,2, ZHANG Yu1, XU Jing-liang1, SUN Yong-ming1, YUAN Zhen-hong1, XIE Jun2, HE Min-chao1, ZHUANG Xin-shu1
(1. CAS Key Laboratory of Renewable Energy, Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China; 2. Institute of new energy and new materials, South China Agricultural University, Guangzhou 510642, China)
High solids hydrolysis is a direct and convenient technology to produce high concentration sugars, which can dramatically improve the utilization of the unit equipment and reduce purification costs. This review analyzed the inhibitory factors in high solids enzymatic hydrolysis system and discussed the reactors design operated at high solids loading for improving the system efficiency. Enzymatic hydrolysis at high solids loading can obtain high concentration sugars and ethanol, however, the enzymatic conversion efficiencies were decreased with the solids increasing. There were several factors contributed to this inhibitory effect, including the decline adsorption of the cellulase, inhibition from the hydrolysates, high viscosity caused by stirring and mixing difficulty, and lack of available water, etc. Enzymatic efficiency can be improved by altering the reaction temperature and stirring mode, using of surfactant and fed-batch saccharification strategy. The ethanol yield is therefore enhanced the production cost is saved.
lignocellulose; high solids; enzymatic hydrolysis; inhibited factors; solid effects; enzymolysis reactor
TK6
A
10.3969/j.issn.2095-560X.2015.03.004
2095-560X(2015)03-0184-07
刘云云(1985-),女,在职博士,助理研究员,主要从事木质纤维原料糖化与发酵技术研究。
2015-04-01
2015-04-15
国家自然科学基金(21306196,21176237,21211140237);广州科技项目(2013J4300026)
† 通信作者:袁振宏,E-mail:yuanzh@ms.giec.ac.cn;谢 君,E-mail:xiejun@scau.edu.cn
袁振宏(1953-),男,博士,研究员,博士生导师,主要从事生物质原料高效转化技术与工艺研究。
