淀粉酶产生菌MSP13筛选及其产酶条件初步优化
2015-01-03马晓梅
马晓梅,赵 辉*
淀粉酶产生菌MSP13筛选及其产酶条件初步优化
马晓梅,赵 辉*
(黑龙江大学生命科学学院,农业微生物技术教育部工程研究中心,黑龙江 哈尔滨 150080)
从优质白酒窖泥中分离筛选出13株产淀粉酶的兼性厌氧细菌,通过测定α-淀粉酶、β-淀粉酶、糖化酶和脱支酶酶活力,最终筛选出一株生产4种淀粉酶活力均相对较高的菌株,并对其进行形态观察,生理生化指标和16S rDNA鉴定,确定该菌株为解淀粉芽孢杆菌,并将其命名为MSP13。对菌株MSP13产酶条件进行初步优化,确定其产酶的较佳条件是:CaCl2质量浓度0.15 g/L、MgSO4·7H2O质量浓度0.3 g/L,pH 5.5和温度37℃。优化后的菌株MSP13生产4种酶的酶活力平均提高了31.645%。
淀粉酶;窖泥;鉴定;筛选;白酒
白酒是我国传统的发酵食品,因其独特的酿造工艺及其呈现的特殊风味,在世界酒类产 品中别具一格[1]。在传统固态浓香型白酒发酵中,窖泥是白酒风味形成的基础,长期的工艺操作使窖泥富集了种类繁多、功能各异的益于酿酒的微生物菌群[2-8]。中国浓香型白酒的生产基础是泥窖窖池,窖 泥中的微生物在发酵过程中起着举足轻重的作用[9]。要产好酒,就必须有优质的窖池,而优质的窖池其本质在于窖泥,优质的窖泥能产生香气,可大幅度提高白酒的档次[10]。窖泥中多种霉菌、酵母菌和细菌,是生产商品酶、多糖和抗生素等的主要发酵微生物[11]。在白酒生产中,淀粉酶起着液化和糖化的作用,是白酒出酒率的重要保证。因此通过筛选窖泥中高活力淀粉酶菌株,并应用于白酒发酵,将会明显提高白酒的出酒率。
从1963年起,日本研究者三田利用白曲霉(Aspergillus candidus Link)生产出一种酸性淀粉酶,适用于烧酒制备中淀粉原料的加工[12]。龙茜萍等[13]从贵州某酒厂大曲中分离得到一株产糖化酶活力较高的菌株,鉴定该菌株为黑曲霉(Aspergillus niger),该菌株可应用于白酒大曲的强化和处理酒糟;谢建华等[14]从南宁酒厂附近土壤中筛选到一株产淀粉酶的野生菌株GXBA-4,经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefacien);Rohban等[15]在伊朗高盐度湖泊中分离出49个极端嗜盐微生物,可产淀粉酶和蛋白酶等多种酶,并且鉴定了菌属;Norashirene[16]从马来西亚温泉中筛选出11株产淀粉酶的嗜热菌,经鉴定这些菌株为分枝杆菌属。张文丽等[17]从吉林某豆制品加工厂污水排放口处的土样中,分离筛选得到一株高产糖化酶的黑曲霉(Aspergillus niger)。近几年许多学者分别从富含淀粉的土壤样品、海洋泥中和污水排放口处的土样中,都筛选出产淀粉酶的菌株,并对其进行了鉴定[18-24]。
淀粉水解酶系是影响淀粉转化率及出酒率的主要因素[25]。α-淀粉酶为内切型水解酶,可以随机内切淀粉链的α-1,4糖苷键,产物为小分子糖和短链糊精的混合物[26]。β-淀粉酶是外切型水解酶,能从淀粉链的非还原性末端顺次切下一分子麦芽糖[27]。葡萄糖淀粉酶也是一种外切型水解酶,它从淀粉链的非还原末端顺序切开α-1,4-糖苷键生成一分子葡萄糖[28]。因此α-淀粉酶为β-淀粉酶和葡萄糖淀粉酶提供充足的淀粉链非还原末端,β-淀粉酶和葡萄糖淀粉酶将其水解为可发酵的糖类。淀粉脱支酶同α-淀粉酶和β-淀粉酶等水解酶不同,其作用对象为α-1,6-糖苷键,但它不能直接降解淀粉,只有当α-淀粉酶作用后才降解支链淀粉[29]。因此在白酒发酵过程中,只有在4种酶的共同作用下,才能使谷物中的直链和支链淀粉更好地被降解,从而提高出酒率。
本实验选取东北寒区优质老窖窖泥,利用五点取样法,从窖泥中分离、筛选高产淀粉酶(α-淀粉酶、β-淀粉酶、糖化酶、脱支酶)的细菌,以期筛选生产4种酶活性均较高的菌株,并对筛选出的菌株进行鉴定。细菌产4种淀粉酶的调控基因不同[26-28,30],其水解机制也不相同,但4种酶在最适温度、最适pH值及对金属离子的需求上有很大相似之处[31-34],因此优化最适的酶活性条件,以期提高4种淀粉酶的活力,使4种酶在一个最适的条件下协同作用,从而提高白酒发酵的原料利用率和出酒率。
1 材料与方法
1.1材料、试剂与培养基
窖泥来自黑龙江省富裕老窖酒业有限公司的优质老窖池。
DL15000 DNA Marker、细菌基因组DNA试剂盒生工生物工程(上海)股份有限公司;可溶性淀粉、支链淀粉哈尔滨宝信生物科技有限公司。
分离和保藏培养基:可溶性淀粉2 g、牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂20 g、蒸馏水1 000 mL,pH 7.0~7.2,固体加入15~20 g琼脂,121℃灭菌20 min。
发酵培养基:牛肉膏3 g、蛋白胨10 g、可溶性淀粉5 g、Na2HPO40.3 g、MgSO4·7H2O 0.5 g、NaCl 5 g、CaCl20.2 g、蒸馏水1 000 mL,pH 7.0,121℃灭菌20 min。
1.2仪器与设备
聚合酶链式反应(polymerase chain reaction,PCR)仪德国Biometra公司;DGGE电泳仪美国Bio-Rad公司;UV755B紫外分光光度计、FA1004电子天平上海精密科学仪器有限公司。
1.3方法
1.3.1样品采集
依据生态学原理,采用五点法对酒厂的优质窖池中的窖泥进行采集。取样自上而下,按4层分别采取,同一层面按中心部和周边部五点取样,并混合均匀作为1个样品,在室温下进行采样,记好标记,无菌密封,4℃冰箱保存。
1.3.2产淀粉酶菌株的初筛
称取窖泥1 g,放入盛有99 mL灭菌分离培养基的三角烧瓶中,静止培养24 h,吸取富集菌液0.5 mL,进行不同浓度梯度稀释,分别取0.1 mL涂布于分离培养基上,每个梯度做3个平行样,37℃倒置恒温培养24 h,用灭菌的牙签挑选单菌落,分别影印接种于2个新的分离平板,筛选出的菌落用卢戈氏碘液染色,产透明圈的为目的菌株。根据其菌落形态不同进行简单归类,并进行纯化保藏。
1.3.3高产淀粉酶菌株的复筛
测定初筛菌株的淀粉酶活力进行复筛。用发酵培养基对目的菌株进行培养,分别测定α-淀粉酶、β-淀粉酶、糖化酶和脱支酶的活力。
脱支酶活力单位定义为在45℃、pH 6.8条件下,1 min内水解支链淀粉产生1 μmol还原糖所需的酶量;α-淀酚酶与β-淀粉酶活力单位定义为在40℃、pH 5.6条件下,1 min内水解可溶性淀粉产生1 μmol还原糖所需的酶量;糖化酶活力单位定义为在30℃、pH 4.6条件下,1 min内水解可溶性淀粉产生1 μmol还原糖所需的酶量。4种酶活力均采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法确定[17,35-37]。
1.3.4菌株形态学及生理生化鉴定
参照《伯杰细菌鉴定手册》[38],对筛选出高淀粉酶活力的菌株进行形态学描述和生理生化鉴定。生理生化鉴定包括:甲基红实验、乙酰甲基甲醇实验、柠檬酸盐利用实验、多种糖发酵实验、好氧性实验、明胶液化实验、脲酶实验、蛋白胨水解实验、硫化氢实验、硝酸盐还原实验和过氧化氢实验等,每个实验重复3次[38-39]。
1.3.5菌株16S rDNA鉴定
1.3.5.1提取细菌基因组DNA
16S rDNA通用引物设计如下:正向引物8F:5’-AGAGTTTGATCCTGGCTCAG-3’;反向引物1512R:5’-ACGGCTACCTTGTTACGACTT-3’。
1.3.5.2 PCR扩增反应体系和程序
PCR扩增反应体系:10×PCR Buffer缓冲液2.5 μL,dNTP Mixture 2 μL,正向引物与反向引物各1 μL,DNA模板1 μL,去离子水17.3 μL,Taq DNA聚合酶0.2 μL,总计25 μL。
PCR扩增反应程序:94℃变性5 min,94℃变性0.5 min,56℃退火1 min,72℃延伸2 min,32个循环,72℃终延伸8 min,4℃保存。
1.3.5.3目的片段与载体连接
用TaKaKa连接试剂盒将回收产物连接至pMD19-T载体上,4℃反应过夜,利用质粒提取试剂盒将载体与DNA片段进行连接,连接目的产物转化至大肠杆菌DH5α感受态细胞,保存重组阳性克隆,并进行扩大培养,提取质粒,再次进行PCR 扩增。
1.3.5.4 16S rDNA片段的测序与系统发育分析
将PCR产物送至生工生物工程(上海)股份有限公司进行序列测定。再将测序所得到的16S rDNA序列与GenBank数据库进行BLAST比对分析,通过MEGA软件构建系统发育树。
1.3.6菌株MSP13生长曲线和淀粉酶活力的研究
将菌株MSP13进行培养,每2 h测定该菌的生长曲线和淀粉酶总酶活力,确定菌株MSP13的最佳培养时间。
1.3.7产淀粉酶条件的优化
将筛选出的菌株MSP13进行初步的产酶条件优化。培养基中CaCl2质量浓度分别为0、0.1、0.2、0.4、0.5 g/L;MgSO4·7H2O质量浓度分别为0.1、0.2、0.4、0.5、0.6 g/L;pH值分别为4.5、5.0、5.5、6.0、6.5、7.0;温度分别为28、31、35、37、39℃;按照上述条件每次只改变一个变量,5%的接种量,静止培养24 h后,测定菌液的淀粉酶活力,得到CaCl2和MgSO4·7H2O质量浓度、温度和pH值与淀粉酶活力的关系。再利用优化后的培养条件进行淀粉酶的生产,分别测定α-淀粉酶、β-淀粉酶、糖化酶和脱支酶的酶活力。
2 结果与分析
2.1高产淀粉酶细菌的分离筛选
初筛共获得53株菌株,根据透明圈大小比较,选出其中的13株菌株产淀粉酶的酶活力见表1。由表1可知,菌株MSP13的α-淀粉酶、β-淀粉酶、糖化酶和脱支酶的酶活力相对较高,分别为9.679、31.258、17.372、26.981 U/mL。因此确定MSP13作为后续进一步研究的菌株。

表1 13株菌所产4种酶的酶活力比较Table 1 Comparison of four enzyme activities from 13 strains
2.2菌株的鉴定
2.2.1筛选菌株的形态学观察及生理生化鉴定
对菌株MSP13进行形态学观察和生理生化鉴定,结果见表2和表3,从表中结果可初步鉴定菌株MSP13为芽孢杆菌属。

表2 菌株MSP13的形态特征Table 2 Morphological characteristics of MSP13

表3 菌株MSP13的生理生化实验结果Table 3 Physiological and biochemical tests of MSP13
2.2.2菌株MSP13的16S rDNA鉴定及系统发育分析
以菌株MSP13的基因组为模板,经PCR扩增,电泳检测,在1 000~2 000 bp处有一明亮的特征条带(图1)。
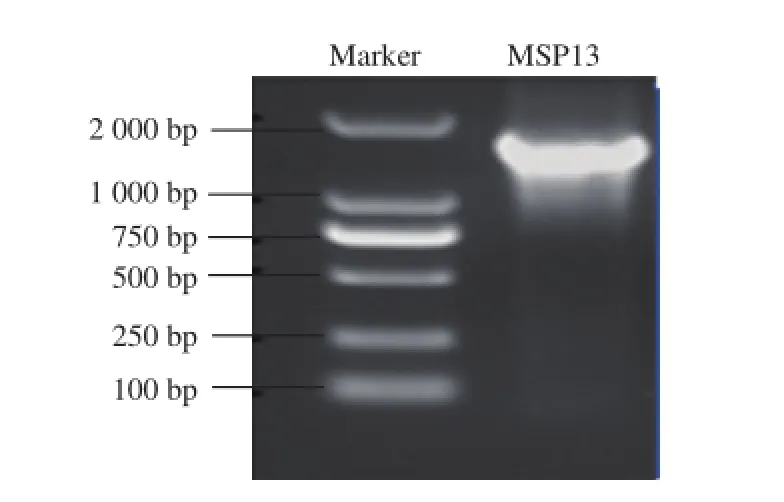
图1 菌株MSP13的16S rDNA PCR扩增产物电泳分析Fig.1 Electrophoresis of PCR-amplified products of 16S rDNA from MSP13
经测序,菌株MSP13的16S rDNA序列长1 439 bp,与GenBank数据库进行BLAST比对分析,利用DNAMAN软件绘制菌株的系统发育树,结果见图2。结合形态学观察和生理生化分析,可以确定菌株MSP13为解淀粉芽孢杆菌。
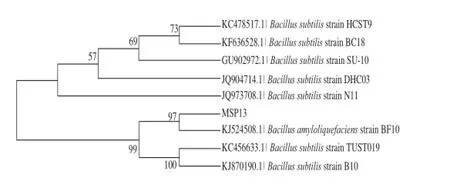
图2 菌株MSP13系统发育树Fig.2 Phylogenetic tree of MSP13
2.3菌株MSP13产淀粉酶条件的优化
2.3.1菌株MSP13的生长与淀粉酶合成规律

图3 菌株MSP13的生长曲线与产酶曲线Fig.3 Growth curve and enzyme-producing curve of MSP13
从图3可知,菌株MSP13的迟缓期为2~4 h,对数期为4~14 h,稳定期为14~18 h,衰亡期为18~24 h;同时18 h时酶活力较高,所以确定该菌株最佳培养时间为18 h。
2.3.2温度对菌株MSP13产淀粉酶酶活力的影响
温度对MSP13菌株产淀粉酶酶活力的影响见图4,在37℃时菌株MSP13所产淀粉酶的酶活力最大。
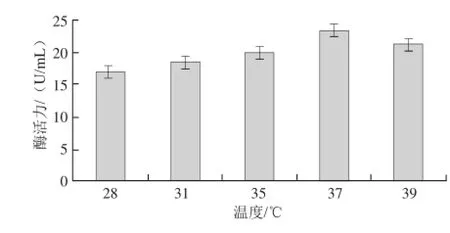
图4 温度对菌株MSP13产淀粉酶酶活力的影响Fig.4 Effect of temperature on the production of amylase from MSP13
2.3.3 pH值对菌株MSP13产淀粉酶酶活力的影响
pH值对菌株MSP13产淀粉酶酶活力的影响见图5,pH值为5.5时菌株MSP13所产淀粉酶的酶活力最高。
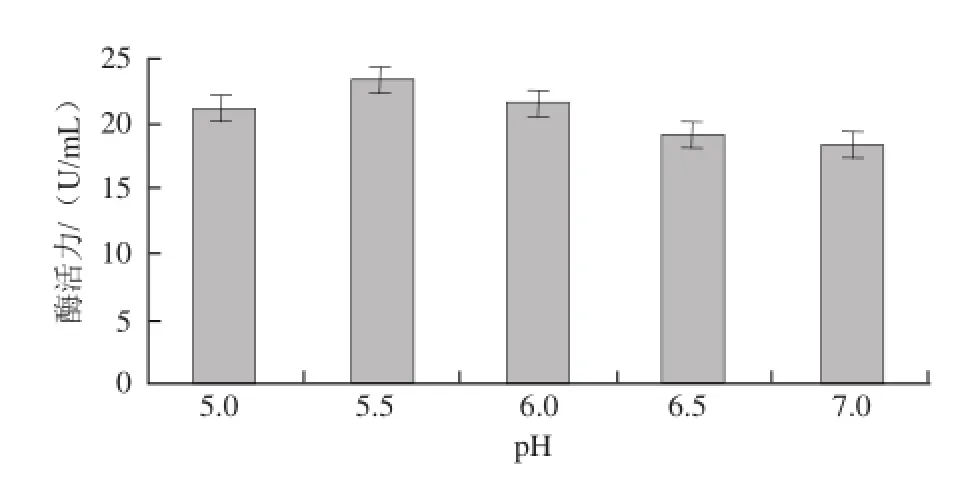
图5 pH值对菌株MSP13产淀粉酶酶活力的影响Fig.5 Effect of pH on the production of amylase from MSP13
2.3.4 CaCl2和MgSO4·7H2O对菌株MSP13产淀粉酶酶活力的影响
CaCl2和MgSO4·7H2O对菌株MSP13产淀粉酶酶活力的影响见图6,确定CaCl2质量浓度为0.15 g/L、MgSO4·7H2O质量浓度为0.3 g/L时菌株MSP13产淀粉酶的酶活力最高。

图6 aCl2和MgSOMgSO4·7H7H2O对菌株MSP13产淀粉酶酶活力的影响Fig.6 Effect of calcium and magnesium ions on the production of amylase from MSP13
用优化后的培养基(牛肉膏3 g/L、蛋白胨10 g/L、可溶性淀粉5 g/L、Na2HPO40.3 g/L、MgSO4·7H2O 0.3 g/L、NaCl 5 g/L、CaCl20.15 g/L,pH 5.5)进行37℃培养,测定菌株MSP13的α-淀粉酶、β-淀粉酶、糖化酶、脱支酶的酶活力分别为16.31、45.02、25.17、36.72 U/mL,4种酶活力平均提高了31.645%。
3 结 论
本实验从优质白酒窖泥中筛选出α-淀粉酶、β-淀粉酶、糖化酶和脱支酶活力均较高的菌株,并经形态学、生理生化和16S rDNA鉴定,确定该菌株为解淀粉芽孢杆菌,并将其命名为MSP13,对该菌株的培养基和培养条件进行了初步优化,确定该菌的最适培养温度为37℃,最适pH值为5.5,最佳CaCl2质量浓度为0.15 g/L,最佳MgSO4·7H2O质量浓度为0.3 g/L。优化后的α-淀粉酶、β-淀粉酶、糖化酶和脱支酶活力分别为16.31、45.02、25.17、36.72 U/mL,优化后4种酶活力平均提高了31.645%。
解淀粉芽孢杆菌在自然界中分布十分广泛,能够对多种真菌与细菌产生抑制作用[40-43],王奕文等[44]从不同甜瓜表面分离到1株解淀粉芽孢杆菌,对灰葡萄孢、链格孢、尖孢镰刀菌、黑曲霉和粉红单端孢等8种果蔬病原真菌有显著且广谱的拮抗作用。张淑梅等[45]从大豆中筛选到解淀粉芽孢杆菌TF2,证明其对大豆根腐病菌具有较强抑制作用。解淀粉芽孢杆菌也从动物粪便及肠道中分离得到,并将其作为益生菌添加剂添加到动物饲料中,有较好抑制致病菌的效果。Castro等[46]研究了解淀粉芽孢杆菌MIR-41产淀粉酶、普鲁兰酶和葡萄糖苷酶的情况。本实验选取东北寒区优质老窖窖泥,从窖泥中分离筛选出了产α-淀粉酶、β-淀粉酶、糖化酶、脱支酶4种酶活性均较高的解淀粉芽孢杆菌MSP13,该菌株来源于白酒窖泥,能适应白酒发酵环境,若应用于白酒发酵,在4种淀粉酶的协同作用下,可以大幅度提高淀粉的出酒率,对于白酒企业有很实际的应用价值。
[1]赵辉,敞颜,王葳,等.浓香型白酒窖泥中高产己酸兼性厌氧细菌的分离鉴定[J].食品科学, 2012, 33(5): 177-182.
[2]王化斌.泥窖在浓香型大曲白酒生产中的作用[J].酿酒科技, 2007(7): 65-67.
[3]王旭亮,王德良,韩兴林.白酒微生物研究与应用现状[J].酿酒科技, 2009(9): 88-91.
[4]张肖克,黄永光,胡晓瑜.窖泥糟醅发酵过程微生物多态性特征[J].酿酒科技, 2006(1): 65-72.
[5]罗惠波,甄攀,黄治国.浓香型白酒窖池细菌群落[J].微生物学通报, 2010, 37(11): 1621-1627.
[6]余有贵,李侦,熊翔,等.窖泥微生态的主要特征研究[J].食品科学, 2009, 30(21): 258-261.
[7] MAZZA P, MONCIARDINI P, CAVALETTI L, et al. Diversity of actinoplanes and related genera isolated from an Italian soil[J]. Microbial Ecology, 2003, 45(4): 362-372.
[8] AMANN R I, LUDWIG W, SCHLEIFER K H. Phylogenetic identifi cation and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59(1): 143-169.
[9]岳元媛,张文学,刘霞,等.浓香型白酒窖泥中兼性厌氧细菌的分离鉴定[J].微生物学通报, 2007, 34(2): 251-255.
[10]杨官荣,唐亚涛.人工窖泥的培养和应用[J].酿酒, 2010(1): 25-27.
[11] MURUGAN K, AJAR N Y, RAMESHWAR T. Deciphering the diversity of culturable thermotolerant bacteria from Manikaran hot springs[J]. Annals of Microbiology, 2014, 64: 741-751.
[12]高崎义幸.日本开发耐热耐酸性α-淀粉酶[J].日本食品工业, 1994, 30(6): 44-50.
[13]龙茜萍,王晓丹,谭静,等.一株高产糖化酶菌株的筛选与鉴定[J].酿酒科技, 2013(8): 7-9.
[14]谢建华,师永生,杜丽琴,等.一株产酸性α-淀粉酶菌株的筛选、纯化及酶学性质[J].应用与环境生物学报, 2011, 17(1): 95-99.
[15] ROHBAN R, AMOOZEGAR M A, VENTOSA A. Screening and isolation of halophilic bacteria producing extracellular hydrolyses from Howz Soltan Lake, Iran[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36(3): 333-340.
[16] NORASHIRENE M J, ROSLIZA S A, SHARINA M R N, et al. Screening and isolation of lipolytic, amylolytic and cellulolytic thermophiles from Hulu Langat hot spring, Selangor[C]//Business Engineering an d Industrial Applications Colloquium (BEIAC), 2012 IEEE. IEEE, 2012: 204-209.
[17]张文丽,于寒松,朴春红,等.一株高产糖化酶生产菌的筛选与鉴定[J].生物技术通报, 2013(7): 133-135.
[18]孙子羽,迟乃玉,王宇,等.低温生淀粉糖化酶菌株RS01分离及其酶学性质[J].微生物学通报, 2010, 37(6): 798-802.
[19]权淑静,马焕,谢复红,等.淀粉酶高产菌株筛选及发酵条件优化研究[J].河南科学, 2011, 29(10): 1185-1189.
[20]张继千,郑冰心,吴波,等.一株产淀粉酶海洋菌的筛选及发酵条件的研究[J].中国酿造, 2010, 29(5): 64-65.
[21]刘洋, 王一琰, 白黎婧,等.一株酸性淀粉酶产生菌的分离鉴定及其酶学性质研究[J].食品工业科技, 2014, 35(4): 174-178.
[22]张丽靖,沈江峰,金庆超,等.一株酸性淀粉酶产生菌的分离、鉴定及酶学特性初步研究[J].生物技术通报, 2011(5): 143-144.
[23] EZEJI T C, WOLF A, BAHL H. Isolation,characterization, and identification ofGeobacillus thermodenitrifi cansHRO10, anα-amylase andα-glucosidase producing thermophile[J]. Canadian Journal of Microbiology, 2005, 51(8): 685-693.
[24]姚作雄,陈晓霞,李雅芸,等.一株产中温淀粉酶芽孢杆菌的培养条件优化[J].中国酿造, 2012, 31(3): 48-53.
[25]张秀红,马冰,李素琴,等.清香型大曲淀粉水解酶测定方法研究[J].酿酒科技, 2012(10): 115-118.
[26]封棣,孟青青,王玉海,等. α-淀粉酶的基因改造与菌种选育研究进展[J].食品工业科技, 2014, 35(15): 381-385.
[27]张剑,林庭龙,秦瑛,等. β-淀粉酶研究进展[J].中国酿造, 2009, 28(4): 5-8.
[28]马丽娜,陈喜文,甘睿,等.葡萄糖淀粉酶的结构和功能研究进展[J].生物技术通讯, 2005, 16(6): 677-680.
[29]王红梅,潘仁瑞,吴茜茜,等.微生物脱支酶研究进展[J].现代农业科技, 2011(13): 41-43.
[30]王云飞,张伟丽,黄丹,等.淀粉脱支酶的研究进展及应用[J].中国酿造, 2008, 27(24): 25-26.
[31]周家华,黄立新,周俊侠,等. α-淀粉酶和葡萄糖淀粉酶协同水解淀粉的动力学研究[J].中国调味品, 1997(7): 11-12.
[32]王弋博,李博,李三相,等.异淀粉酶产生菌的分离纯化及生长特性[J].青海师范大学学报, 2013(1): 82-86.
[33]郝灵珍.啤酒生产过程中淀粉酶系变化动态、淀粉酶系及蛋白酶系对糖化产物影响的研究[D].青岛:中国海洋大学, 2012: 20.
[34]洪新,唐克.耐酸性α-淀粉酶产生菌发酵条件的优化[J].中国畜牧兽医, 2009, 36(1): 145-147.
[35]徐良玉,石贵阳,陶飞,等.快速筛选耐酸性α-淀粉酶生产菌株的平板透明圈法[J].无锡轻工大学学报, 2003, 22(5): 91-94.
[36]马晓军,张晓君,杨玲,等.支链淀粉酶产生菌的筛选及发酵条件的研究[J].兰州大学学报, 2001, 37(6): 81-85.
[37]马颖辉.高产淀粉酶及蛋白酶功能饲用菌的研究[D].大庆:黑龙江八一农垦大学, 2012: 13.
[38]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译.8版.北京:科学出版社, 1984: 729-795.
[39]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001: 253-298.
[40]张娟,杨彩梅,曹广添,等.解淀粉芽孢杆菌及其作为益生菌的应用[J].动物营养学报, 2014, 26(4): 863-867.
[41]胡苗清,姚明泽,张耀华,等.两株芽孢杆菌的鉴定及淀粉酶基因的克隆[J].华北农学报, 2011, 26(5): 103-106.
[42]罗佳捷,肖淑华,张彬,等.解淀粉芽孢杆菌的培养工艺及应用研究进展[J].饲料博览, 2014(5): 40-42.
[43]车晓曦,李校堃.解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的研究进展[J].北京农业, 2010(3): 7-10.
[44]王奕文,胡文冰,许玲,等.甜瓜果实表面生防芽孢杆菌的类群与鉴别[J].植物 病理学报, 2008, 38(3): 317-324.
[45]张淑梅,王玉霞,孟利强,等.内生解淀粉芽孢杆菌TF28液体发酵条件研究[J].东北农业大学学报, 2013, 44(11): 19-24.
[46] CASTRO G R, BAIGORÍ M D, MENDEZ B S, et al. Effects of pH and temperature on the continuous production of amylolyticenzymes by Bacillus amyloliquefaciens MIR-41[J]. Journal of Chemical Technology & Biotechnology, 1993, 58(3): 277-280.
Screening of Amylase-Producing Strain MSP13 and Optimization of Fermentation Conditions
MA Xiaomei, ZHAO Hui*
(Agricultural Microbiology Engineering Research Center, Ministry of Education, College of Life Science, Heilongjiang University, Harbin 150080, China)
Totally 13 strains of facultative anaerobic bacteria that can produce amylase were isolated from a highquality liquor pit mud. One strain was screened by determining the activities of α-amylase, β-amylase, glucoamylase and debranching enzyme. Through morphological observation, physiological and biochemical tests and molecular biological methods, the screened strain was identifi ed as Bacillus amyloliquefaciens and named as MSP13. Furthermore, the culture conditions for amylase production were optimized to be 0.15 g/L CaCl2, 0.3 g/L MgSO4·7H2O, pH 5.5 and 37℃.This strain under the optimal conditions could improve the four enzyme activities by 31.645% on average.
amylase; liquor pit mud; identifi cation; screening; liquor
Q815
A
10.7506/spkx1002-6630-201511034
2014-12-03
黑龙江省博士后科研启动基金项目(LBH-Q13139)
马晓梅(1987—),女,硕士研究生,研究方向为发酵工程。E-mail:759948123@qq.com
*通信作者:赵辉(1971—),男,副教授,博士,研究方向为发酵工程。E-mail:zhaohui9463@sohu.com
