乳酸链球菌素与植酸大豆蛋白复合膜的功能特性
2015-01-03杨万根李中茂朱秋劲田维江
杨万根,李 菲,李中茂,朱秋劲,田维江 3
乳酸链球菌素与植酸大豆蛋白复合膜的功能特性
杨万根1,李 菲1,李中茂1,朱秋劲2,田维江 3
(1.吉首大学食品科学研究所,湖南 吉首 416000;2.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;3.贵州罗汉食品有限公司,贵州 贵阳 550018)
为了开发新型大豆蛋白可食膜,将天然减菌剂乳酸链球菌素(Nisin)和植酸加入到大豆蛋白膜中,研究它们对膜的遮光、隔氧、阻湿功能及蛋白质交联度和膜结构的影响。结果表明:添加Nisin会引起大豆分离蛋白膜阻湿性和蛋白质交联度下降,但遮光性和隔氧性增强。植酸对膜的遮光性、阻湿性、隔氧性和蛋白质的交联度的影响与其添加量有关。电镜扫描分析结果表明,大豆分离蛋白膜表面平整光滑,添加了Nisin后,膜中出现复杂纹路,但仍然呈大理石状;继续加入植酸,膜的大理石状结构遭到了破坏。
可食膜;大豆分离蛋白;乳酸链球菌素;植酸;功能特性
可食膜是一种以多糖、蛋白质等天然可食性物质为原料制成的多孔网络结构薄膜,具有无环境污染,可作为营养强化剂、抗菌剂载体等优点[1-2]。以大豆分离蛋白为原料制备的可食膜因透气性低、蛋白质分子之间的交联作用强烈、膜的机械特性优异等优点而成为近年来可食膜的研究热点[3]。植酸是一种螯合能力强的天然添加剂,在食品工业中常作为抗氧化剂、稳定剂、护色剂、保鲜剂使用。Stodolak等[4]报道,植酸能有效降低生鲜牛肉和熟牛肉中硫代巴比妥酸值的累积,抑制生鲜牛肉中高铁肌红蛋白的形成。Nisin则是一种安全的生物防腐剂,在各类食品加工中已广泛应用[5]。可食膜的研究正由单一成分制膜向由多种生物大分子制成、具有多种功能性质的多组分复合膜方向发展[6],例如于有伟等[7]采用质量分数1%植酸壳聚糖复合涂膜处理鲜切莲藕,发现复合涂膜处理能够降低鲜切莲藕的质量损失率和丙二醛含量,延缓藕片的褐变,同时使VC和多酚含量维持在较高水平。目前,已有大量Nisin可食膜的研究报道[8-9]以及大豆分离蛋白复合可食膜的报道[10-12],但尚无Nisin植酸大豆蛋白复合可食膜的报道,因此本实验向大豆分离蛋白可食膜中引入植酸和Nisin,研究植酸和Nisin对膜的遮光、阻湿、隔氧等功能的影响,为新型可食膜的开发提供技术参考。
1 材料与方法
1.1材料与仪器
新鲜猪油购买新鲜肥猪肉自制;大豆分离蛋白粉安阳市奇天生物技术有限公司;Nisin浙江银象生物工程有限公司;植酸、甘油(分析纯)国药集团化学试剂有限公司。
722型可见分光光度计上海瞬宇恒平科学仪器有限公司;FUJIWARA游标卡尺浙江台州奇博工具有限公司;Quanta 200FEG扫描电子显微镜美国FEI公司。
1.2方法
1.2.1大豆蛋白抗菌膜的制备
膜的制备方法:称取2 g大豆分离蛋白粉,加入80 mL蒸馏水,待充分搅拌后,加入质量分数45%(甘油-大豆分离蛋白)的增塑剂甘油,在70℃的水浴中充分搅拌20 min,反应结束后,冷却至50℃,加入减菌剂,在50℃的水浴中继续充分搅拌3 min,成膜液冷却后倒在30 cm×30 cm光滑洁净玻璃板上展开,在室温下自然风干成膜备用。
加入减菌剂的剂量不同,得到11种不同的蛋白膜。N0+P0膜不含减菌剂,向其中加入Nisin使之终质量分数(下同)为1%、3%、5%、7%、9%,得到N1膜、N3膜、N5膜、N7膜、N9膜。向N9膜中加入植酸使之终质量分数为1%、3%、5%、7%、9%,得到N9+P1膜、N9+P3膜、N9+P5膜、N9+P7膜和N9+P9膜。
1.2.2膜的透光率测定
将膜切成1 cm×3 cm大小,贴在比色皿(1 cm)的一侧,在500 nm波长处测定其透光率,以空皿做空白。随后用游标卡尺在该膜上随机选取5个点测厚度,取其平均值。
1.2.3膜的水蒸气透过性测定
采用拟杯子法[13]:将待测的蛋白膜覆盖于装有无水硅胶的称量瓶口处,置于30℃、相对湿度为80%的干燥器中(内装饱和硫酸铵溶液),每12 h称量一次,持续1周。同时测定对应膜的厚度,以及瓶口的面积。通过杯质量的增加量确定水蒸气的透过量。计算公式如下:

式中:J为薄膜单位面积的透湿率/(g/(d·m2));WVP为薄膜的透湿系数/(g·mm/(m2·d·kPa));C为水蒸气通透速率/(g/d);X为膜厚度/mm;A为有效膜面积/m2;ΔP为膜两侧水蒸气压差/kPa。
1.2.4膜的交联度测定
根据O’Connel等[14]的方法,将反应后的成膜溶液冷却后,用去离子水稀释50倍,在440 nm波长处测定吸光度A440nm,以判断其交联度。
1.2.5膜的抗氧化性测定
称取适量新鲜猪油,盛于广口瓶中,用制备的膜覆盖,膜与瓶间接口用蜂蜡封住,以不覆盖任何物质及覆以保鲜膜的油瓶作对照。各样品置于60℃恒温箱中,1周后揭开膜,称取油样2~3 g,按GB/T 5009.37—2003《食用植物油卫生标准的分析方法》规定的方法测定其过氧化值(peroxide value,POV)。
1.2.6膜表面结构的测定
膜表面喷金,直接于扫描电子显微镜下观察,加速电压为5.0 kV[15]。
1.3数据处理
实验重复3次,结果取平均值。
2 结果与分析
2.1膜的透光率测定结果
Maran等[16]报道,可食膜的透光性受到塑化剂的影响,随塑化剂量的增加,透光性增强。但本实验膜配方中的塑化剂量固定,因此膜的透光性只受到Nisin和植酸添加量的影响。由图1可知,N0+P0膜的厚度最小,透光率最高,达到92.86%。N0+P0膜配方中加入1%Nisin得到N1膜,其厚度是N0+P0膜的1.81倍,但其透光率并没有大幅下降,为N0+P0膜的0.98倍。随着Nisin添加量从1%增加到9%,膜的厚度减小,但透光率不升反降,说明Nisin的添加量与膜的透光率呈负相关。

图1 不同膜的透光性Fig.1 Optical transmittance of various films
在N9膜配方中添加植酸,膜的透光率随植酸添加量的增大经历了升→降→升的变化。N9+P3膜比N9+P1膜多2%的植酸,厚度增加了0.4 ☒m,但透光率增加了7.08%,因此在1%~3%植酸添加量范围内,膜的透光率呈增加趋势。N9+P5膜的厚度比N9+P3膜减小1.7 ☒m,但透光率降低了11.7%,因此膜的透光率呈下降趋势。N9+P7膜和N9+P9膜的厚度比N9+P5膜分别增加0.5 ☒m和1 ☒m,但透光率反而增加了0.43%和7.67%,因此呈增加趋势。
复合膜的透光率可以作为判断共混体系中高分子相容性好坏的依据之一。若复合膜中高分子的相容性差,则会由于在两相界面上发生光散射或反射,致使膜的透光率变低[17]。图1中Nisin膜的透光率均大于80%,说明Nisin分子与大豆分离蛋白分子的相容性较好,但是Nisin的持续增加会使共混体系的不相容性增大,透光率降低。植酸是一种亲水性淡褐色浆状液体,它的加入有利于大豆分离蛋白分子和Nisin分子的相互作用,但它又与蛋白质(固相)不相容,使共混体系不相容性增大,因此植酸对膜的透光性影响是两者综合的结果。在1%~3%植酸添加量范围内,植酸的添加增大了大豆蛋白和Nisin分子的相容性,因此透光率增大。但植酸添加量为5%时,共混体系不相容性占据主导地位,透光率变小。之后继续加入7%、9%的植酸破坏了蛋白质网络结构,致使透光率增大。
2.2膜的阻湿性测定结果

图2 不同膜的阻湿性Fig.2 Water vapor barrier property of various films
透湿率和透湿系数越高,表明膜的水蒸气透过性越好。由图2可知,N0+P0膜中加入Nisin后,透湿系数有较小幅度的增加,这是由于Nisin与大豆分离蛋白分子之间缺乏极好的相容性,Nisin加入后破坏了原来大豆分离蛋白分子间的致密网状结构,致使膜的透水性增强。N9膜中添加1%植酸后,破坏了原来复合膜(Nisin+大豆蛋白)的固相致密结构,因此其水蒸气透过性比N9膜增强。但植酸的亲水性质又有利于Nisin和大豆分离蛋白分子的相互作用,因此在适量植酸作用下,膜的水蒸气透过性最低。整体上看,适当添加量的Nisin会增强大豆分离蛋白膜的水蒸气透过性,而植酸则因有增强复合膜中高分子的相容性的作用而呈现降低膜的水蒸气透过性的趋势。对于食品而言,低透湿率和透湿系数意味着水分蒸发降低,因此以N9+P3膜最佳。
2.3膜的阻氧性测定结果
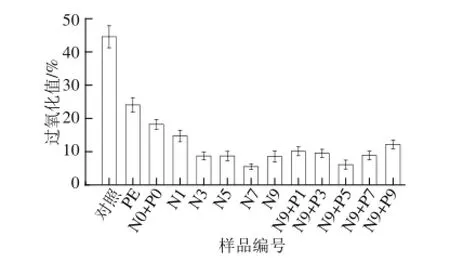
图3 不同膜的阻氧性Fig.3 Oxygen barrier property of various films
氧会影响到食品的保质期,将可食膜应用到食品中是一种解决食品保鲜的新方法[18]。Wihodo等[19]指出,蛋白膜是一种阻气性能优良的可食膜。由图3可知,N0+ P0膜比PE膜的阻氧性能更加突出。随Nisin添加量的增加,膜的阻氧性能逐步增强,在7%添加量时达到最大阻氧性能。植酸的加入,在起始1%添加量时,由于破坏了
Nisin和大豆分离蛋白分子间的致密结构,使膜的阻氧性能降低。但是继续增大植酸添加量,膜的阻氧性能又逐步增强,植酸添加量为5%时,即N9+P5膜的阻氧性能最佳。再增大植酸添加量,膜的阻氧性能又下降。实验中为了增大膜中抗菌物质Nisin的含量,选择了N9膜为基础添加植酸。但是就所有膜而言,N7膜的阻氧性能最佳,N9+P5膜次之。
2.4膜的交联度测定结果

图4 不同膜的交联度Fig.4 Degree of crosslinking of various films
膜中蛋白质的交联度与膜的遮光性、阻湿性和阻氧性等功能呈正相关[20]。膜的吸光度越高,说明膜中蛋白质的交联度越好。由图4可知,1%Nisin的加入破坏了大豆分离蛋白的交联,吸光度下降。但是3%的Nisin添加量促进膜的交联度提升,再继续加入Nisin会最终导致交联度的下降。这可能是因为Nisin为小分子多肽,适量的Nisin加入到蛋白质溶液中对蛋白质大分子交联起到一定的桥联作用,而过少或过多都会破坏蛋白质大分子之间的交联。Nisin的溶解度受到pH值的影响,在酸性环境中溶解度增大。在1%~5%植酸添加量区间内,植酸的加入明显降低了大豆蛋白成膜液中蛋白质的交联度。在5%~9%植酸添加量区间,随植酸添加量的增大,交联度又逐步升高。
2.5膜表面结构测定结果


图5 不同膜的扫描电镜图Fig.5 Scanning electron micrographs of various films
为掌握Nisin和植酸添加量对膜结构的影响,选取Nisin和植酸最大添加量的N9膜和N9+P9膜以及对照N0+ P0膜进行电镜扫描。张赟彬等[21]在研究中将大豆分离蛋白膜放大20 000倍和10 000倍,发现大豆分离蛋白膜上的蛋白分子排列密集,形成交织紧密的网状结构,使得膜具有较强的阻水性。图5中将3种膜放大3 000倍和1 000倍,发现N0+P0膜(大豆分离蛋白膜)表面平整光滑,呈大理石状。N9膜表面平滑度下降,有明显复杂纹路,但仍然呈大理石状,说明大豆蛋白分子和Nisin分子组成的共混体系的相容性下降。Resa等[22]报道,向木薯淀粉可食膜中加入Nisin,能使膜表面变得粗糙。Storia等[23]在研究中也发现Nisin能引起聚乙烯膜表面变得明显粗糙。在N9膜配方中再添加9%植酸后,N9+P9膜表面的大理石状结构遭到破坏,说明植酸加入破坏了蛋白质交联形成的网状结构,这与膜的透光性、透氧性、透湿性增大结果一致。
3 结 论
添加Nisin和植酸两种减菌剂对大豆蛋白膜的遮光、阻湿、隔氧等性能存在影响。大豆分离蛋白膜中添加Nisin会引起阻湿性下降,但遮光性和阻氧性增强。植酸的加入有利于大豆分离蛋白分子和Nisin分子的相互作用,但又会增大固-液相面,使共混体系不相容性增大,因此植酸对膜的遮光性、阻湿性、阻氧性的影响与其添加量有关。Nisin加入会导致膜中蛋白质交联度轻微的下降,而植酸对膜中蛋白质交联度的影响亦与其添加量有关。大豆分离蛋白膜表面平整光滑,呈大理石状。添加了Nisin后,膜表面虽然出现复杂纹路,但仍然呈大理石状;继续加入植酸后,膜表面变得粗糙,膜的大理石状结构遭到破坏。
[1] ELSABEE M Z, ABDOU E S. Chitosan based edible films and coatings: a review[J]. Materials Science and Engineering: C, 2013, 33(4): 1819-1841.
[2] ROJAS-GRA☒ M A, SOLIVA-FORTUNY R, MART☒N-BELLOSO O. Edible coatings to incorporate active ingredients to fresh-cut fruits: a review[J]. Trends in Food Science and Technology, 2009, 20(10): 438-447.
[3]贾云芝,陈志周.可食性大豆分离蛋白膜研究进展[J].包装学报, 2011, 3(3): 71-76.
[4]STODOLAK B, STARZYŃSKA A, CZYSZCZOŃ M,et al. The effect of phytic acid on oxidative stability of raw and cooked meat[J]. Food Chemistry, 2007, 101(3): 1041-1045.
[5]吕淑霞,白泽朴,代义,等.乳酸链球菌素(Nisin)抑菌作用及其抑菌机理的研究[J].中国酿造, 2008, 27(9): 87-92.
[6] BONILLA J, ATAR☒S L, VARGAS M, et al. Edible films and coatings to prevent the detrimental effect of oxygen on food quality: possibilities and limitations[J]. Journal of Food Engineering, 2012, 110(2): 208-213.
[7]于有伟,李惠,邸金花.壳聚糖植酸天然复合涂膜对鲜切莲藕保鲜效果的研究[J].中国食品学报, 2012, 12(3): 131-136.
[8] SANJURJO K, FLORES S, GERSCHENSON L, et al. Study of the performance of nisin supported in edible ☒lms[J]. Food Research International, 2006, 39(6): 749-754.
[9] SCAFFARO R, BOTTA L, GALLO G. Photo-oxidative degradation of poly(ethylene-co-vinyl acetate)/nisin antimicrobial films[J]. Polymer Degradation and Stability, 2012, 97(4): 653-660.
[10] WANG Le, XIAO Man, DAI Shuhong, et al. Interactions between carboxymethyl konjac glucomannan and soy protein isolate in blended films[J]. Carbohydrate Polymers, 2014, 101(30): 136-145.
[11] JIA Dongying, FANG Yu, YAO Kai. Water vapor barrier and mechanical properties of konjac glucomannan-chitosan-soy protein isolate edible films[J]. Food and Bioproducts Processing, 2009, 87(1): 7-10.
[12] CAO Na, FU Yuhua, HE Junhui. Preparation and physical properties of soy protein isolate and gelatin composite films[J]. Food Hydrocolloids, 2007, 21(7): 1153-1162.
[13]刘小玲.鸡骨明胶的制备、结构及功能性质研究[D].无锡:江南大学, 2005: 86.
[14] O’CONNELL J E, FOX P F. Proposed mechanism for the effect of polyphenols on the heat stability of milk[J]. International Dairy, 1999, 9(8): 523-536.
[15]张敏,施大文.八角莲及其近缘属植物叶表面的电镜扫描观察[J].中国中药杂志, 1998, 23(8): 451-511.
[16] MARAN J P, SIVAKUMAR V, SRIDHAR R, et al. Development of model for barrier and optical properties of tapioca starch based edible films[J]. Carbohydrate Polymers, 2013, 92: 1335-1347.
[17]张卉,宋妍,冷静.近红外光谱分析技术[J].光谱实验室, 2007, 24(3): 388-395.
[18] BONILLA J, ATAR☒S L, VARGAS M, et al. Edible films and coatings to prevent the detrimental effect of oxygen on food quality: possibilities and limitations[J]. Journal of Food Engineering, 2012, 110(2): 208-213.
[19] WIHODO M, MORARU C I. Physical and chemical methods used to enhance the structure and mechanical properties of protein ☒lms: a review[J]. Journal of Food Engineering, 2013, 114(3): 292-302.
[20] COMA V, SEBTI I, PARDON P, et al. Film properties from crosslinking of cellulosic derivatives with a polyfunctional carboxylic acid[J]. Carbohydrate Polymers, 2003, 51(3): 265-271.
[21]张赟彬,江娟.大豆分离蛋白可食膜的生产工艺及性能表征[J].食品科学, 2012, 33(6): 100-104.
[22] RESA C P O, JAGUS R J, GERSCHENSON L N. Effect of natamycin, nisin and glycerol on the physicochemical properties, roughness and hydrophobicity of tapioca starch edible films[J]. Materials Science and Engineering: C, 2014, 40(1): 281-287.
[23] STORIA A L, ERCOLINI D, MARINELLO F, et al. Characterization of bacteriocin-coated antimicrobial polyethylene films by atomic force microscopy[J]. Journal of Food Science, 2008, 73(4): 48-54.
Functional Properties of Soybean Protein Isolate-Based Complex Films with Nisin and Phytic Acid
YANG Wangen1, LI Fei1, LI Zhongmao1, ZHU Qiujin2, TIAN Weijiang3
(1. Institute of Food Science, Jishou University, Jishou 416000, China; 2. School of Liquor and Food Engineering,
Guizhou University, Guiyang 550025, China; 3. Guizhou Luohan Food Co. Ltd., Guiyang 550018, China)
To develop a new kind of edible film, the natural preservatives nisin and phytic acid were incorporated to the formula of soybean protein isolate (SPI)-based film, and the barrier properties to light, water vapor and oxygen of the developed edible films were studied as well as their degree of crosslinking and structure. The results showed that the addition of nisin could reduce the water vapor barrier properties and degree of crosslinking of the SPI film, but enhance its light and oxygen barrier properties. The influence of phytic acid on the barrier properties and degree of crosslinking of the film was correlated with its addition amount. The scanning electron microscope showed that the surface of SPI-based film was smooth. Its marble-like pattern was maintained but became more complicated after the addition of nisin. After the further addition of phytic acid, the marble-like pattern of the film was destroyed.
edible film; soybean protein isolated; nisin; phytic acid; functional property
TS206.4
1002-6630(2015)11-0071-04
10.7506/spkx1002-6630-201511014
2014-08-15
贵州省农业科技攻关项目(黔科合NY字[2011]3099号);吉首大学人才引进科研资助项目(8811310)
杨万根(1974—),男,讲师,博士,研究方向为肉制品深加工及食品生物技术。E-mail:yangwangen08@163.com
