15 种柑橘果实主要酚类物质的体外抗氧化活性比较
2015-01-03周志钦席万鹏
张 华,周志钦,席万鹏,*
15 种柑橘果实主要酚类物质的体外抗氧化活性比较
张 华1,2,周志钦1,3,席万鹏1,3,*
(1.西南大学园艺园林学院,重庆 400716;2.重庆三峡学院生命科学与工程学院,重庆 404100;3.南方山地园艺学教育部重点实验室,重庆 400715)
为了明确柑橘果实主要酚类物质单体的抗氧化活性差异,利用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiozoline-6)-sulphonic acid,ABTS)法、铁离子还原(ferric reducing/antioxidant power,FRAP)法3种离线法,以及两种在线高效液相色谱-DPPH/ABTS(high performance liquid chromatography-DPPH/ABTS,HPLC-DPPH/ABTS)柱后衍生系统联用技术分别对15种柑橘果实主要酚类物质单体的抗氧化活性进行测定和比较分析。结果表明:抗氧化活性综合(antioxidant potency composite,APC)指数可有效反应各单体的抗氧化活性,柑橘果实15种主要酚类物质抗氧化活性明显不同,4种酚酸的抗氧化活性最强,依次为:没食子酸(92.32%)>咖啡酸(85.29%)>绿原酸(69.75%)>阿魏酸(50.97%)。圣草酚(39.38%)、圣草次苷(39.36%)和芦丁(27.42%)的抗氧化活性中等,橙皮素、柚皮素、地奥司明、橙皮苷、川陈皮素、甜橙黄酮、柚皮苷和橘皮素的抗氧化活性较小(<5%)。酚羟基的糖基化或甲基化会都降低柑橘酚类物质的自由基清除能力,酚羟基数目越多,抗氧化活性越强。
酚酸;黄烷酮;抗氧化活性;DPPH法;ABTS法;铁离子还原法;高效液相色谱-柱后衍生系统联用技术
酚类化合物是植物次生代谢产物的最主要类型之一,目前已经在植物界鉴定到8 000种以上。酚类物质是具有一个或多个芳香环连接一个或多个羟基的一组化合物,主要由生物类黄酮、酚酸和单宁等三大类物质构成,各大类又由许多亚类物质组成[1]。柑橘是世界上第一大水果,其果实具有重要的营养、保健和医学价值。现有的流行病学研究表明,柑橘果实的营养保健价值与其丰富的酚类物质抗氧化活性密切相关[2]。柑橘果实中的酚类物质主要包括黄烷酮、多甲氧基黄酮和酚酸,其中包括橙皮素、柚皮素在内的15种酚类物质被认为在柑橘各代表类型的果实中广泛存在[3-4]。尽管目前已有研究报道了宽皮柑橘[5]、柚、酸橙[6]、甜橙、柠檬[7-9]的抗氧化活性,但大多数研究主要集中评价柑橘各代表类型或品种中酚类物质的总抗氧化活性上,目前,关于柑橘酚类物质单体抗氧化活性的相关研究仍比较少见,相关信息还比较缺乏。
抗氧化活性测定方法可分为体外和体内抗氧化方法或在线和非在线抗氧化方法等。体外抗氧化方法具有实验操作简单方便、成本较低等优点,应用较为普遍。体外抗氧化活性表现为抗氧化物质对自由基的清除能力,以及对于金属离子的还原能力。1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiozoline-6)-sulphonic acid,ABTS)法和铁离子还原(ferric reducing/antioxidant power,FRAP)法是3种常用体外抗氧化活性检测方法(“非在线”法)。随着高效液相色谱法(high performance liquid chromatography,HPLC)的不断发展,HPLC-DPPH和HPLC-ABTS联用技术(“在线”法)不仅可以用于分离分析提取物中成分和化合物的含量,还可在线快速分析单个化合物的抗氧化活性[10]。“非在线”法化学反应时间充分,可以从反应程度说明物质抗氧化活性强弱;“在线”法化学反应时间较短,则是从化学反应速率角度说明抗氧化活性强弱。但是,由于各种方法反应原理和条件不同,测定的结果并不完全一致,需要同时配合使用才可以提高评价的可靠性和准确性。
本实验使用ABTS法、DPPH法、FRAP法3种离线方法和HPLC-ABTS和HPLC-DPPH两种在线体外评价方法,对15种柑橘果实主要酚类物质单体的抗氧化活性进行比较分析和综合评价,旨在为柑橘资源的开发利用提供信息。
1 材料与方法
1.1试剂与材料
酚类标准物质单体:柚皮苷(纯度98%)、橙皮苷(纯度98.0%)、橙皮素(纯度97%)、圣草次苷(纯度98%)、芦丁(纯度99%)、地奥司明(纯度97.3%)、川陈皮素(纯度98%)、甜橙黄酮(纯度98.7%)、橘皮素(纯度98.1%)、阿魏酸(纯度99%)、没食子酸(纯度99%)、绿原酸(纯度98%)北京百灵威公司;圣草酚(纯度≥95.0%)、柚皮素(纯度95%)、咖啡酸(纯度≥98%)美国Sigma公司。15种常见酚类标准物质详细信息见表1。

表1 15 种柑橘果实主要酚类物质单体Table 1 Fifteen major phenolic monomers in citrus fruits
VC(L-ascorbic acid,纯度99%)北京百灵威公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、DPPH、ABTS、2,4,6-三吡啶基三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、色谱级甲酸美国Sigma公司;无水乙醇、冰醋酸、醋酸钠、氯化铁、NaHCO3等为分析纯天津光复精细化工研究所。
1.2仪器与设备
Milli-Q Advantage A10超纯水系统双蒸水制备仪美国密理博公司;电子天平(感量0.1 mg)德国赛多利斯集团;KQ-100B超声波清洗器昆山市超声仪器有限公司;LDL-5A菲恰尔离心机上海菲恰尔分析仪器有限公司;紫外-可见分光光度计美国铂金埃尔默公司。
Waters e2695型高效液相色谱分析系统(配有四元梯度泵、Waters XTerra MS C18保护柱(20 mm×3.9 mm,5 ☒m)、自动进样器、柱温箱、Waters 2998型光电二极管阵列PAD检测器)、Waters柱后反应系统(配有柱后衍生泵、柱后反应线圈、柱后衍生反应温度控制器、Waters 2489双通道紫外-可见光检测器)、Waters EmpowerTM2 Chromatography数据分析工作站美国Waters公司。
1.3方法
1.3.1 溶液的配制
准确称取15种酚类物质标准品单体固体粉末各10.00 mg,分别用DMSO溶解并定容至10.00 mL,配成1.00 mg/mL酚类标准物质贮备液,保存在-20℃冰箱中。
DPPH自由基溶液的配制:分别称取0.019 6 g DPPH粉末于500 mL甲醇溶液中,配制为0.1 mmol/L的DPPH自由基溶液,现配现用。
ABTS+·溶液的配制:5 mL ABTS(7 mmol/L)溶液和88 ☒L过磷酸钾水溶液(140 mmol/ L),混合避光反应12 h,得ABTS+·。取1 mL ABTS+·反应液加入100 mL无水乙醇,然后用无水乙醇逐级稀释至该溶液在400 nm波长处的吸光度为0.70±0.02。ABTS+·反应液在24 h之内用完。
1.3.2单体抗氧化活性的非在线测定
DPPH自由基抗氧化活性测定参照Brand-Williams等[11]的方法,稍作修改。准确吸取50 ☒L 1 mg/mL的酚类物质单体贮备液于玻璃试管中,之后加入3.0 mL 0.1 mmol/L DPPH甲醇溶液。将混合好的待测溶液,充分混匀,室温下避光静置30 min。测定517 nm波长处酚类物质吸光度,吸光度越低,表明样品抑制或清除自由基能力越强。添加等量的DMSO溶液作为空白对照组。每个分析样品重复3次。按照下式计算样品的DPPH自由基清除率。
式中:Ai为空白对照组的吸光度;Aj为加样品溶液的吸光度。
ABTS+·抗氧化活性的测定参照Arnao等[12]的方法,稍作修改。准确吸取50 ☒L 1 mg/mL的酚类物质单体贮备液,加入3 mL已经预先混合的ABTS反应试剂,充分混匀,室温反应10 min,在400 nm波长处测定吸光度。添加等量的DMSO溶液作为空白对照组。每个分析样品重复3 次。按照下式计算样品的ABTS+·抑制率。
式中:A0为空白对照组吸光度;At为样品溶液吸光度。
样品的FRAP值测定参照Benzie等[13]的方法。取50 ☒L提取物,加入3 mL已经预先混合的FRAP反应试剂(0.1 mol/LpH 3.6醋酸缓冲液、10 mmol/L TPTZ(溶于40 mmol/L盐酸)、20 mmol/L氯化铁以体积比10∶1∶1混合)。超声波振荡30 s,反应10 min,混合均匀后在593 nm波长处测定吸光度。以VC水溶液为标样,制作标准曲线,得到吸光度(y)与VC含量(x)之间的回归方程。样品的FRAP值(还原Fe3+的抗氧化活性)用VC当量抗氧化能力(ascorbic acid equivalent antioxidant capacity,AAEAC)来表示(mg/L)。每个样品重复测定3次。
1.3.3 HPLC-DPPH/ABTS抗氧化活性的在线测定
HPLC系统参数的设置参考张元梅等[3]已经报道的方法(略有改动)。Sunfire-C18柱(4.6 mm×250 mm,5 ☒m);流动相A:体积分数0.1%甲酸水溶液,流动相B:甲醇;梯度洗脱程序条件:0~20 min 37%~50%B;20~35 min 50%~80%B;35~40 min 80%~100%B;40~50 min 100%B;50~60 min 37%B,流速0.7 mL/min;柱温25℃;进样体积15 ☒L;检测波长设置为283、280、330、367、290、320 nm。同时进行200~600 nm全波段光谱扫描。
柱后衍生自由基分析系统参数的设置参见Jeon等[14]的方法,略有改动。0.1 mmol/L DPPH自由基溶液引入流速0.4 mL/min,检测波长517 nm;ABTS·+溶液(400 nm波长处吸光度为0.70±0.02),引入流速0.4 mL/min,检测波长400 nm,柱后温度25℃。
1.4数据处理
使用SPSS 17.0软件进行单因素方差分析和皮尔森相关性分析。采用Origin 7.5作图软件作图。所得数据用±s的形式表示。使用抗氧化活性综合(antioxidant potency composite,APC)指数法[15]进行酚类标准物质单体抗氧化活性比较,按照下式计算APC指数。
ABTS+·抑制率/%=
2 结果与分析
2.1基于DPPH法、ABTS法和FRAP法酚类物质单体抗氧化活性分析

表2 15种常见柑橘酚类标准物质的抗氧化活性Table 2 Antioxidant capacities of 15 major phenolics in citrus fruits
由表2可知,由DPPH法和ABTS法测定的15种酚类物质对DPPH自由基的清除率和ABTS+·的抑制率明显不同。在DPPH自由基捕获法中,15种酚类物质抑制DPPH自由基清除效果由大到小的顺序依次是:咖啡酸((32.47±5.96)%)和没食子酸((32.52±2.40)%)>绿原酸((26.67±2.42)%)>圣草酚((19.24± 2.34)%)>阿魏酸((17.36±1.32)%)>芦丁((15.06± 2.21)%)>其他酚类物质。3 种多甲氧基黄酮(川陈皮素、甜橙黄酮和橘皮素)的DPPH自由基清除率均较低。其中测得酚类物质的DPPH自由基清除率最高值(没食子酸,(32.52±2.40)%)是最低值(柚皮苷,(0.52±0.24)%)的62.54 倍。
在ABTS+·捕获法中,15 种酚类物质对ABTS+·的抑制效果由大到小的顺序依次是:没食子酸((62.16±4.48)%)>阿魏酸((57.24±1.36)%)>咖啡酸((25.69±2.41)%)>圣草酚((17.39±3.23)%)>圣草次苷((16.53±8.79)%)>绿原酸((16.06±1.21)%)>芦丁((13.04±1.77)%)>橙皮素((11.39±3.00)%)>柚皮素((10.98±0.95)%)>橙皮苷((5.97± 2.36)%)>地奥司明((5.71±2.58)%)>柚皮苷((2.61±0.95)%)>甜橙黄酮((0.99±0.10)%)>川陈皮素((0.99±1.84)%)>橘皮素((0.21±1.69)%)。其中测得酚类物质的ABTS+·抑制率最高值(没食子酸(62.16±4.48)%)是最低值(橘皮素(0.21±1.69)%)的296 倍。
在F R A P法测定方法中,1 5种酚类物质还原F e3+的抗氧化活性由大到小的顺序依次是:没食子酸((1 175.33±18.33)mg/L)>咖啡酸((1 002.29±32.50)mg/L)>绿原酸((876.22±26.89)mg/L)>阿魏酸((734.02± 17.47)mg/L)>圣草次苷((283.92±3.83)mg/L)>圣草酚((96.89±4.56)mg/L)>芦丁((18.97±3.24)mg/L)>柚皮苷、柚皮素、橙皮苷、橙皮素、地奥司明、川陈皮素、甜橙黄酮和橘皮素(均未检测到抗氧化活性)。其中没食子酸((1 175.33±18.33)mg/mL)的FRAP值是芦丁((18.97±3.24)mg/L)FRAP值的61.96倍。
2.2基于在线HPLC-DPPH/ABTS法酚类物质单体的抗氧化活性分析
在线HPLC-DPPH/ABTS抗氧化活性检测系统由HPLC系统和柱后衍生系统组成。HPLC系统用来检测有无酚类标准物质从色谱柱中被洗脱出来,如果相对于空白样品检测结果,检测到有正色谱峰说明有酚类物质被洗脱出来;反之则没有。柱后系统用来检测DPPH自由基溶液或者是ABTS+·溶液的光吸收响应值,在进样品之前,系统会自动将DPPH自由基溶液或ABTS+·溶液的光吸收数值归零。当有抗氧化物质清除掉DPPH自由基或ABTS+·时候,柱后系统便会检测出倒峰,色谱倒峰面积越大,代表其抗氧化活性越强。由表2可知,在1~8号生物类黄酮中,只有圣草酚、圣草次苷和芦丁检测出色谱倒峰。在9~11号3种多甲氧基黄酮均未检测出倒峰。12~15号4种酚类物质均检测出倒峰。HPLC-DPPH法测定的倒峰面积明显小于HPLC-ABTS法测得的峰面积。
利用HPLC-DPPH在线法检测酚类物质的倒峰面积由大到小的顺序是:咖啡酸((36.90±1.24)×105)>绿原酸((32.18±0.33)×105)>没食子酸((29.43±1.12)×105)>圣草酚((8.34±1.03)×105)>阿魏酸((5.86±0.09)×105)>芦丁((5.61±0.26)×105)>圣草次苷((5.28±0.20)×105)。HPLCDPPH在线法测得的倒峰面积最大值(咖啡酸(36.90±1.24)×105)是最小值(圣草次苷(5.28±0.20)×105)的6.99倍。
利用HPLC-ABTS在线法检测出酚类物质的倒峰面积由大到小的顺序是:咖啡酸((31.05±2.85)×106)和圣草次苷((29.16±1.36)×106)>没食子酸((25.42±3.15)×106)、圣草酚((24.51±0.70)×106)和绿原酸((24.58±0.23)×106)>芦丁((16.46±0.76)×106)>阿魏酸((9.64±0.12)×106)。HPLC-ABTS在线法测得的倒峰面积最大值(咖啡酸(31.05±2.85)×106)是最小值(阿魏酸(9.64±0.12)×106)的3.22倍。
2.3酚类物质单体的抗氧化活性综合评价
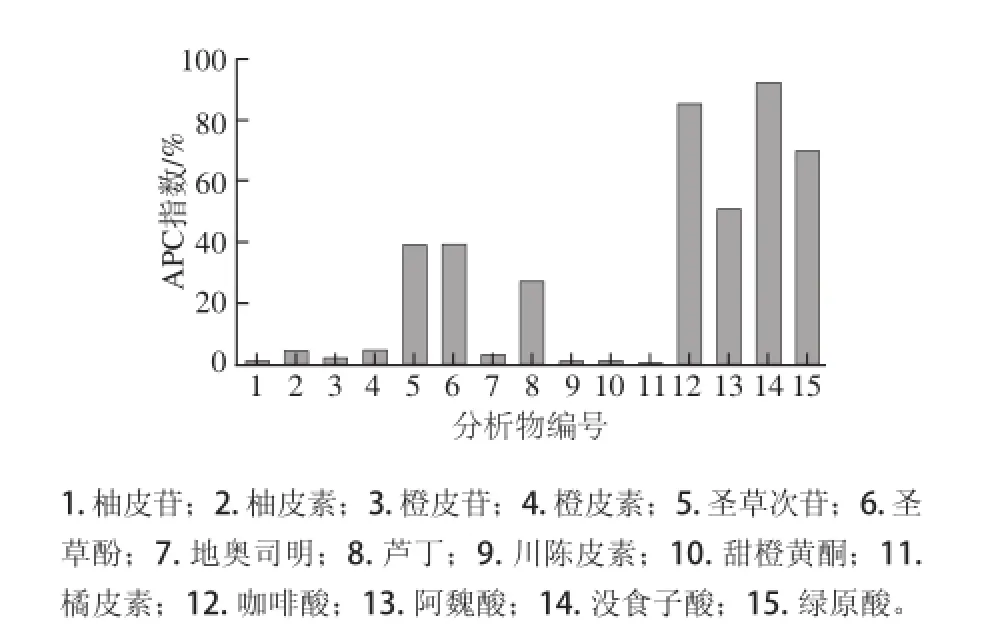
图1 15 种柑橘果实主要酚类物质抗氧化活性APC指数Fig.1 APC indexes for antioxidant activities of 15 major phenolics in citrus fruits

表3 15 种柑橘果实主要酚类物质抗氧化活性及排序Table 3 Ranking of 15 major phenolic compounds in citrus fruits by antioxidant activviittyy
由于各种化合物化学性质不同,且各种方法反应原理和条件也存在差异,因此,使用各种方法测定得到的抗氧化活性结果并不完全一致。如果能将各种测定方法的抗氧化活性结果综合起来,即可直接比较各种化合物的抗氧化活性差异[16-17]。本实验依据Seeram等[15]报道的APC指数法对5种测定结果进行了综合评价(图1和表3)。结果显示,APC指数由大到小的顺序是:没食子酸(92.32%)>咖啡酸(85.29%)>绿原酸(69.75%)>阿魏酸(50.97%)>圣草酚(39.38%)>圣草次苷(39.36%)>芦丁(27.42%)>橙皮素(4.88%)>柚皮素(4.78%)>地奥司明(3.24%)>橙皮苷(2.33%)>川陈皮素(1.18%)>甜橙黄酮(1.16%)、柚皮苷(1.16%)>橘皮素(0.41%)。其中没食子酸的APC指数(92.32%)最高,是橘皮素APC指数(0.41%)的225.17倍。APC指数显示排在前4位的都是酚酸,多甲氧基黄酮排在较后位置。未糖基化的黄酮类APC指数要大于糖基化的黄酮类化合物。
3 讨 论
大量研究表明,植物酚类物质具有抗氧化活性,能有效清除自由基,还原金属离子[2]。目前,少数柑橘酚类物质的抗氧化活性也已有报道,胡春等[18]发现橙皮苷具有清除羟自由基的作用。葡萄柚、橘、橙的果皮和果肉中的柚皮素和柚皮苷均有一定的抗氧化活性[19-22]。本研究结果表明,柑橘果实15种主要酚类化合物均都具有清除自由基和还原金属离子的能力(表1),各单体化合物抗氧化活性差异较大,依次为:没食子酸>咖啡酸>绿原酸>阿魏酸>圣草酚>圣草次苷>芦丁>橙皮素>柚皮素>地奥司明>橙皮苷>川陈皮素>甜橙黄酮>柚皮苷>橘皮素。孙丽萍等[23]对山奈酚、咖啡酸、异鼠李素、绿原酸、高良姜素和对香豆酸6种化合物的抗氧化活性进行了比较,结果显示抗氧化活性由强到弱的顺序为:山奈酚>咖啡酸>异鼠李素>绿原酸>高良姜素>对香豆酸。与本实验发现的咖啡酸抗氧化活性高于绿原酸抗氧化活性的结果相一致。本课题组前期的研究发现,14种野生宽皮柑橘果肉的抗氧化活性与总酚酸含量呈极显著正相关(P<0.01,DPPH:r= 0.843;FRAP:r= 0.917;ABTS:r= 0.907;氧自由基吸收能力(oxygen radical absorption capacity,ORAC):r=0.885),而与总黄酮呈显著正相关(P<0.05,DPPH:r= 0.643;FRAP:r= 0.638;ABTS:r=0.573;ORAC:r= 0.596),总酚酸含量高的品种其总抗氧化活性也显著高于其他品种[24],这与本研究发现的4种酚酸单体的抗氧化活性显著高于其他类黄酮的结果相一致。阿魏酸是14种野生宽皮柑橘果肉的主要酚酸,阿魏酸含量高的品种抗氧化活性也显著高于其他品种,这主要是由于果实的总抗氧化活性不仅与酚类化合物的抗氧化活性有关,而且与其在果实中的绝对含量也直接相关。
现有研究表明,植物酚类化合物的抗氧化活性差异不仅与酚羟基的糖基化、甲氧化以及酚羟基的数目和取代位置相关,也与C2、C3位双键的有无相关[25]。本实验结果表明,糖基化的酚类物质的抗氧化活性均低于相对应的酚类物质糖基配苷。如柚皮苷、橙皮苷和圣草次苷分别是柚皮素、橙皮素和圣草酚C7位羟基糖基化的产物,即糖基化的类黄酮抗氧化活性要小于相对应的糖基配苷。侯留鑫等[26]的研究结果显示,柚皮素的抗氧化活性显著大于柚皮苷。绿原酸与咖啡酸的不同在于咖啡酸的羧基被糖基化即为绿原酸,其抗氧化活性强于绿原酸,这与本实验结果相同。蒋柳云等[27]的报道显示,黄酮苷的抗氧化活性随着糖基中糖的增多而减小。侯留鑫等[26]的研究也证明了黄酮苷元的抗氧化活性大于黄酮糖苷,黄酮二糖苷的抗氧化活性大于黄酮四糖苷。有研究表明,黄酮类化合物羟基成苷后,原分子会失去络合过渡金属离子的能力,从而不能有效络合可以催化过氧化链式反应的一些重要金属离子,造成抗氧化活性降低[28]。
酚类物质羟基甲氧基化也会直接影响其抗氧化活性。川橙皮素、甜橙黄酮和橘皮素均属于多甲氧基黄酮。其结构特点是苯环上的羟基高度甲氧基化,没有酚羟基。本实验结果显示,3种多甲氧基黄酮抗氧化活性均较差。这可能是由于黄酮类化合物甲氧基化后,原分子氧糖苷的形成改变了分子的平面结构和亲脂性所致[29]。单杨等[30]研究发现,酚类物质羟基甲氧基化会降低酚类化合物的抗氧化活性。同时,羟基的糖基化或甲氧基化造成羟基数目的减少,也会降低其抗氧化活性[1]。如圣草酚的B环上有两个羟基,橙皮素和柚皮素的B环上有一个酚羟基,圣草酚的抗氧化活性强于橙皮素和柚皮素。其原因为酚羟基越多,则与活性自由基结合的氢原子也越多。当酚羟基与自由基结合后,由于羟基中氧原子的pπ共轭效应具有强烈的斥电子作用,使得与活性自由基反应后生成的酚类自由基更稳定[31],从而有利于清除自由基。
现有研究表明,黄酮类化合物B环上的羟基是黄酮类化合物抗氧化、清除自由基的主要活性部位[32]。本研究中,圣草酚B环上的邻二酚羟基表现出较强的抗氧化活性。此外,黄酮类化合物A环上C7位酚羟基也是一个重要的抗氧化活性基团。C7位酚羟基糖基化的柚皮苷、橙皮苷和圣草次苷与未糖基化的柚皮素、橙皮素和圣草酚相比,其抗氧化明显降低。黄酮类化合物C环上的C3位的羟基似乎对抗氧化活性不大。芦丁C3位具有糖基,但是芦丁仍然具有较强的抗氧化活性。这和Cholbi等[33]的研究结果一致,这可能是因为C3是醇羟基,其与酚羟基相比较稳定,不易失电子,可增加化合物的水溶性而对抗氧化活性意义不大。C2、C3位双键对抗氧化活性的影响说法不一。理论上分析,双键延长了共轭体系,有利于B环失电子后自旋形成更稳定的自由基从而中断链式反应。而一旦双键被氢化后,缩短了共轭体系,改变了分子的平面结构,降低了羟基的作用,黄酮类物质的抗氧化活性会降低。本研究发现,地奥司明和橙皮苷两者抗氧化活性差异不显著,证明C2和C3位双键的有无对黄酮类化合物抗氧化活性影响不大,这与Husain等[31]的研究结果相一致。Mora等[34]研究指出,芹菜素C2、C3位双键氢化为柑橘素后,抗氧化活性下降很大,双键对活性影响较大。
4 结 论
柑橘果实酚类物质的抗氧化活性明显不同,在检测的15种柑橘主要酚类物质中,没食子酸、咖啡酸、绿原酸和阿魏酸4种酚酸的抗氧化活性最强,圣草酚、圣草次苷和芦丁的抗氧化活性中等,橙皮素、柚皮素、地奥司明、橙皮苷、川陈皮素、甜橙黄酮、柚皮苷和橘皮素的抗氧化活性最低,柑橘酚类化合物的抗氧化活性差异主要与酚羟基的结构修饰密切相关。
[1] BALASUNDRAM N, SUNDRAM K, SAMMAN S. Phenolic compounds in plants and agri-industrial by-products: antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006, 99(1): 191-203.
[2] FUKUMOTO L R, MAZZA G. Assessing antioxidant and prooxidant activities of phenolic compounds[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3597-3604.
[3]张元梅,周志钦,孙玉敬,等.高效液相色谱法同时测定柑橘果实中18种类黄酮的含量[J].中国农业科学, 2012, 45(17): 3558-3565.
[4]冉玥,焦必宁,赵其阳,等.超高效液相色谱法同时测定柑橘中11种类黄酮物质[J].食品科学, 2013, 34(4): 168-172.
[5] ZHANG Yuanmei, SUN Yujing, XI Wanpeng, et al. Phenolic compositions and antioxidant capacities of Chinese wild mandarin (Citrus reticulataBlanco) fruits[J]. Food Chemistry, 2014, 145: 674-680.
[6] TRIPOLI E, GUARDIA M L, GIAMMANCO S, et al.Citrusflavonoids: molecular structure, biological activity and nutritional properties: a review[J]. Food Chemistry, 2007, 104(2): 466-479.
[7] ABAD-GARCIA B, GARMON-LOBATO S, BERRUETA L A, et al. On line characterization of 58 phenolic compounds incitrusfruit juices from Spanish cultivars by high-performance liquid chromatography with photodiode-array detection coupled to electrospray ionization triple quadrupole mass spectrometry[J]. Talanta, 2012, 99: 213-224.
[8] GOULAS V, MANGANARIS G A. Exploring the phytochemical content and the antioxidant potential ofcitrusfruits grown in Cyprus[J]. Food Chemistry, 2012, 131(1): 39-47.
[9] KELEBEK H, CANBAS A, SELLI S. Determination of phenolic composition and antioxidant capacity of blood orange juices obtained from cvs. Moro and Sanguinello (Citrus sinensis(L.) Osbeck) grown in Turkey[J]. Food Chemistry, 2008, 107(4): 1710-1716.
[10]耿雪飞,郑永杰,赵明.基于HPLC-ABTS体系筛选细叶杜香抗氧化活性成分[J].化学工程师, 2011(10): 70-73.
[11] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30.
[12] ARNAO M B, CANO A, ACOSTA M. The hydrophilic and lipophilic contribution to total antioxidant activity[J]. Food Chemistry, 2001, 73(2): 239-244.
[13] BENZIE I F F, CHUNG W Y, STRAIN J J.“Antioxidant”(reducing) efficiency of ascorbate in plasma is not affected by concentration[J]. The Journal of Nutritional Biochemistry, 1999, 10(3): 146-150.
[14] JEON Y E, LEE Y S, LIM S S, et al. Evaluation of the antioxidant activity of the fruiting body ofPhellinus linteususing the on-line HPLC-DPPH method[J]. Journal of the Korean Society for Applied Biological Chemistry, 2009, 52(5): 472-479.
[15] SEERAM N P, AVIRAM M, ZHANG Yanjun, et al. Comparison of antioxidant potency of commonly consumed polyphenol-rich beverages in the United States[J]. Journal of Agricultural and Food Chemistry, 2008, 56(4): 1415-1422.
[16]王华磊,冯建荣,樊新民,等.新疆17个杏品种的抗氧化指标与总酚含量的测定[J].果树学报, 2008, 25(6): 828-831.
[17]裴世春,徐玖亮,商亚芳. HPLC-ABTS+·在线法筛选细叶杜香叶部抗氧化活性成分[J].食品科学, 2012, 33(19): 88-91.
[18]胡春,丁霄霖.黄酮类化合物在不同氧化体系中的抗氧化作用研究[J].食品与发酵工业, 1996, 22(3): 46-53.
[19] ORTUNO A, GARCIA-PUIG D, FUSTER M D, et al. Flavanone and nootkatone levels in different varieties of grapefruit and pummelo[J]. Journal of Agricultural and Food Chemistry, 1995, 43(1): 1-5.
[20] AUNER B G, WIRTH M, VALENTA C. Antioxidative activity and cytotoxicity of four different flavonoids for dermal applications[J]. Journal of Drug Delivery Science and Technology, 2005, 15(3): 227-232.
[21] JEON S M, BOK S H, JANG M K, et al. Comparison of antioxidant effects of naringin and probucol in cholesterol-fed rabbits[J]. Clinica Chimica Acta, 2002, 317(1): 181-190.
[22] OZYURT D, DEMIRATA B, APAK R. Determination of total antioxidant capacity by a new spectrophotometric method based on Ce (IV) reducing capacity measurement[J]. Talanta, 2007, 71(3): 1155-1165.
[23]孙丽萍,穆雪峰,施海燕,等.北京洋槐蜜化学成分及其抗氧化活性[J].食品科学, 2012, 33(9): 77-80.
[24] XI Wanpeng, ZHANG Yuanmei, SUN Yujing, et al. Phenolic composition of Chinese wild mandarin (Citrus reticulataBalnco.)pulps and their antioxidant properties[J]. Industrial Crops and Products, 2014, 52(1): 466-474.
[25]胡春.黄酮类化合物的抗氧化性质[J].中国油脂, 1996, 21(4): 18-21.
[26]侯留鑫,王华清,郑铁松,等.一种新型茶叶籽黄酮单体的分离鉴定及其抗氧化活性[J].食品科学, 2013, 34(21): 115-120. doi: 10.7506/ spkx1002-6630-201321024.
[27]蒋柳云,刘玉明.黄酮类化合物抗氧化活性的构效关系研究[J].化学研究与应用, 2004, 16(4): 510-512.
[28] van ACKER S A B E, de GROOT M J, van DEN BERG D J, et al. A quantum chemical explanation of the antioxidant activity of flavonoids[J]. Chemical Research in Toxicology, 1996, 9(8): 1305-1312.
[29] BORS W, HELLER W, MICHEL C, et al. Flavonoids as antioxidants: determination of radical-scavenging efficiencies[J]. Methods in Enzymology, 1990, 186: 343-355.
[30]单杨,李高阳,李忠海.柑橘皮中多甲氧基黄酮的体外抗氧化活性研究[J].食品科学, 2007, 28(8): 100-103.
[31] HUSAIN S R, CILLARD J, CILLARD P. Hydroxyl radical scavenging activity of flavonoids[J]. Phytochemistry, 1987, 26(9): 2489-2491.
[32]陈琪,王伯初,唐春红,等.黄酮类化合物抗氧化性与其构效的关系[J].重庆大学学报, 2003, 26(11): 48-55.
[33] CHOLBI M R, PAYA M, ALCARAZ M J. Inhibitory effects of phenolic compounds on CCl4-induced microsomal lipid peroxidation[J]. Experientia, 1991, 47(2): 195-199.
[34] MORA A, PAY☒ M, R☒OS J L, et al. Structure-activity relationships of polymethoxyflavones and other flavonoids as inhibitors of nonenzymic lipid peroxidation[J]. Biochemical Pharmacology, 1990, 40(4): 793-797.
Comparison of Antioxidant Activity in vitro of 15 Major Phenolic Compounds in Citrus Fruits
ZHANG Hua1,2, ZHOU Zhiqin1,3, XI Wanpeng1,3,*(1. College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400716, China; 2. College of Life Science and Engineering, Chongqing Three Gorges University, Chongqing 404100, China; 3. Key Laboratory of Horticulture for Southern Mountainous Regions, Ministry of Education, Chongqing 400715, China)
The antioxidant activities of 15 major phenolic compounds in citrus were evaluated by 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2’-azino-bis (3-ethylbenzthiozoline-6)-sulphonic acid (ABTS) radical scavenging capacity and ferric reducing/antioxidant power (FRAP) assays alone and in combination with high performance liquid chromatography-DPPH/ABTS (HPLC-DPPH/ABTS) post-column reaction system. The results showed that the antioxidant potency composite (APC) index was a valid comprehensive index for evaluating antioxidant activities of phenolic compounds, and an obvious difference in antioxidant activities of these major phenolic compounds was observed. Four phenolic acids had the highest antioxidant activities in the declining order of gallic acid (92.32%) > caffeic acid (85.29%) > chlorogenic acid (69.75%) > ferulic acid (50.97%), eriodictyol (39.38%), eriocitrin (39.36%) and rutin (27.42%) were in the middle, and the antioxidant activities of hesperitin, naringenin, diosmin, hesperidin, nobiletin, sinensetin, naringin and tangeretin (< 5%) were very low. The antioxidant activities of these phenolic compounds were reduced by glycosylation or methoxylation, but increased with increasing number of phenolic hydroxyl groups.
phenolic acid; flavanone; antioxidant activity; DPPH method; ABTS method; FRAP method; HPLC-DPPH/ABTS
TS201.4
1002-6630(2015)11-0064-07
10.7506/spkx1002-6630-201511013
2014-11-01
中央高校基本科研业务费专项资金项目(XDJK2014A014);重庆三峡学院引进高层次人员科研启动项目(14RC05);重庆市自然科学基金项目(cstc2013jcyjA80012)
张华(1982—),女,讲师,博士,研究方向为果品营养与安全。E-mail:zhanghua03129@163.com
*通信作者:席万鹏(1979—),男,副教授,博士,研究方向为果品品质与营养。E-mail:xwp1999@zju.edu.cn
