短波紫外线对草莓采后腐烂、苯丙烷类代谢和抗氧化活性的影响
2015-01-03王焕宇姜璐璐王惠源郑永华
王焕宇,姜璐璐,王惠源,喻 譞,金 鹏,郑永华
(南京农业大学食品科技学院,江苏 南京 210095)
短波紫外线对草莓采后腐烂、苯丙烷类代谢和抗氧化活性的影响
王焕宇,姜璐璐,王惠源,喻 譞,金 鹏,郑永华*
(南京农业大学食品科技学院,江苏 南京 210095)
以‘红艳’草莓为材料,研究短波紫外线(ultraviolet-C,UV-C)处理对草莓果实在5 ℃、12 d贮藏期间腐烂、苯丙烷类代谢和抗氧化活性的影响。结果表明,2.0 kJ/m² UV-C处理能显著抑制草莓果实贮藏期间腐烂指数的上升。同时,UV-C处理能有效诱导果实贮藏期间苯丙氨酸解氨酶、肉桂酸羧化酶、对香豆酰-CoA连接酶、查尔酮异构酶和二氢黄酮醇还原酶活性的增加,维持较高的总酚、总花色苷、总黄酮以及主要酚类和花色苷类单体的含量,促进果实1,1-二苯基-2-三硝基苯肼自由基清除率和总还原力的上升,抑制羟自由基清除率的下降,从而保持了果实较高的抗氧化活性。
草莓;短波紫外线;腐烂;苯丙烷类代谢;抗氧化活性
草莓为浆果类水果,果实色泽艳丽,风味芳香;同时富含酚类、花色苷类和黄酮类等多种天然抗氧化活性成分,具有很高的营养价值,深受消费者的喜爱[1]。但草莓含水量高、组织娇嫩,且无外果皮保护,采后易受机械损伤和微生物侵染而腐烂变质[2-3]。因此,如何控制草莓果实腐烂的发生,已成为草莓采后贮运保鲜研究的热点和延长其贮藏期的关键。国内外对草莓果实的采后生理和贮藏已有较多研究,冷藏结合化学保鲜剂处理可显著抑制果实腐烂,但化学保鲜剂会对人类健康和环境带来潜在的危害,其应用受到了越来越多的制约,因此迫切需要寻求绿色安全的保鲜技术。
短波紫外线(ultraviolet-C,UV-C)处理作为一种无污染、无毒害的物理处理方法,不仅能有效控制果实贮藏病害的发生,而且可以有效诱导果实采后花色苷和多酚类等次生代谢产物的合成[4-6]。近年来研究表明,使用不同剂量的UV-C照射处理香菇[7]、番茄[8]和蜜橘[9]等果蔬,不仅能起到控制产品腐烂和延缓衰老,从而延长贮藏期的作用;同时还能促进次生代谢产物的合成和提高果蔬的抗氧化活性。因而UV-C处理在果蔬保鲜中显示出了较好的应用前景。但UV-C处理对草莓果实活性成分和抗氧化活性的影响及其与苯丙烷类代谢的关系尚未见报道。因此,本实验以‘红艳’草莓果实为试材,研究了果实在5 ℃、12 d贮藏期间腐烂、抗氧化活性及苯丙烷类代谢相关酶活性的变化,并从苯丙烷类代谢的角度探讨草莓果实采后抗氧化活性变化的机制,以期为UV-C处理在草莓果实保鲜中的应用提供依据。
1 材料与方法
1.1 材料与试剂
供试材料为八分熟的‘红艳’草莓品种(Fragaria× ananassa Duch. cv. Hongyan),选择大小、成熟度基本一致,无病虫害、无机械损伤的果实进行实验。
碳酸钠、β-巯基乙醇、二硫苏糖醇 国药集团化学试剂有限公司;抗坏血酸、过氧化氢、福林酚试剂南京寿德试剂器材有限公司;p-香豆酸、酚类和花色苷单体、查尔酮、反式肉桂酸、1,1-二苯基-2-三硝基苯肼(1,1-diphneyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;甲酸、乙腈均为国产色谱纯;丙酮、三氯化铝、无水乙醇、乙酸乙酯均为国产分析纯。
1.2 仪器与设备
GL-20G-H型冷冻离心机 上海安亨科学仪器厂;UV-1600型分光光度计 上海美普达仪器有限公司;ZDZ-1型紫外辐射照度计 上海嘉定学联实业有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;1200高效液相色谱仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 UV-C处理
选择的紫外灯功率为30 W,有效波长为254 nm,上下灯管与草莓距离为30 cm。在前期实验中,将随机挑选好的草莓果实分成5 组,分别按照0、0.5、1.0、2.0 kJ/m²和4.0 kJ/m²剂量的UV-C对果实进行照射处理。处理后的果实用塑料盒(20 cm×12 cm×8 cm)进行分装,然后置于(5±1)℃避光贮藏,12 d后测定果实的腐烂指数。在最佳UV-C处理条件下,将果实随机分成2 组,处理组用2.0 kJ/m2UV-C处理,对照组不作任何处理,处理组和对照组分别选用400 个果实,各重复3 次。处理后在(5±1)℃条件下避光贮藏12 d,期间每隔3 d取样进行分析测定。
1.3.2 指标测定
1.3.2.1 腐烂指数的测定
草莓果实的腐烂指数参照陈学红等[10]的方法测定。按腐烂面积大小将果实分为4 级:0级,无腐烂;1级,果面有1~3个小腐烂斑点;2级,腐烂面积占果实面积的25%~50%;3级,腐烂面积大于果实面积的50%。按下式计算腐烂指数:

1.3.2.2 苯丙烷类代谢相关酶活性的测定
苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)活性参照Zucker[11]的方法测定,以反应液每分钟在波长290 nm处光密度值变化0.001为1个酶活性单位;对香豆酰-CoA连接酶(4-coumarate coenzyme A ligase,4-CL)活性参照Knobloch等[12]的方法测定,以反应液每分钟在波长333 nm处光密度值变化0.001为1 个酶活性单位;肉桂酸羧化酶(cinnamate-4-hydroxylase,C4H)活性参照Lamb等[13]的方法测定,以反应液每分钟在波长340 nm处光密度值变化0.001为1 个酶活性单位;查尔酮异构酶(chalcone isomerase,CHI)活性参照Lister等[14]的方法测定,以反应液每分钟在波长370 nm处光密度值变化0.1为1 个酶活性单位;二氢黄酮醇还原酶(dihydroflavonol-4-reductase,DFR)活性参照Ju Zhiguo等[15]的方法测定,以反应液每分钟在波长550 nm处光密度值变化0.001为1 个酶活性单位;蛋白质含量采用考马斯亮蓝法测定。以上酶活性均以U/mg表示。
1.3.2.3 总酚、总花色苷和总黄酮含量的测定
果实总酚、总花色苷和总黄酮含量均参照Wang Kaituo等[16]的方法进行测定,结果均以mg/g表示。
1.3.2.4 酚类和花色苷类单体物质含量的测定
酚类和花色苷类单体含量的测定参照Zheng Yonghua等[17]的方法。取5 g果肉加25 mL丙酮,研磨成匀浆并离心,取上清液在35 ℃水浴条件下旋转蒸发后过C18Sep-Pak(Supelco公司)萃取小柱,然后用0.45 ☒m孔径的纤维膜过滤得到滤液,最后用高效液相色谱仪测定相关物质的含量。手动进样,进样体积为20 ☒L滤液。分析色谱柱为反向Nova-Pak C18分析柱,流动相为2.5%甲酸-乙腈溶液,洗脱时间35 min,流速1 mL/min。分别在波长350 nm和510 nm处测定酚类和花色苷类单体物质的含量,结果以☒g/g表示。
1.3.2.5 羟自由基清除率、DPPH自由基清除率和还原力的测定
羟自由基清除率和DPPH自由基清除率分别参照Wang Kaituo[16]和Larrauri[18]等的方法进行测定,结果均以清除百分率来表示;还原力采用Ozsoy等[19]的方法进行测定,结果以三氯化铁反应液在波长700 nm处的吸光度来表示。
1.4 数据分析
采用Origin 8.5和SASV 8.0统计分析软件对实验数据进行处理,采用Duncan新复极差法对数据进行差异显著性分析。
2 结果与分析
2.1 UV-C处理对草莓果实腐烂指数的影响
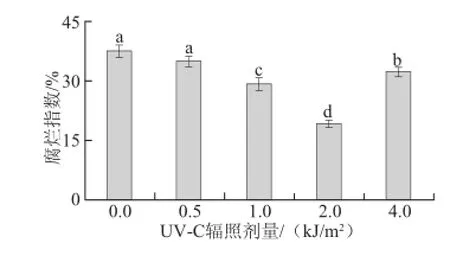
图1 不同剂量UV-C处理对草莓果实5 ℃贮藏12 d后腐烂指数的影响Fig.1 Effect of UV-C treatment at different dosages on decay index in strawberry fruit after storage at 5 ℃ for 12 days
如图1所示,草莓果实在5 ℃贮藏12 d后,1.0、2.0、4.0 kJ/m2UV-C处理组果实的腐烂指数分别为29.17%、19.27%和32.2%,均显著低于对照组的37.5%(P<0.05),其中又以2.0 kJ/m2UV-C处理的抑制效果最好。而0.5 kJ/m2剂量的UV-C处理果实的腐烂指数达到了34.9%,与对照组无显著差异(P>0.05)。因此,选用2.0 kJ/m2进一步研究UV-C处理对草莓果实苯丙烷类代谢和抗氧化活性的影响。
2.2 UV-C处理对对草莓果实苯丙烷类代谢相关酶的影响


图2 UV-C处理对草莓果实PAL(A)、4-CL(B)、C4H(CC))、CHI(D)和DFR(E)活性的影响Fig.2 Effects of UV-C treatment on the activities of PAL (A), 4-CL (B), C4H (C), CHI (D) and DFR (E) in strawberry fruit
PAL、4-CL、C4H、CHI和DFR是植物苯丙烷类代谢途径中的关键酶,其活性的大小与植物酚类物质含量的变化密切相关。由图2可知,草莓果实PAL和DFR活性在贮藏期间呈不断上升趋势,经UV-C处理的果实,其PAL和DFR活性均显著高于对照(P<0.05)。4-CL和C4H活性均在贮藏前期略有增加后逐渐下降,且UV-C处理均有效促进了二者活性的上升,整个贮藏期均明显高于对照组。CHI活性在贮藏期间呈下降的趋势,UV-C处理明显延缓了果实CHI活性的下降,整个贮藏期除了第9天与对照组无显著差异(P>0.05),其他贮藏时间均显著高于对照(P<0.05)。
2.3 UV-C处理对草莓果实总酚、总花色苷和总黄酮含量的影响
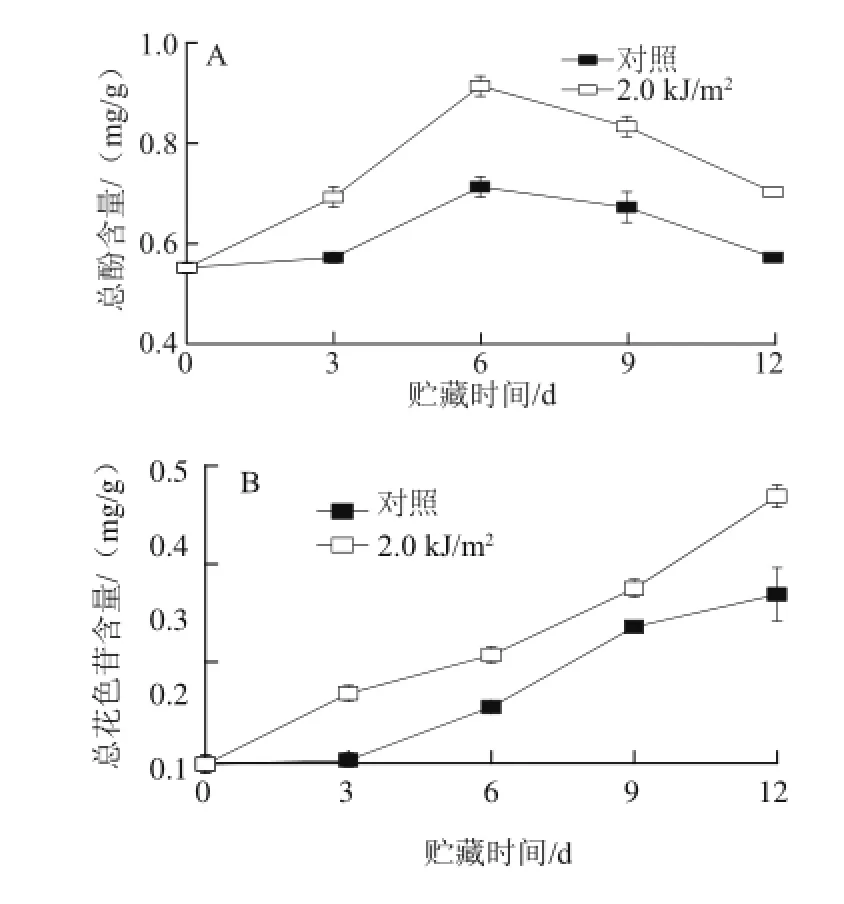
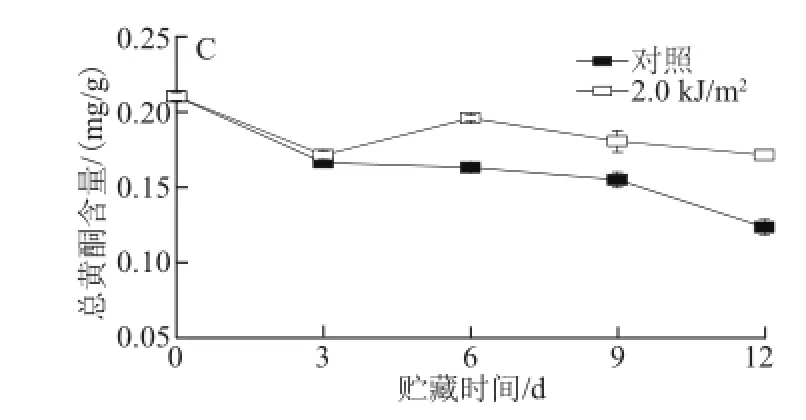
图3 UV-C处理对草莓果实总酚(A)、总花色苷(B)和总黄酮(C)含量的影响Fig.3 Effects of UV-C treatment on the contents of total phenolics (A), total anthocyanin (B) and total flavnoids (C) in strawberry fruit
图3A表明,草莓果实贮藏期间总酚含量呈先上升后下降的趋势,贮藏第6天,总酚含量达到峰值,但UV-C处理有效诱导了草莓果实总酚含量的增加,整个贮藏期处理组总酚含量均显著高于对照组(P<0.05)。草莓果实总花色苷含量在整个贮藏期间呈上升的趋势,UV-C处理一定程度上诱导了总花色苷含量的增加,但仅在贮藏末期显著高于对照组(图3B)(P<0.05)。果实的总黄酮含量贮藏期呈整体下降的趋势,UV-C处理能有效抑制草莓果实总黄酮含量的下降,整个贮藏期处理组的含量均高于对照组(图3C)。
2.4 UV-C处理对草莓果实酚类和花色苷类单体含量的影响

表1 UV-C处理对草莓果实酚类单体物质含量的影响Table1 Effects of UV-C treatment on the contents of individual phenolic compounds in strawberry fruit
采用高效液相色谱分析发现‘红艳’草莓果实中主要的酚类单体物质包括鞣花酸、鞣花酸葡萄糖苷、p-香豆酰葡萄糖、槲皮素-3-葡糖苷酸、山柰酚-3-葡萄糖苷以及山柰酚-3-葡糖苷酸,主要的花色苷类单体有矢车菊-3-葡萄糖苷、矢车菊-3-葡萄糖苷-丁二酸和天竺葵-3-葡萄糖苷。如表1、2所示,草莓果实中鞣花酸、鞣花酸葡萄糖苷、p-香豆酰葡萄糖、槲皮素-3-葡糖苷酸和山柰酚-3-葡萄糖苷在贮藏前6 d缓慢上升,随后逐渐下降,而山柰酚-3-葡糖苷酸却呈先下降后上升趋势。UV-C处理促进了草莓果实贮藏期间鞣花酸、鞣花酸葡萄糖苷、p-香豆酰葡萄糖、山柰酚-3-葡萄糖苷和山柰酚-3-葡糖苷酸含量的增加,但对槲皮素-3-葡糖苷酸的积累无显著影响(P>0.05)。草莓果实中矢车菊-3-葡萄糖苷、矢车菊-3-葡萄糖苷-丁二酸和天竺葵-3-葡萄糖苷的含量在贮藏期间呈缓慢上升趋势。UV-C处理显著诱导了果实中天竺葵-3-葡萄糖苷含量的上升(P<0.05),使处理组果实天竺葵-3-葡萄糖苷的含量在贮藏期间均高于对照组果实。而UV-C处理对贮藏前3 d草莓果实的矢车菊-3-葡萄糖苷和矢车菊-3-葡萄糖苷-丁二酸含量无显著影响(P>0.05),贮藏3 d后,UV-C处理显著诱导了草莓果实中二者含量的积累(表2)(P<0.05)。

表2 UV-C处理对草莓果实花色苷类单体物质含量的影响Table2 Effects of UV-C treatment on the contents of individual anthocyanin compounds in strawberry fruit
2.5 UV-C处理对草莓果实羟自由基清除率、DPPH自由基清除率和还原力的影响


图4 UV-C处理对草莓果实羟自由基清除率(A)、DPH自由基清除率(B)和还原力(C)的影响Fig.4 Effects of UV-C treatment on hydroxyl radical scavenging rate (A), DPPH radical scavenging rate (B) and reducing activity (C) in strawberry fruit
如图4A所示,对照组和处理组果实的羟自由基清除率在贮藏期间均不断下降,但UV-C处理在整个贮藏期均显著抑制了草莓羟自由基清除率的下降(P<0.05)。草莓果实的DPPH自由基清除率在前6 d急剧增加后逐渐下降。UV-C处理有效促进了草莓果实DPPH自由基清除率的上升,使整个贮藏期处理组DPPH自由基清除率均显著高于对照组(P<0.05),维持草莓果实较高的DPPH自由基清除率(图4B)。草莓果实的还原力在贮藏第3天达到峰值,后逐渐下降,而处理组在贮藏第9天略有增加。UV-C处理组还原力在整个贮藏期均高于对照组,但仅在贮藏末期显著高于对照组(图4C)(P<0.05)。
3 讨 论
果实腐烂是限制草莓采后贮运最主要问题。已有研究表明,UV-C处理可显著诱导桃[20]、番茄[21]和葡萄柚[22]等果实抗病相关酶活性的上升,同时抑制这些果实的腐烂,表明UV-C处理能通过诱导提高果实的抗病性,从而减少采后腐烂的发生。本研究中,UV-C处理也可显著抑制草莓果实采后腐烂的发生,这可能与UV-C诱导草莓果实本身产生抗病性有关。但UV-C抑制草莓果实腐烂的作用与处理剂量有关,在一定剂量范围内,UV-C处理剂量越高,对果实腐烂的抑制作用越大,以2.0 kJ/m² UV-C处理对草莓果实腐烂的抑制作用最大。高剂量(4.0 kJ/m²) UV-C对果实腐烂的抑制作用反而减小,这可能与其对果实组织产生灼伤有关。
近年来,果实中酚类物质等物活性成分含量的高低和抗氧化活性的大小已成为评价其营养品质和保鲜效果的重要指标。草莓果实体内富含花色苷等植物活性成分,具有较强的自由基清除能力和抗氧化能能力[1,17]。UV-C处理可有效诱导多种果蔬采后花色苷类、酚类、黄酮类等次生代谢物质含量的增加,提高其贮藏期间的抗氧化能力[9,23-24]。本研究中,草莓果实的总酚含量呈先上升后下降的趋势,总花色苷随着贮藏时间的延长逐渐积累,而总黄酮含量在贮藏时间呈下降趋势。UV-C处理组的总酚、总花色苷和总黄酮含量都不同程度的高于对照组。进一步对草莓果实主要酚类物质和花色苷单体进行定量分析,发现UV-C处理也显著增加了花色苷单体和大部分酚类单体的含量。伴随着这些抗氧化物质含量的增加,UV-C处理增强了草莓果实的DPPH自由基清除力和还原力,抑制了羟自由基清除力的下降。这些结果表明,UV-C能通过促进草莓果实酚类和花色苷类物质的合成来提高草莓果实的抗氧化能力。
苯丙烷类代谢途径(phenylpropnaoid pathway,PPP)是植物合成多酚类化合物的一条重要途径,其中PAL、4-CL、C4H、CHI和DFR是调控该代谢途径的关键酶,PAL是PPP第一步限速酶,C4H和4-CL是催化合成酚类物质前体4-香豆酸-CoA的关键酶,CHI在黄酮类化合物进一步转化中起着重要作用,DFR能催化二氢黄酮醇还原反应生成花色苷的前体花白素,这些酶在多种果蔬的酚类物质合成中起到重要的调控作用[25]。本研究中,2.0 kJ/m² UV-C处理显著提高了草莓果实PAL、4-CL、C4H、CHI和DFR的活性,同时促进草莓果实花色苷和酚类物质的积累,保持较高的抗氧化活性,这说明UV-C处理能通过诱导苯丙烷类代谢关键酶的活性的上升来促进草莓果实酚类、花色苷类及黄酮类等次生代谢物的合成,提高果实的抗氧化活性和营养价值。
本实验结果表明,UV-C处理能有效抑制草莓贮藏期间腐烂的发生,以2.0 kJ/m² UV-C处理对草莓果实腐烂的抑制作用最大。UV-C处理能显著增强苯丙烷类代谢关键酶PAL、4-CL、C4H、CHI和DFR的活性,提高总酚、总黄酮、总花色苷以及酚类和花色苷类单体的含量,维持果实较高的抗氧化活性。
[1] 李梦钗, 冯薇, 杨丽娜. 臭氧处理对草莓保鲜效果的影响[J]. 中国农学通报, 2011, 27(16): 230-243.
[2] 李莹, 任艳青, 闫化学, 等. 成熟度和贮藏温度对草莓贮藏期间果实品质的影响[J]. 食品工业科技, 2013, 34(4): 335-340.
[3] MARQUENIE D, MICHIELS C W, GEERAERD A H, et al. Using survival analysis to investigate the effect of UV-C and heat treatment on storage rot of strawberry and sweet cherry[J]. International Journal of Food Microbiology, 2002, 73(2/3): 187-196.
[4] 于刚, 栾雨时, 安利佳. UV-C处理对蓝莓贮藏保鲜及品质的影响[J].食品研究与开发, 2013, 34(2): 92-95.
[5] PATR☒CIA C, S☒RGIO F P, ELIANE A B. Effects of gamma and UV-C irradiation on the postharvest control of papaya anthracnose[J]. Postharvest Biology and Technology, 2007, 43(3): 366-373.
[6] ALLENDE A, ART☒S F. UV-C radiation as a novel technique for keeping quality of fresh processed ‘Lollo Rosso’ lettuce[J]. Food Research International, 2003, 36(7): 739-746.
[7] 姜天甲, 陆仙英, 蒋振晖, 等. 短波紫外线处理对香菇采后品质的影响[J]. 农业机械学报, 2010, 41(2): 108-112.
[8] 刘长虹, 陆仙英, 蔡路晙, 等. 短波紫外线处理对番茄采后抗氧化活性的影响[J]. 农业机械学报, 2011, 42(4): 116-129.
[9] SHEN Yan, SUN Yujing, QIAO Liping, et al. Effect of UV-C treatments on phenolic compounds and antioxidant capacity of minimally processed Satsuma mandarin during refrigerated storage[J]. Postharvest Biology and Technology, 2013, 76: 50-57.
[10] 陈学红, 郑永华, 杨震峰, 等. 高氧处理对草莓采后腐烂和品质的影响[J]. 农业工程学报, 2004, 20(5): 200-202.
[11] ZUCKER M. Sequential induction of phenylalanine ammonialyase and a lyase-inactivating system in potato tuber disks[J]. Plant Physiology, 2004, 43(3): 365-374.
[12] KNOBLOCH K H, HAHLBROCK K. 4-Coumarate: CoA ligase from cell suspension culture of Petroselinum hortense Hoffm. Partial purication, substrate specificity, and further properties[J]. Archives of Biochemistry and Biophysics, 1977, 184(1): 233-248.
[13] LAMB C Y, RUBERY P H. A spectrophotometric assay for trapscinnamic acid 4-hydroxylase activity[J]. Analytical Biochemistry, 1975, 68(2): 554-561.
[14] LISTER C E, LANCASTER J E, WALKER J R L. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars[J]. Journal of the Science of Food and Agriculture, 1975, 71(3): 313-320.
[15] JU Zhiguo, YUAN Yongbing, LIU Chenglian, et al. Dihydrofl avonol reductase activity and anthocyanin accumulation in ‘Delicious’,‘Golden Delicious’ and ‘Indo’ apples[J]. Scientia Horticulturae, 1997, 70(1): 31-34.
[16] WANG Kaituo, JIN Peng, CAO Shifeng, et al. Methyl jasmonate reduces decay and enhances antioxidant capacity in Chinese bayberries[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5809-5815.
[17] ZHENG Yonghua, WANG S Y, WANG C Y, et al. Changes in strawberry phenolics, anthocyanins, and antioxidant capacity in response to high oxygen treatments[J]. LWT-Food Science and Technology, 2007, 40(1): 49-57.
[18] LARRAURI J A, SANCHEZ M C, SAURA C F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. Journal of Agricultural and Food Chemistry, 1998, 46(7): 2694-2697.
[19] OZSOY N, CAN A, YANARDAG R, et al. Antioxidant activity of Smilax excelsa L. leaf extracts[J]. Food Chemistry, 2008, 110(3): 571-583.
[20] AHMED E G, CHARLES L W, ANN M C. Induction of chitinase, β-1,3-glucanase, and phenylalanine ammonia lyase in peach fruit by UV-C treatment[J]. Biological Control, 2003, 93(3): 349-355.
[21] CHARLES M T, TANO K, ASSELIN A, et al. Physiological basis of UV-C induced resistance to Botrytis cinerea in tomato fruit. Ⅴ. Constitutive defence enzymes and inducible pathogenesis-related proteins[J]. Postharvest Biology and Technology, 2009, 51(3): 414-424.
[22] DROBY S, CHALUTZ E, HOREV B. Factors affecting UV-induced resistance in grapefuit against the green mould decay caused by penicillium digitatum[J]. Plant Pathology, 1993, 42(3): 418-424.
[23] JIANG Tianjia, JAHANGIR M M, JIANG Zhenhui, et al. Influence of UV-C treatment on antioxidant capacity, antioxidant enzyme activity an d texture of postharvest shiitake (Lentinus edodes) mushrooms during storage[J]. Postharvest Biology and Technology, 2010, 56(3): 209-215.
[24] BRAVO S, GARC☒A-ALONSO J, MART☒N-POZUELO G, et al. The influence of post-harvest UV-C hormesis on lycopene, β-carotene, and phenolic content and antioxidant activity of breaker tomatoes[J]. Postharvest Biology and Technology, 2012, 49(1): 296-302.
[25] 杨爱萍, 汪开拓, 金文渊, 等. 杨梅果实采后抗氧化活性变化及其与苯丙烷类代谢的关系[J]. 食品与发酵工业, 2011, 37(9): 221-225.
Effects of UV-C Treatment on Postharvest Decay, Antioxidant Activity and Phenylpropanoid Metabolism in Strawberry Fruit
WANG Huanyu, JIANG Lulu, WANG Huiyuan, YU Xuan, JIN Peng, ZHENG Yonghua*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The effects of UV-C treatment on postharvest decay, phenylpropanoid metabolism and antioxidant activity in strawberry fruit (Fragaria × ananassa Duch. cv. Hongyan) during storage at 5 ℃ for up to 12 days were investigated. The results showed that UV-C treatment at 2.0 kJ/m² had the most significant inhibitory effect on fruit decay during the storage period. Meanwhile, this treatment significantly enhanced the activities of phenylalnine ammonialyase, cinnamate-4-hydroxylase, 4-coumarate coenzyme A ligase, chalcone isomerase and dihydroflavonol-4-reductase, maintained higher contents of total phenolics, anthocyanins and flavnoids as well as main individual phenolic and anthocyanin compounds than controls, promoted the 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical-scavenging activity and reducing power and inhibited the decrease of hydroxyl radical-scavenging activity, thus maintaining higher antioxidant activity of strawberry fruit.
strawberry; ultraviolet-C; fruit decay; phenylpropanoid metabolism; antioxidant activity
TS255.3
A
10.7506/spkx1002-6630-201510044
2014-11-30
国家自然科学基金面上项目(31471632);公益性行业(农业)科研专项(201303073);南京农业大学SRT计划项目(1418A19)
王焕宇(1988—),男,硕士研究生,研究方向为农产品加工与贮藏。E-mail:2012108084@njau.edu.cn
*通信作者:郑永华(1963—),男,教授,博士,研究方向为农产品加工与贮藏。E-mail:zhengyh@njau.edu.cn
