粗壮脉纹孢菌原生质体的制备、再生及转化的条件
2015-01-03杨建远范亚苇张炳火邓泽元
杨建远,李 静,范亚苇,张炳火,邓泽元,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.九江学院药学与生命科学学院,江西 九江 332000)
粗壮脉纹孢菌原生质体的制备、再生及转化的条件
杨建远1,2,李 静1,范亚苇1,张炳火2,邓泽元1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.九江学院药学与生命科学学院,江西 九江 332000)
为建立原生质体介导的粗壮 脉纹孢菌遗传转化系统,本研究 主要考察了复合酶解液、菌龄及酶解时间对粗壮脉纹胞菌原生质体生成及再生的影响。结果表明,粗壮脉纹胞菌孢子悬液接种在马铃薯葡萄糖琼脂(potato dextrose ag ar,PDA)液体培养基中,30℃条件下摇床培养10 h的菌丝,采用0.5 g/100 mL蜗牛酶+0.5 g/100 mL溶壁酶+1 g/100 mL纤维素酶的复合酶解液、30℃条件下酶解10 h,粗壮脉纹胞菌原生质体生成及再生最为适合。在此条件下,原生质体生成数可达4.53×106个,38#再生培养基中的再生数可达1.41×106个,再生率达31.71%,聚乙二醇介导PAKHB载体转化NC原生质体,每微克质粒可获得8个以上的转化子。
粗壮脉纹孢菌;原生质体;制备;再生;转化
粗壮脉纹孢菌(Neurospora crassa,NC)是子囊菌门(Ascomycoya),子囊菌纲(Ascomycetes),粪壳目(Sordariales),粪壳科(Sordariaceae),脉胞菌属(Neurospora)的真菌,是纤维素复合酶系产量较高的菌种之一[1]。本实验室从江西省的传统小吃豆扎清中分离到的粗壮脉纹胞菌(编号NC-l-6),具有较高的产纤维素酶及类胡萝卜素活性[2-4]。近年来,以丝状真菌为转化系统的遗传改造工程是研究热点之一。粗壮脉纹胞菌作为一种模式菌种,全基因组序列已经测完,因其自身的诸多特点在分子遗传机制研究、生理生化途径研究、工业产品发酵研究等领域均发挥着重要的作用[5],因此,粗壮脉孢菌功能基因的遗传改造相关研究将具有广阔的前景。
原生质体是真菌生理及遗传研究的重要工具,在真菌的遗传重组及微生物菌株的进化方面具有重要的贡献[6-7]。原生质体的融合和转化系统一定程度上依赖于原生质体制备数量和质量[8]。真菌原生质体的制备和再生条件受较多因素的影响[9],不同菌种之间差别较大,同一菌种也受菌龄、酶的种类及各种实验条件变化而变化。然而,国内外鲜见有较详细的粗壮脉纹胞菌原生质体制备条件研究的报道。本研究以粗壮脉纹胞菌菌株(NC-1-6)为对象,考察了其原生质体制备、再生及转化条件,为进一步对其进行功能基因的遗传改造奠定基础。
1 材料与方法
1.1菌株、质粒、试剂和溶液的配制
粗壮脉纹胞菌(NC-l-6),由南昌大学食品科学与技术国家重点实验室分离保存;同源重组质粒pUC18-APpki-php-B(含潮霉素B基因,简称为PAKHB),由南昌大学食品科学与技术国家重点实验室构建。
溶壁酶、纤维素酶 美国Sigma公司;蜗牛酶、潮霉素B、山梨醇和PEG 4000生工生物工程(上海)股份有限公司。
孢子洗液:9 g/L NaCl、0.5 g/L吐温-80。
酶解液:采用pH 6.0的10 mmol/L磷酸盐缓冲液配制成含0.6 mol/L MgSO4的不同复合酶,蜗牛酶质量浓度为0.5 g/100 mL(A)、溶壁酶质量浓度为0.5 g/100 mL(B)、纤维素酶质量浓度为1.0 g/100 mL(C)。
STC溶液:50 mmol/L CaCl2、1.0 mol/L山梨醇、50 mmol/L Tris-HCl(pH 8.0)。
PTC溶液:50 mmol/L CaCl2、40 g/100 mL聚乙二醇(polyethylene glycol,PEG)4000、50 mmol/L Tris-HCl(pH 8.0)。
TB3溶液:酵母粉3 g、胰蛋白胨3 g、蔗糖200 g,加蒸馏水至1 L,灭菌备用。
1.2方法
1.2.1粗壮脉纹孢菌孢子悬液的制备
将马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)斜面保存的粗壮脉纹孢菌孢子,接种到沙氏固体斜面培养基中,30℃静置培养1 d,将NC菌落转接到沙氏固体培养基中,30℃条件下静置培养5~10 d。用孢子洗液轻轻将孢子洗下,400目滤器过滤,收集孢子悬液。经血球计数板计数,其浓度约为8×106个/mL,分装为10 mL每管,-20℃冻存。
1.2.2粗壮脉纹孢菌菌丝体的培养
将10 mL粗壮脉纹孢菌孢子悬液50℃热激90 s,接种到50 mL PDA液体培养基中,30℃、180 r/min,摇床培养6~14 h,用灭菌的400目滤器过滤,收集菌丝体,并用0.6 mol/L MgSO4冲洗2~3次,用无菌滤纸吸干表面的水分,备用。
1.2.3粗壮脉纹孢菌原生质体的制备
[10-11]方法略作修改,称取0.25 g上述湿菌丝体,放入装有5 mL的复合酶解液的50 mL离心管中,于30℃、80 r/min,摇床酶解6~14 h后,用5 mL酶解缓冲液稀释吹散,经灭菌的4层擦镜纸过滤,滤液于10 mL离心管中,4℃、3 000 r/min离心10 min,弃上清,用2 mL预冷的1.0 mol/L山梨醇溶液重悬洗涤2次,4℃、2 000 r/min离心10 min;用1 mL预冷的1.0 mol/L山梨醇溶液重悬,经血球计数板计数,冰浴备用。原生质体制备数(X)的计算见下式。

式中:A为重悬液原生质体含量/(个/mL);V为重悬原生质总体积/mL。
1.2.4粗壮脉纹孢菌原生质体的观察
当考察时间对原生质体生成的影响因素时,取酶解6、8、10、12、14 h的酶解产物各20 μL于载玻片上,浮游生物 计数仪下观察原生质体的生成状况。
1.2.5粗壮脉纹孢菌原生质体的再生
取上述50 μL原生质体悬液以预冷的1.0 mol/L山梨醇溶液稀释成约102个/mL,同时取50 μL原生质体悬液以灭菌蒸馏水稀释相同倍数作对照,以消除菌丝片段产生的误差。分别取200 μL涂布于38#固体再生平板上,30℃条件培养至刚长出菌丝时,即开始观察标记。原生质体再生数(Y)计算公式如下。
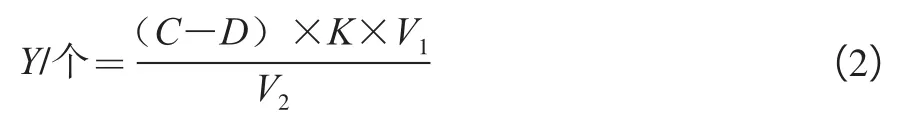
式中:C为平板菌落平均数/个;D为对照平板菌落平均数/个;K为稀释倍数;V1为重悬原生质总体积/mL;V2为原生质涂布用的体积/mL。
原生质体再生率(Z)计算公式为:

1.2.6 PEG介导的粗壮脉纹孢菌原生质体转化
转化方法参考文献[12-13]略作修改,4℃、2 000 r/min离心备用的原生质体,用预冷的STC溶液调整原生质体数大于1×107个/mL,取粗壮脉纹孢菌原生质体100μL加入到含20μL(约3μg)PAKHB载体(含潮霉素B抗性基因)和50μLPTC溶液的10 mL离心管中,轻轻混匀后冰浴30 min,再加入900μLPTC溶液,室温静置20~30 min,再加入4 mL TB3溶液,30℃条件下静置30~60 min,1 500 r/min离心5 min,吸去4 mL上清后,取200μL涂布在含有200μg/mL潮霉素B的PDA再生培养基上,30℃静置培养1~2 d,观察转化子生长情况。
2 结果与分析
2.1复合酶解液对粗壮脉纹孢菌原生质体制备及再生的影响
分别以5 mL含A+B、A+C、B+C及A+B+C 4种复合酶解液酶解0.25 g培养10 h的湿菌丝体。由图1可知,A+B、A+C、B+C、A+B+C复合酶解液对粗壮脉纹孢菌的酶解能力依次增强。其中,以A+B复合酶解液酶解的原生质体生成数及再生数最少;以A+B+C复合酶解液酶解后原生质体生成数及再生数最多。因此,A+B+C复合酶解液的酶解能力最强。

图1 复合酶解液对原生质体制备及再生的影响Fig.1 Effects of enzyme preparations on protoplast production and regeneration
2.2菌龄对粗壮脉纹孢菌原生质体制备及再生的影响
分别取0.25 g培养6、8、10、12、14 h的湿菌丝体,用5 mL的A+B+C复合酶解液,30℃条件下酶解10 h。由图2可知,粗壮脉纹孢菌菌丝体培养时间对原生质体生成及再生影响较大,培养10 h的菌丝体对原生质体的生成及再生最为有利,再生数可达1.41×106个,而培养12 h以上的菌丝体酶解较困难,原生质体生成及再生数均较低。因此,以培养10 h菌龄的菌丝体为最适条件。
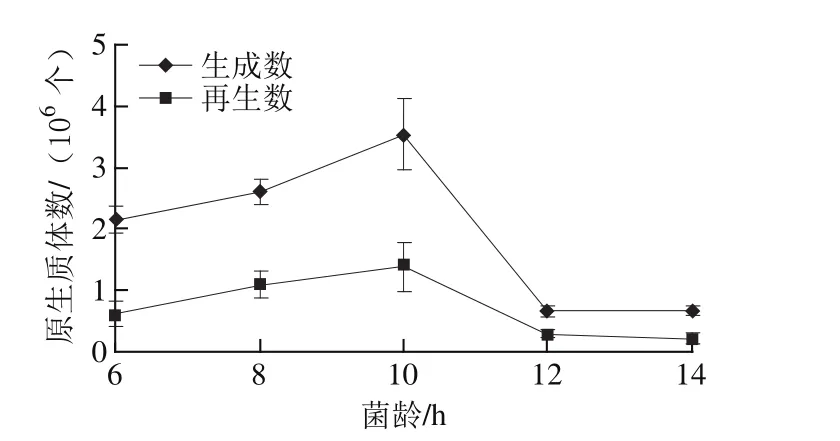
图2 菌龄对原生质体制备和再生的影响Fig.2 Effects of mycelium age on protoplast production and regeneration
2.3酶解时间对粗壮脉纹孢菌原生质体制备及再生的影响
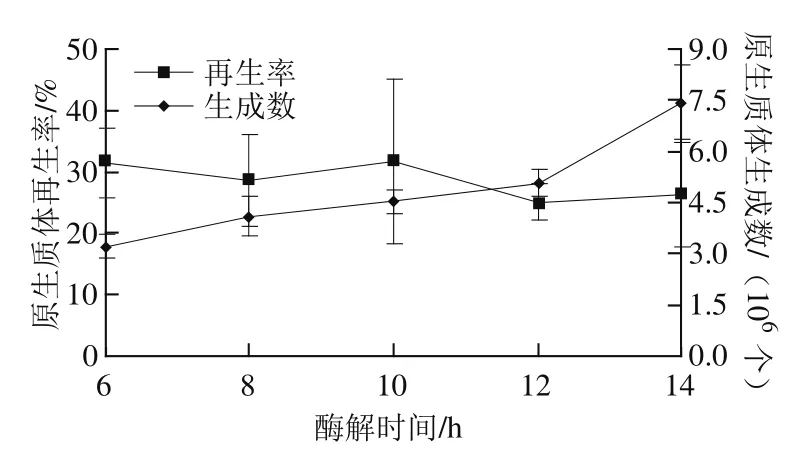
图3 酶解时间对原生质体制备和再生率的影响Fig.3 Effects of enzymatic digestion time on protoplast production and regeneration rate
取0.25 g培养10 h的菌丝体,以5 mL的A+B+C复合酶解液,30℃条件下分别酶解6、8、10、12、14 h。由图3可知,A+B+C复合酶对培养10 h的粗壮脉纹孢菌菌丝体酶解6~14 h,原生质体生成数量呈升高趋势,但酶解10 h生成的原生质体再生率最高,达到31.71%,此时,原生质体生成数可达4.53×106个。同时,考虑到酶解时间短对原生质体的转化或融合有利,因此,选择A+B+C复合酶酶解10 h为最佳酶解条件。
2.4粗壮脉纹孢菌原生质体的观察
培养10 h的菌丝体,30℃条件下,以A+B+C复合酶解液酶解,显微镜下观察可见,随着酶解时间的增加,原生质体不断从粗壮脉纹孢菌菌丝体中游离出来,而菌丝体逐渐变软成团,过长时间酶解后菌丝体可断裂成碎片。酶解10 h制备的原生质体较均匀干净(图4),而酶解12~14 h后制备的原生质体容易发生聚集黏连(图5),这可能是因为细胞壁消化过于彻底导致的。

图4 酶解10 h生成的原生质体(400×)Fig.4 Protoplast after enzymatic incubation for 10 h (400×)

图5 酶解14 h生成的原生质体(400×)Fig.5 Protoplast after enzymatic incubation for 14 h (400×)
2.5 PEG介导的粗壮脉纹孢菌原生质体转化

图6 含潮霉素B的PDA再生培养基上转化子生长情况Fig.6 Phenotype of transformants on plate medium containing hygromycin B
经PAKHB质粒载体转化原生质体涂布抗性再生平板,培养1 d后,可见在含有潮霉素B的PDA再生培养基上能长出粗壮脉纹孢菌菌落,可获得大于8个转化子/μg质粒,而对照平板上未有生长(图6)。表明制备的粗壮脉纹胞菌原生质体质量较好,能满足基因重组转化或原生质体融合的需要。
3 讨 论
真菌细胞壁成分较复杂,粗壮脉纹胞菌细胞壁成分由外到里为无定形葡聚糖层、葡聚糖蛋白网、蛋白质及几丁质微纤丝层[14],真菌通常采用纤维素酶、溶壁酶及蜗牛酶复合酶进行酶解脱壁[15-16]。根据李姝江等[17]报道,当复合酶中纤维素酶-蜗牛酶-溶菌酶质量比为2∶1∶1时对球孢白僵菌菌丝原生质体制备效果好。考虑到酶的浓度太高会对原生质体产生毒害作用而影响再生率,而溶壁酶本身也是一种复合酶,因此确定复合酶为含0.5 g/100 mL蜗牛酶,0.5 g/100 mL溶壁酶和1.0 g/100 mL纤维素酶的酶解液。同时参考相关文献[18-20]确定30℃为酶解温度。本研究重点考察了酶的种类、菌龄及酶解时间对粗壮脉纹胞菌原生质体制备及再生的影响。
本研究考察的几种组合的复合酶中,以A+B+C组成的复合酶解液效果最好,B+C组合效果较好,而A+B、A+C组合效果差,这与周礼红等[21]实验结果相近。可见,在粗壮脉纹胞菌原生质体制备过程中,溶壁酶及纤维素酶先前的协同酶解外层的无定形葡聚糖层、葡聚糖蛋白网、蛋白质层,对蜗牛酶酶解细胞壁内层的几丁质起着十分重要作用。
粗壮脉纹胞菌菌丝的生长较快,菌龄对原生质体生成影响较大。菌龄过短,则菌丝收获量小;菌龄太长,菌丝细胞壁会沉积不易被酶解的物质[22],即无定形葡聚糖层增加,而难以酶解。本研究表明,菌龄为4 h时孢子刚刚萌发还很难收集到菌丝体,菌龄为10 h时收集的菌丝体量较合适,酶解生成的原生质体及再生数也最高,而菌龄为12 h以上的菌丝体酶解较困难。然而,有些生长较慢的真菌最适菌龄较长,如猴头菌和黑曲霉分别需5 d和3 d[20,23]。
酶解时间过短酶解不充分,原生质生成数少,时间过长会毒害细胞膜,甚至皱缩,再生率下降[24]。本研究结果表明,随着酶解时间延长生成的原生质体数量呈现增加的趋势,但原生质体的再生率在酶解时间为6、8、10 h时明显高于12、14 h,在实验中也观察到酶解时间大于12 h时原生质体发生了部分聚集、黏连,这充分说明酶解10 h以后一定程度上对原生质体细胞膜产生了损害。同时,酶解时间的长短在一定程度上受菌龄、酶的种类及浓度等因素的影响。粗壮脉纹胞菌原生质体的再生和转化结果表明,在此优化条件下制备的原生质体质量较好。
参考文献:
[1] EBERHART B M, BECK R S, GOOLSBY K M. Cellulase of Neurospora crassa[J]. Journal of Bacteriology, 1977, 130(1)∶ 181-186.
[2] 刘沛毅, 邓泽元, 杨建远, 等. 粗壮脉纹胞菌复合多菌种发酵茶粕产纤维素酶的研究[J]. 食品科学, 2014, 35(1)∶ 174-179. doi∶ 10.7506/ spkx1002-6630-201401034.
[3] 杨风玲, 邓泽元, 叶俊, 等. 粗壮脉纹胞菌降解稻草粗纤维培养基的优化[J]. 南昌大学学报, 2013, 37(4)∶ 386-390.
[4] 李红艳, 邓泽元, 范亚苇, 等. 粗壮脉纹孢菌发酵豆渣所产类胡萝卜素的研究[J]. 食品工业科技, 2009, 30(4)∶ 160-163.
[5] 张妍妍, 刘佩卉, 刘新利. 粗糙脉孢菌及其在发酵工业中的应用研究[J]. 山东科学, 2011, 24(3)∶ 37-42.
[6] PRABAVATHY V R, MATHIVANAN N, SAGADEVAN E, et al. Intra-strain protoplast fusion enhances carboxymethyl cellulase activity in Trichoderma reesei[J]. Enzyme and Microbial Technology, 2006, 38(5)∶ 719-723.
[7] HAMLYN P F, BRADSHAW R E, MILLAN F M, et al. Efficient protoplast isolation from fungi using commercial enzymes[J]. Enzyme and Microbial Technology, 1981, 3(4)∶ 321-325.
[8] KIM B K, KANG J H, JIN M, et al. Mycelial protoplast isolation and regeneration of Lentinus lepideus[J]. Life Sciences, 2000, 66(14)∶1359-1367.
[9] LIU Wen, ZHU Wenmiao. Production and regeneration of Trichosporon cutaneum protoplasts[J]. Process Biochemistry, 2000, 35∶ 659-664.
[10] 张粲, 高乐, 赫荣琳, 等. 桧状青霉原生质体制备和再生的研究[J].基因组学与应用生物学, 2014, 33(1)∶ 57-62.
[11] SU Shanshan, LUO Yijing, CAO Siyuan, et al. Construction and evaluation of an exopolysaccharide-producing engineered bacterial strain by protoplast fusion for microbial enhanced oil recovery[J]. Bioresource Technology, 2013, 144∶ 44-49.
[12] 姚婷婷, 王正祥. 黑曲霉原生质体的制备、再生及转化条件[J]. 食品与生物技术学报, 2006, 25(4)∶ 116-120.
[13] 李燕萍, 谭文辉, 许杨. 橙色红曲菌AS3.4384转化方法的建立[J]. 食品科学, 2007, 28(10)∶ 317-322.
[14] 周德庆. 微生物学教程[M]. 2版. 北京∶ 高等教育出版社, 2002∶ 54.
[15] THOMAS E, PAKALA S, FEDOROVA N D, et al. Triallelic SNP-mediated genotyping of regenerated protoplasts of the heterokaryotic fungus Rhizoctonia solani[J]. Journal of Biotechnology, 2012, 158(3)∶144-150.
[16] LI Lina, YU Changqing, HAN Yuxi. Enhancement of arachidonic acid production by mortierella isabellina through protoplast regeneration mutagenesis[J]. Journal of Northeast Agricultural University, 2011, 18(2)∶ 65-72.
[17] 李姝江, 朱天辉, 韩珊, 等. 球孢白僵菌原生质体制备和再生条件[J].四川农业大学学报, 2011, 29(1)∶ 45-51.
[18] 周凤艳, 张勇, 周振荣, 等. 空心莲子草致病菌假隔链格孢菌原生质体的制备与再生[J]. 植物保护学报, 2014, 41(2)∶ 151-156.
[19] 徐金涛. 瑞氏木霉β-葡萄糖苷酶在纤维素酶诱导表达过程中作用机制的研究[D]. 济南∶ 山东大学, 2014.
[20] 刘莉, 肖招燕, 郭丽琼, 等. PEG 介导的猴头菌遗传转化体系的建立[J].菌物学报, 2014, 33(1)∶ 121-128.
[21] 周礼红, 李国琴, 王正祥, 等. 红曲霉原生质体的制备、再生及其遗传转化系统[J]. 遗传, 2005, 27(3)∶ 423-428.
[22] 王赓, 杜连祥. 新月弯孢霉原生质体制备及再生条件的研究[J]. 微生物学通报, 1999, 26(1)∶ 21-23.
[23] 王发祥, 俞健, 王建辉, 等. 1株产酸性α-淀粉酶黑曲霉原生质体制备和再生条件优化[J]. 食品科学, 2014, 35(1)∶ 155-158. doi∶ 10.7506/ spkx1002-6630-201401030.
[24] 邱静, 罗水忠, 姜绍通, 等. 高产L-乳酸米根霉的原生质体制备与再生条件研究[J]. 食品科学, 2011, 32(9)∶ 174-178.
Protoplast Production, Regeneration and Transformation of Neurospora crassa
YANG Jianyuan1,2, LI Jing1, FAN Yawei1, ZHANG Binghuo2, DENG Zeyuan1,*
(1. State Key Laboratory of Food Science and Techno logy, Nanchang University, Nanchang 330047, China; 2. College of Pharmaceutical and Life Sciences, Jiujiang University, Jiujiang 332000, China)
This study aimed to establ ish protoplast-mediated genetic transformation system ofNeurospora crassa. Several major fac tors influencing the production and regeneration ofN. crassaprotoplast, such as mycelium incubation time, macerozyme and digestion time, were investigated. The results showed that mycelium incubation in liquid PDA medium at 30℃for 10 h, and enzymatic hydrolysis at 30℃for 10 h with a macerozyme solution containing 0.5 g/100 mL snailase, 0.5 g/100 mL lyticase and 1.0 g/100 mL cellulase were optimal for the production and regeneration ofN. crassaprotoplast. Under these conditions, the number of production and regeneration in 38# regeneration medium ofNeurospora crassaprotoplast were 4.53 × 106and 1.41 × 106, respectively, and the regeneration rate was 31.71%. Transformation efficiency with PAKHB plasmid by PEG-mediated was more than 8 transformants per μg of plasmid DNA.
Neurospora crassa; protoplasts; producti on; regeneration; transformation
TS201
1002-6630(2015)17-0169-04
10.7506/spkx1002-6630-201517032
2014-11-26
食品科学与技术国家重点实验室(南昌大学)目标导向课题(SKLF-ZZA-201303);江西省科技支撑计划项目(2010BSB03004)
杨建远(1979—),男,讲师,博士研究生,研究方向为食品生物技术与食品营养。E-mail:yjy731@sohu.com
*通信作者:邓泽元(1963—),男,教授,博士,研究方向为食品营养与功能食品。E-mail:dengzy@ncu.edu.cn
