一株柴胡红景天中内生真菌的抗氧化活性
2015-01-03崔晋龙郭婷婷王俊宏王梦亮
崔晋龙,郭婷婷,2,王俊宏,王梦亮,*
(1.山西大学应用化学研究所,山西 太原 030006;2.山西大学生物技术研究所,山西 太原 030006)
一株柴胡红景天中内生真菌的抗氧化活性
崔晋龙1,郭婷婷1,2,王俊宏1,王梦亮1,*
(1.山西大学应用化学研究所,山西 太原 030006;2.山西大学生物技术研究所,山西 太原 030006)
对柴胡红景天中一株具有抗氧化活性的内生真菌Rb-R-1进行研究,获得其分类地位并评价抗氧化活性强弱。结果表明:这株真菌为Ascomacota门Hypocreales目Neonectria属的N. ramulariae真菌,具有较强的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基(·OH)、超氧阴离子自由基(O2-·)、NO2-清除能力和Fe2+螯合能力,IC50值分别为8.86、4.40、9.65、16.53、1.91 mg/mL;其发酵产物中总酚和总黄酮含量分别达18.12、22.48 mg/g。发酵条件优化结果表明,在以乳糖为碳源、牛肉膏为氮源、装液量90 mL/250 mL、pH 7.0、25℃条件下培养10 d时,内生真菌Rb-R-1发酵产物对DPPH自由基的清除率最大,达到93.12%;总酚和总黄酮含量最高,分别为19.14 mg/g和28.25 mg/g。
柴胡红景天;内生真菌;抗氧化;发酵条件优化
高山植物红景天(Rhodiola roseaL.)是2002年我国卫生部颁布的“关于进一步规范保健食品原料管理的通知(卫法监发[2002]51)”中规定的“可用于保健食品的物品”之一,也是世界许多民族长期使用的抗氧化植物药和食品添加原料[1]。在我国,红景天主要分布于海拔超过3 000 m的高寒、强紫外线辐射、多风的青藏高原等山区[2],其主要化学成分有40多种,包括苯丙烷类、苯乙醇及它们的衍生物[2-3]如红景天苷、酪醇等[3],许多属于酚类、黄酮类物质的范畴,这赋予了红景天良好的以抗氧化和抗缺氧双向调节为基础的抗高山反应、抗衰老、抗疲劳等适应原活性[4]。
内生真菌,是生活于健康植物组织内部,不引起植物明显病原特征的微生物[5]。在长期的共进化过程中,内生真菌与宿主共同应对各种生物与非生物胁迫,形成了专一性很强的共生关系[5-6]。自1993年Stierle等[6]从红豆杉内生真菌Taxomyces andreanae中分离出紫杉醇以来,人们陆续从特定功能的药用植物中分离出了类似功能的多种内生真菌[7]。因此,从特定药理功能植物中寻找特定活性的内生真菌已成为寻找新天然产物的研究热点[8]。
截至目前,大多数这样的内生真菌来自于温带或亚热带植物[9],而对高山、海洋等特殊环境中的植物,尤其是具有特定功能的珍稀植物研究很少[10]。尤其是对于红景天内生真菌的研究,国内外均无报道。本实验室对我国主要的红景天品种——柴胡红景天(Rhodiola bupleuroides)内生真菌进行了研究,获得一株具有开发价值的抗氧化活性内生真菌,在明确其分类地位的基础上,评价其抗氧化活性,为这一资源的进一步开发利用提供数据基础。
1 材料与方法
1.1材料
柴胡红景天于2012年9月采集于西藏米拉山口(海拔5 700 m,东经92 °22’50”,北纬29 °11’25”),由山西大学崔晋龙副教授鉴定为柴胡红景天(R. bupleuroides)[11]。真菌Rb-R-1分离自柴胡红景天的健康块茎。以上材料与菌种均保藏于山西大学应用化学研究所。
1.2仪器与设备
PTX200聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;BX53摄影生物显微镜 日本Olympus公司;HEI-VAP/LR20旋转蒸发仪德国Heidolph公司;CS/50CXII型高速冷冻离心机 日本Hitachi公司;UV2450型紫外-可见分光光度计 日本岛津公司。
1.3方法
1.3.1真菌Rb-R-1的鉴定
形态学鉴定:将真菌Rb-R-1接种于察氏(Czapek’s,CZ)培养基平板上,28℃培养7 d,观察菌落形态特征;挑取菌丝,在显微镜下观察菌丝、孢子、产孢结构等特征,鉴定真菌Rb-R-1的属种。
分子鉴定:采用十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)法提取真菌R b-R-1的基因组D N A,用引物I T S 1(T C C G T A G G T G A A C C T G C G G)和I T S 4(TCCTCCGCTTATTGATATGC)[12]对真菌rDNA-ITS进行PCR扩增,程序为94℃3 min,94℃30 s,55℃30 s,72℃1 min,30个循环;72℃延伸5 min,4℃保藏。将PCR产物送至生工生物工程(上海)股份有限公司测序,将序列提交至GenBank(http∶//www.ncbi. nlm.nih.gov/),进行BLAST比对,采用MEGA 4.0软件进行相似菌种的Neighbor-Joining(NJ)遗传树构建,确定其遗传关系,最终确定其属种地位。
1.3.2内生真菌Rb-R-1发酵产物中总酚、总黄酮含量的测定
将纯化好的内生真菌Rb-R-1接种于装有100 mL液体CZ培养基的三角瓶(250 mL)中,25℃、120 r/min培养10 d,4层纱布过滤。收集滤液,10 000 r/min离心10 min,取上清液,加入5倍体积的95%乙醇,去除沉淀。上清液于45℃、8×103Pa条件下旋转蒸发,获得发酵液浓缩物,称质量。加无菌去离子水定容为10 mg/mL的样液,置于4℃条件下备用。
总酚含量的测定采用Fo lin-酚法[13]:配制0.05、0.10、0.15、0.25、0.50 mg/mL的没食子酸对照品梯度溶液,分别移取1 mL于100 mL容量瓶中,加入60 mL水、5 mL Folin-酚试剂混匀;在0.5~8 min内,加入15 mL质量分数20%Na2CO3溶液,摇匀,去离子水定容;20℃放置2 h,于765 nm波长处测定吸光度,获得标准曲线方程为y=1.396 96x-0.001 28(R2=0.999 9)。
总黄酮含量的测定采用芦丁法[14]:分别移取1.0、2.0、3.0、4.0、5.0 mL芦丁对照品溶液(0.20 mg/mL)至10 mL容量瓶中,分别加入5%NaNO2溶液0.3 mL,摇匀后放置6 min;再加入10%Al(NO3)3溶液0.3 mL,摇匀后放置6 min;最后加入10%NaOH溶液4.0 mL,去离子水定容后摇匀;放置15 min,在510 nm波长处测定其吸光度,获得标准曲线方程为y=8.238 19x-0.009 5(R2=0.999 3)。
以1 mL样液分别代替没食子酸和芦丁,通过上述方法和标准曲线方程计算出真菌发酵液粗提物中的总酚、总黄酮含量。
1.3.3内生真菌Rb-R-1发酵产物抗氧化能力测定
内生真菌Rb-R-1发酵产物的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基(·OH)、超氧阴离子自由基(O2-·)清除能力,亚铁离子(Fe2+)螯合能力测定及计算参照文献[15]的方法进行;亚硝酸根离子(NO2-)清除能力测定及计算参照文献[16]的方法进行。
采用南京建成生物工程研究所研制的总抗氧化能力测定试剂盒对内生真菌发酵产物的总抗氧化能力进行测定。总抗氧化能力(U)定义为在37℃时,每分钟每毫升待测液使反应体系的光密度(OD520nm)值每增加0.01为一个总抗氧化能力单位。根据下式计算内生真菌发酵产物的总抗氧化能力。

式中:OD0为空白对照组的光密度;ODi为样品组或阳性对照组反应体系的光密度;发酵产物质量=待测液体积/mL×待测液质量浓度/(mg/mL)。
以上实验均设3次重复。O2-·清除能力测定实验中以乙二胺四乙酸二钠(ethylene diamine tetraacetic aciddisodium salt,EDTA-2Na)为阳性对照,其余实验均以VC为阳性对照。各抗氧化实验中内生真菌Rb-R-1发酵产物的抗氧化能力以IC50值表示,其值越小,表明发酵产物的抗氧化能力越强。
1.3.4内生真菌Rb-R-1发酵条件的优化
1.3.4.1单因素试验设计
以CZ培养基为菌种发酵的基础培养基,以DPPH自由基清除率为评价指标,分别测定不同碳源、氮源、初始pH值、发酵温度、装液量、发酵时间对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响。
分别选择可溶性淀粉(C-A)、乳糖(C-B)、蔗糖(C-C)、葡萄糖(C-D)、麦芽糖(C-E)为内生真菌Rb-R-1发酵的碳源,添加量均为30 g/L;固定氮源为硝酸钠、pH值为7.0、发酵温度为30℃、装液量为120 mL、发酵时间为8 d,测定发酵完成后产物的DPPH自由基清除率。
分别以酵母膏(N-A)、蛋白胨(N-B)、牛肉膏(N-C)、硝酸钠(N-D)、氯化铵(N-E)为内生真菌Rb-R-1发酵的氮源,添加量均为3 g/L;固定碳源为乳糖、pH值为7.0、发酵温度为30℃、装液量为120 mL、发酵时间为8 d,测定发酵完成后产物的DPPH自由基清除率。
分别以5.0、6.0、7.0、8.0、9.0、10.0为内生真菌Rb-R-1发酵的初始pH值;固定碳源为乳糖、氮源为牛肉膏、发酵温度为30℃、装液量为120 mL、发酵时间为8 d,测定发酵完成后产物的DPPH自由基清除率。
分别以15、20、25、30、35、38℃为内生真菌Rb-R-1发酵的发酵温度;固定碳源为乳糖、氮源为牛肉膏、pH值为7.0、装液量为120 mL、发酵时间为8 d,测定发酵完成后产物的DPPH自由基清除率。
分别以30、60、90、120、150、180 mL为内生真菌Rb-R-1在250 mL三角瓶中发酵的装液量;固定碳源为乳糖、氮源为牛肉膏、pH值为7.0、发酵温度为25℃、发酵时间为8 d,测定发酵完成后产物的DPPH自由基清除率。
分别以4、6、8、10、12、14 d为内生真菌Rb-R-1的发酵时间,固定碳源为乳糖、氮源为牛肉膏、pH值为7.0、发酵温度为25℃、装液量为90 mL,测定发酵完成后产物的DPPH自由基清除率。
1.3.4.2正交试验设计
以单因素试验结果为基础,进行正交试验设计,以获得最佳发酵条件。选取碳源量、氮源量、初始pH值、发酵温度、装液量5个因素,每个因素选取4个水平,利用DPS软件设计L16(45)正交试验,确定最佳发酵条件。在正交试验获得的最佳发酵条件下,进一步确定最佳发酵时间(分别培养4、6、8、10、12 d)。同时测定优化条件下发酵液中的总酚、总黄酮含量,以最终确定内生真菌Rb-R-1的最佳发酵条件。
1.4数据统计分析
抗氧化实验中内生真菌Rb-R-1发酵产物的抗氧化能力数据采用SPSS Statistics 17.0分析完成。数据的差异显著性采用DPS数据处理软件,通过最小显著差异法(least-significant difference,LSD)进行分析。
2 结果与分析
2.1内生真菌Rb-R-1鉴定结果
内生真菌Rb-R-1的菌落为黄褐色,表面菌丝黄白色,短绒状,背面深橘黄色;分生孢子无色,圆柱状,连续产生;分生孢子梗直,细长,无色,分支不规则。结合文献[17]的报道,鉴定此菌为柱孢属真菌(Cylindrocarponsp.),其菌落形态和显微结构如图1所示。对该菌进行rDNA-ITS测序,将测序结果提交至GenBank,获得序列登录号为KJ542260,与GenBank数据库比对结果表明,该菌与Neonectria ramulariae(GenBank登录号KM249079)具有100%的同源性和99%的相似性;另外,将该菌与GenBank数据库中同源性高度相似的菌种进行NJ遗传树的构建,进一步确定了其遗传关系(图2);结合前人研究成果[18],最终确定N. ramulariae为C. obtusiusculum的有性型。因此,鉴定内生真菌Rb-R-1为N. ramulariae或C. obtusiusculum真菌。

图1 内生真菌Rb-R-1的菌落(A)及显微(B)形态特征Fig.1 Colony (A) and morphological (B) characteristics of Rb-R-1

图2 基于rDNA-ITS序列构建的Rb-R-1与其相似序列菌株的NJ遗传树Fig.2 Neighbor-Joining tree of Rb-R-1 and its similar isolates based on their rDNA-ITS sequences
2.2内生真菌Rb-R-1发酵产物的抗氧化活性及总酚与总黄酮含量
通过6种抗氧化活性测定方法对内生真菌Rb-R-1的抗氧化能力进行了评价,由表1可知,内生真菌Rb-R-1发酵产物质量浓度与抗氧化能力成量-效关系。随着发酵产物质量浓度的增大,其抗氧化能力逐渐增强,当发酵产物质量浓度为10 mg/mL时,其DPPH自由基清除率、·OH清除率、O2-·清除率、NO2-清除率、Fe2+螯合率、总抗氧化能力均达到最大值,分别为62.65%、79.99%、51.44%、28.00%、85.80%和4.72 U/mL。从IC50值可以看出,与阳性对照VC和EDTA-2Na相比,内生真菌Rb-R-1发酵产物的DPPH自由基、·OH、O2-·清除能力和Fe2+螯合能力较好。内生真菌Rb-R-1发酵产物中总酚和总黄酮的含量分别为18.12、22.48 mg/g;总抗氧化能力测定结果表明,在质量浓度为10 mg/mL时,内生真菌Rb-R-1发酵产物和VC的总抗氧化能力分别为4.72 U/mL和28.78 U/mL。

表1 不同质量浓度内生真菌Rb-R-1发酵产物的抗氧化能力Table1 Antioxidant activities of the fermentation supernatant of Rb-R-1 at different concentrations
2.3内生真菌Rb-R-1发酵条件优化结果
2.3.1单因素试验结果
单因素试验结果表明,不同单因素培养条件下,内生真菌Rb-R-1发酵产物对DPPH自由基的清除能力不同。
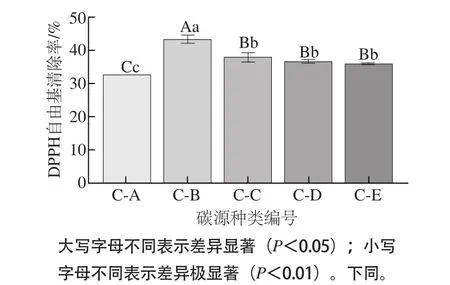
图3 不同碳源对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响Fig.3 Effects of different carbon sources on the DPPH radical scavenging-capacity of Rb-R-1 fermentation products
如图3所示,不同碳源培养条件下,内生真菌Rb-R-1发酵产物对DPPH自由基的清除能力表现为乳糖(43.21%)>蔗糖(37.69%)>葡萄糖(36.40%)>麦芽糖(35.91%)>可溶性淀粉(32.53%)。

图4 不同氮源对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响Fig.4 Effects of different nitrogen sources on the DPPH radical scavenging-capacity of Rb-R-1 fermentation products
如图4所示,不同氮源培养条件下,内生真菌Rb-R-1发酵产物对DPPH自由基的清除能力表现为牛肉膏(56.40%)>蛋白胨(54.36%)>酵母膏(48.70%)>硝酸钠(45.14%)>氯化铵(43.28%)。
以乳糖和牛肉膏分别为碳源和氮源时,各单因素试验结果(图5~8)表明,当初始pH值为7.0、发酵温度为25 ℃、装液量为90 mL/250 mL、发酵时间为10 d时,内生真菌Rb-R-1发酵产物具有最高的DPPH自由基清除率,分别为64.65%、68.61%、70.08%和78.71%。

图5 不同初始pH值对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响Fig.5 Effects of different pH values on the DPPH radical scavengingcapacity of Rb-R-1 fermentation products
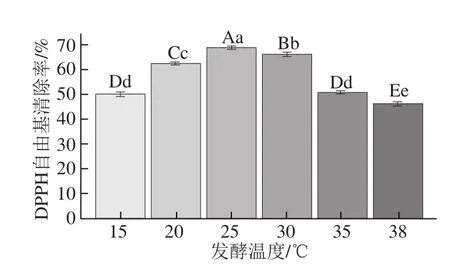
图6 不同发酵温度对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响Fig.6 Effects of different fermentation temperatures on the DPPH radical scavenging-capacity of Rb-R-1 fermentation products

图7 不同装液量对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响Fig.7 Effects of different medium volumes on the DPPH radical scavenging-capacity of Rb-R-1 fermentation products

图8 不同发酵时间对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响Fig.8 Effects of different fermentation times on the DPPH radical scavenging-capacity of Rb-R-1 fermentation products
2.3.2 正交试验结果

表2 内生真菌Rb-R-1最佳发酵条件的正交试验设计及结果Table2 Orthogonal array design with experimental results for optimal culture conditions of Rb-R-1
各因素对试验结果影响极显著(P<0.01)。极差R值的大小表示该因素对试验结果影响的大小,如表2所示,各因素对内生真菌Rb-R-1发酵产物DPPH自由基清除能力影响大小为:氮源量>发酵温度>碳源量>装液量>初始pH值。k值为不同发酵条件下同一因素相同水平下的DPPH自由基清除率平均值。取k值最大时对应的因素水平,即可得出最优组合为A1B1C3D2E2,即最佳发酵条件为碳源量(乳糖)20 g/L、氮源量(牛肉膏)1 g/L、初始pH 7.0、发酵温度25℃、装液量90 mL/250 mL。
进一步对试验结果进行方差分析,结果如表3所示。因素A、B、C、D、E差异均达到极显著水平(P<0.01),表明这5个因素对内生真菌Rb-R-1发酵产物DPPH自由基清除能力的影响都较大。

表3 正交试验结果方差分析Table3 Analysis of variance of the experimental results of orthogonal array dessiiggnn
以上述最佳发酵条件为基础,再次进行最佳发酵时间测定的单因素试验,结果表明,培养10 d后,内生真菌Rb-R-1发酵产物对DPPH自由基的清除率达到最大,为93.12%,明显高于正交试验优化前的单因素试验结果。在上述最优发酵条件下,内生真菌Rb-R-1发酵产物中的总酚、总黄酮含量分别为19.14 mg/g和28.25 mg/g,均高于优化前的含量,表明正交试验优化结果良好。
3 讨 论
新丛赤壳属(Neonectriasp.)真菌是丛赤壳科(Nectriaceae)的重要成员,物种较多。1999年,分类学家重新澄清了其属的概念,认为它们的无性型均属于柱孢属(Cylindrocarpon)[19-20]。该真菌地理范围分布很广,遍布亚洲、欧洲、北美洲[21]。同时,Zhao Peng等[21]采用DNA条形码(ITS rDNA、β-tubulin、EF-1α和RPB2)对该属真菌的分类地位和遗传关系进行了详细总结。该真菌与宿主共生方式多样,曾经作为虫生真菌[22]、云杉小蠹虫伴生真菌[21]、内生真菌[21,23]、植物病原菌[18]被广泛分离和研究。而在本实验中,此真菌作为内生真菌从柴胡红景天中被分离出来,这为高山植物红景天微生态群落的探讨提供了依据。
该真菌作为植物内生真菌或菌根真菌从多种植物中分离出来,表现出了多种多样的生物活性,是寻找天然产物的良好真菌资源。日本学者Shiono等[23]从糙米中分离了内生真菌N. ramulariae,经过研究发现其产生的两种新碱Pyrrospirones A和B具有抑制急性早幼粒细胞白血病HL-60细胞增殖和诱导细胞凋亡的功能;另一项研究表明,N. ramulariae具有产生可以降解聚氨酯等塑料物质的酶的能力[24]。而在本实验中,N. ramulariae被从以强抗氧化能力著称的柴胡红景天中分离出来,表现出强烈的抗氧化能力,这显示出内生真菌与宿主在功能上的一致性,这为进一步丰富该真菌的功能多样性提供了证据,也为从柴胡红景天内生真菌中寻找新的天然抗氧化剂提供了可能。
[1] MA Chaoyang, TANG Jian, WANG Hongxin, et al. Simultaneous determination of six active compounds in Rhodiola L. by RP-LC[J]. Chromatographla, 2008, 67∶ 383-388.
[2] PANOSSIAN A, WIKMAN G, SARRIS J. Rosenroot (Rhodiola rosea)∶ traditional use, chemical composition, pharmacology and clinical ef☒cacy[J]. Phytomedicine, 2010, 17∶ 481-493.
[3] YOUSEF G G, GRACE M H, CHENG D M, et al. Comparative phytochemical characterization of three Rhodiola species[J]. Phytochemistry, 2006, 27∶ 2380-2391.
[4] KUMAR R, TAYADE A, CHAURASIA O P, et al. Evaluation of antioxidant activities and total phenol and flavonoid content of the hydro-alcoholic extracts of Rhodiola sp.[J]. Pharmacognosy Journal, 2010, 2∶ 431-435.
[5] PETRINI O, SIEBER T N, TOTI L, et al. Ecology, metabolite production, and substrate utilization in endophytic fungi[J]. Natural Toxins, 1992, 1∶ 185-196.
[6] STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260∶ 214-216.
[7] RODRIGUEZ R J, HENSON J, VOLKENBURGH E V, et al. Stress tolerance in plants via habitat-adapted symbiosis[J]. The ISME Journal, 2008, 2∶ 404-416.
[8] STROBEL G, DAISY B, CASTILLO U, et al. Natural products from endophytic microorganisms[J]. Journal of Natural Products, 2004, 67∶257-268.
[9] RODRIGUEZ R J, WHITE J F, AMOLD A E, et al. Fungal endophytes∶ diversity and functional roles[J]. New Phytologist, 2009, 182∶ 314-330.
[10] YU N H, KIM J A, JEONG M H, et al. Diversity of endophytic fungi associated with bryophyte in the maritime Antarctic (King George Island)[J]. Polar Biology, 2014, 37(1)∶ 27-36.
[11] 中国科学院《中国植物志》编辑委员会. 中国植物志[M]. 北京∶ 科学出版社, 1984∶ 197.
[12] CUI Jinlong, GUO Shunxing, DONG Hailing, et al. Endophytic fungi from dragon’s blood specimen∶ isolation, identification, phylogenetic diversity and bioactivity[J]. Phytotherapy Research, 2011, 25∶ 1189-1195.
[13] KABIR F, TOW W W, HAMAUZU Y, et al. Antioxidant and cytoprotective activities of extracts prepared from fruit and vegetable wastes and by-products[J]. Food Chemistry, 2015, 167∶ 358-362.
[14] KARIMI E, MEHRABANJOUBANI P, KESHAVARZIAN M, et al. Identification and quantification of phenolic and flavonoid components in straw and seed husk of some rice varieties (Oryza sativa L.) and their antioxidant properties[J]. Journal of the Science of Food and Agriculture, 2014, 94(11)∶ 2324-2330.
[15] GUO Tan, WEI Lei, HOU Chenglin, et al. Antioxidant activities of extract and fractions from Tuber indicum Cooke & Massee[J]. Food Chemisity, 2011, 127∶ 1643-1640.
[16] CHOI S Y, CHUNG M J, SEO W D, et al. Inhibitory effects of Orostachys japonicus extracts on the formation of N-nitrosodimethylamine[J]. Journal of Agricultural and Food Chemisity, 2006, 54∶ 6075-6078.
[17] BAMETT H L, HUNTER B B. 半知菌属图解[M]. 沈崇尧, 译. 北京∶科学出版社, 1977∶ 204.
[18] HIROOKA Y, ICHIHARA Y, MASUYA H, et al. Seed rot, a new disease of beech tree caused by Neonectria ramulariae (anamorph∶Cylindrocarpon obtusiusculum)[J]. Journal of Phytopathology, 2012, 160∶ 504-506.
[19] ROSSMAN A Y, SAMUELS G J, ROGERSON C T, et al. Genera of Bionectriaceae, Hypocreaceae and Nectriaceae (Hypocreales, Ascomycetes)[J]. Studies in Mycology, 1999, 42∶ 1-248.
[20] BRAYFORD D, HONDA B M, MANTIRI F R, et al. Neonectria and Cylindrocarpon∶ the Nectria mammoidea group and species lacking microconidia[J]. Mycologia, 2004, 96∶ 572-597.
[21] ZHAO Peng, LUO Jing, ZHUANG Wenying, et al. DNA barcoding of the fungal genus Neonectria and the discovery of two new species[J]. Science China Life Sciences, 2011, 54∶ 664-774.
[22] 张永杰, 孙炳达, 张姝, 等. 分离自冬虫夏草可培养真菌的多样性研究[J]. 菌物学报, 2010, 29(4)∶ 518-527.
[23] SHIONO Y, SHIMANUKI K, HIRAMATSU F, et al. Pyrrospirones A and B, apoptosis inducers in HL-60 cells, from an endophytic fungus, Neonectria ramulariae Wollenw KS-246[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(23)∶ 6050-6053.
[24] ARACELI L T, GERARDO G S, RAUL R H, et al. Microbial enzymes involved in polyurethane biodegradation∶ a review[J]. Journal of Polymers and the Environment, 2012, 20∶ 258-265.
An Endophytic Fungus with Antioxidant Activity from Rhodiola bupleuroides
CUI Jinlong1, GUO Tingting1,2, WANG Junhong1, WANG Mengliang1,*
(1. Institute of Applied Chemistry, Shanxi University, Taiyuan 030006, China; 2. Institute of Biotechnology, Shanxi University, Taiyuan 030006, China)
In this study, we reported for the first time an endophytic fungus, named Rb-R-1, with antioxidant activity isolated and identified fromRhodiola bupleuroides. The isolate Rb-R-1 was affiliated toNeonectria ramulariaebelonging to the order Hypocrealesin the phylumAscomacota. The fungus possessed high scavenging activities against 1,1-diphenyl-2-picrylhydrazyl (DPPH),·OH, O2-·and NO2-radicals and Fe2+chelating activity, with half maximal inhibitory concentration (IC50) of 8.86, 4.40, 9.65, 16.53 and 1.91 mg/mL, respectively. The contents of total phenolics and total flavonoids in the concentrated culture supernatant of Rb-R-1 were 18.12 and 22.48 mg/g, respectively. The optimal culture conditions that provided maximal DPPH radical scavenging rate (93.12%) were determined as lactose as the carbon source, beef extract as the nitrogen source, initial pH 7.0, 90 mL of the medium in a 250-mL flask and 25℃. In the meantime, the maximal contents of total phenolics and total flavonoids of 19.14 and 28.25 mg/g, respectively, were obtained under these culture conditions.
Rhodiola bupleuroides; endophytic fungi; antioxidant; fermentation condition optimization
Q939.5
1002-6630(2015)17-0022-06
10.7506/spkx1002-6630-201517005
2014-11-03
国家自然科学基金面上项目(31270383);2012年度高等学校博士学科点专项科研基金项目(20121401120001);山西省自然科学基金项目(2014011029-1)
崔晋龙(1976—),男,副教授,博士,研究方向为珍稀药用植物及药用真菌资源开发。E-mail:cjl717@163.com
*通信作者:王梦亮(1966—),男,教授,博士,研究方向为药物中间体合成及开发。E-mail:mlwang@sxu.edu.cn
