非对映异构的(4R)-苄氧基脯氨酸的一锅法合成
2014-12-31马银辉秦露露毛宇鸿
王 舟,马银辉,秦露露,毛宇鸿,王 伟
(陕西师范大学 化学化工学院,陕西 西安 710119)
天然脯氨酸可以催化众多的有机反应,如Aldol反应、α-氨基化反应、Michael反应、开环反应、氧化反应、芳香醛的炔基化反应、Mannich反应、Robinson成 环 反 应、Baylis-Hillman 反 应、Diels-Alder反应等[1-6].脯氨酸分子中同时含有亚氨基和羧基,是双官能团化合物,在催化反应中既可充当路易斯碱又可以作为路易斯酸,因此其具有类似于酶的催化效果.但其催化产率和对映体过量值往往不太令人满意,主要原因是天然脯氨酸分子内的羧基和氨基形成分子内盐,使其在大多数有机溶剂中的溶解度较小,从而影响其催化活性.人们通过对脯氨酸进行结构修饰和改造合成出多种脯氨酸的衍生物如脯氨酰胺类、脯氨醇类以及4-位取代的L-脯氨酸类等[7-9],期望其在溶解性得到改善的同时在催化不对称反应中得到更好的收率和更高的立体选择性.我们在进行脯氨酸类催化剂的合成时,参照文献[10]方法,从N-Boc-(4R)-羟基-(2S)-脯氨酸甲酯出发,通过威廉逊醚化法和再去Boc保护,预计可以得到(4R)-苄氧基-(2S)-脯氨酸.但实验结果显示,所得到的产物的13C NMR谱中的峰均是成对出现的,这一现象引起了我们极大的兴趣.通过对产物的进一步柱色谱分离,最终得到两个纯的化合物,通过对其结构进行表征,确定了产物的结构.产物之一为目标产物(4R)-苄氧基 -(2S)-脯氨酸,另一个产物应该为其非对映异构体(4R)-苄氧基 -(2R)-脯氨酸.本工作用一锅法同时合成了非对映异构的(4R)-苄氧基脯氨酸,可以为D-型脯氨酸衍生物的简便合成提供参考.
1 实验
1.1 试剂与仪器
试剂:N-Boc-(4R)-羟基-(2S)-脯氨酸甲酯,NBoc-(4R)-羟基-(2S)-脯氨酸(分析纯,上海求得生物化工有限公司),氢化钠(60%,分析纯,阿拉丁),溴化苄(分析纯,国药集团上海试剂公司),四氢呋喃、正己烷、甲醇、乙酸乙酯、二氯甲烷等(分析纯,天津富宇试剂厂).
仪器:超导核磁共振仪400M(美国Bruke公司);EQUINX55FT-IR红外光谱仪(KBr压片,德国Brucher公司);质谱仪(美国Bruke公司,ESI);X-5型显微熔点测定仪(北京泰克仪器有限公司).
1.2 合成
(4R)-苄氧基脯氨酸的合成路线见图1.
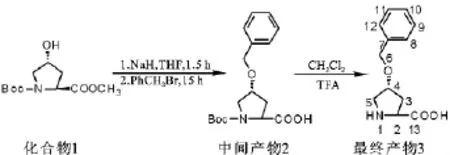
图1 (4R)-苄氧基脯氨酸合成路线Fig.1 Synthesis route of(4R)-benzyloxy-proline
中间产物2的合成参考文献[10].将2.97g(12.1mmol)化合物1溶于40mL无水四氢呋喃中,冰浴下搅拌10min;称取含60% 氢化钠的固体2.04g(51.0mmol),用无水正己烷洗涤3次,烘干后加入,室温下搅拌1.5h;将4.21g(24.6mmol)苄溴溶于10mL无水四氢呋喃中,缓慢滴加,室温反应15h,减压除去溶剂,加入冰水淬灭反应.乙酸乙酯萃取(20mL×3)并弃去该有机相,水相于冰浴冷却下用盐酸(0.5mol/L)调节pH值至4左右,乙酸乙酯萃取(10mL×3),收集有机相,无水硫酸镁干燥,抽滤,减压除去溶剂得黄色油状物N-Boc-(4R)-苄氧基脯氨酸(2)3.64g,产率94%.
产物3的合成:将3.64g(11.3mmol)化合物2溶于10mL二氯甲烷,冰浴下搅拌10min;将21.8mL三氟乙酸和17.3mL二氯甲烷混和均匀,逐滴加入到溶液中,搅拌3h后停止反应,减压除去溶剂,得褐色黏稠状液体.加入5mL乙酸乙酯溶解该黏稠物,去离子水萃取(20mL×3),减压除水至2 mL左右,用浓氨水调节pH值至6左右,再次除水至2mL左右,加入大量丙酮搅拌;有白色固体析出,过滤;母液浓缩后再加入丙酮析出白色固体,过滤,真空干燥,得到白色固体(4R)-苄氧基脯氨酸(3)1.24g,产率为50%.
2 结果与讨论
将合成得到的产物3进行1H NMR、13C NMR波谱表征,结果见表1.

表1 产物3的1 H NMR、13C NMR的谱图相关数据Tab.1 1 H NMR、13C NMR data of product 3
值得注意的是碳谱中脂肪碳的峰都是成对出现(见图2),究竟是什么原因导致碳谱峰发生分裂,我们推测,可能是生成了两种结构相近的化合物.
将所得到的白色固体,经TLC展开后,最终显示为两个点,在此基础上,通过调节流动相的极性,经过柱层析分离,分离条件为:硅胶柱色谱分离(甲醇∶二氯甲烷=1∶4),可得到两种白色固体,两种产物的质量比约为2∶1.对得到的两种产物分别进行了1H NMR、13C NMR、MS、红外光谱、元素分析、熔点等表征.与文献[10]对比可以确定,产量较高的一个产物为(4R)-苄氧基-(2S)-脯氨酸,表征数据如下:HRMS(ESI):[M-H+]C12H15NO3计算值220.097 9,实验值220.097 7;m.p:194~196℃(文献值196~198℃);[α]30D=-34°(c=1,HOAc).产量略低的另一产物推测其结构为(4R)-苄氧基-(2R)-脯氨酸,有关其合成未见文献报道,关于其对映异构体(4S)-苄氧基-(2S)-脯氨酸虽有文献报道[11-12],但合成方法较繁琐,而且没有有关其碳谱具体归属的报道.本文的表征结果如下:HRMS(ESI):[M-H+]C12H15NO3计算值 220.097 9,实验值220.097 5;m.p:190~193℃,[α]30D=-7.6°(c=1,HOAc).文献[11]报道的其对映异构体(4S)-苄氧基-(2S)-脯氨酸[α]30D= +6.9°(c=1,HOAc).

图2 (4R)-苄氧基脯氨酸13C NMR谱图Fig.2 13C NMR spectrum of(4R)-benzyloxy-proline
将两种产物进行1H NMR、13C NMR波谱表征,结果见表2.
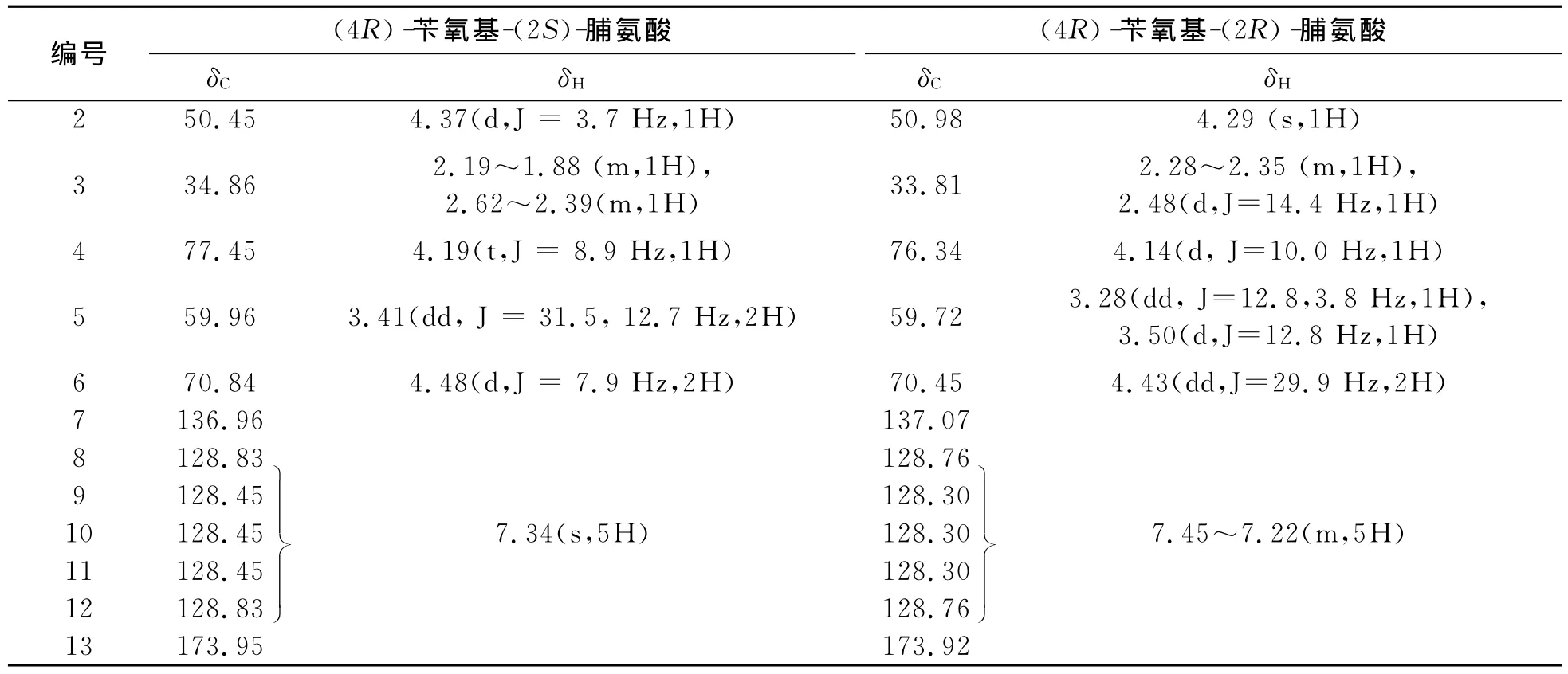
表2 两个产物的1 H NMR、13C NMR的谱图相关数据Tab.2 1 H NMR、13C NMR data of two products
两个产物的13C NMR峰均为单峰,如图3和图4所示,前面的成对情况消失,从MS、元素分析、熔点、旋光度等可以确定两者为非对映异构体,另外从红外光谱数据来看,两者几乎没有差别.

图3 (4R)-苄氧基-(2S)-脯氨酸13C NMR谱图Fig.3 13C NMR spectrum of(4R)-Benzyloxy-(2S)-proline
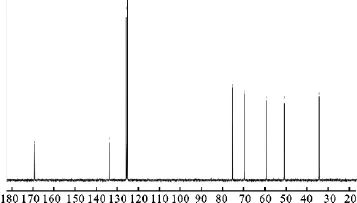
图4 (4R)-苄氧基-(2R)-脯氨酸的13C NMR谱图Fig.4 13C NMR spectrum of(4R)-Benzyloxy-(2R)-proline
当初始原料1换成N-Boc-(4R)-羟基-(2S)-脯氨酸时,得到的最终产物只有一种,即(4R)-苄氧基-(2S)-脯氨酸,这与文献[10]的报道是一致的.对于产生上述现象的原因,本文做以下探讨和推测.
当以N-Boc-(4R)-羟基-(2S)-脯氨酸甲酯为原料时,4位羟基在NaH的作用下脱去质子形成氧负离子,由于所用的NaH是过量的,NaH作为强碱会继续夺取部分2位碳原子上所连接的氢原子,生成碳负离子,碳负离子夺取体系中的一个活泼氢,恢复碳的四面体结构时,使得2位碳原子的构型部分发生翻转,此时体系是N-Boc-(4R)-羟基-(2S)-脯氨酸甲酯和N-Boc-(4R)-羟基-(2R)-脯氨酸甲酯的4位羟基在NaH的作用下脱去质子形成的两种构型的氧负离子的混合物,氧负离子再进攻苄溴进行亲核取代,得到两种产物的混合物,进一步再脱去氮原子上的Boc保护基,最后得到(4R)-苄氧基-(2S)-脯氨酸和(4R)-苄氧基-(2R)-脯氨酸两种产物.
在同样条件下,当以N-Boc-(4R)-羟基-(2S)-脯氨酸为原料时,氢化钠会优先和N-Boc-(4R)-羟基-(2S)-脯氨酸的羧基作用成盐,剩余的氢化钠会进一步夺取4位羟基的氢,生成氧负离子,NaH的量不够继续夺取2位碳原子上所连接的氢原子,所以2位碳原子的构型不会发生翻转,最终只生成(4R)-苄氧基-(2S)-脯氨酸这一种产物,与实验结果一致.
3 结论
本文通过威廉逊醚化合成(4R)-苄氧基-(2S)-脯氨酸同时,得到2-消旋化的产物(4R)-苄氧基-(2R)-脯氨酸.(4R)-苄氧基-(2S)-脯氨酸与(4R)-苄氧基-(2R)-脯氨酸属非对映异构体关系.通过1H NMR、13C NMR、HRMS、红外光谱、熔点等表征,对两种产物结构进行了确认,并对生成两种产物的原因进行了初步探讨.实验的新发现为L-脯氨酸部分转化为D-脯氨酸提供了一种简便的方法,也可以为非对映异构的脯氨酸衍生物的合成和表征提供重要的参考.
[1]List B,Lerner R A,Barbas C F.Proline-catalyzed direct asymmetric aldolreactions[J].Journal of American Chemical Society,2000,122(10):2395-2396.
[2]Guo Haiming,Niu Hongying,Xue Mengxia,et al.LProline in an ionic liquid as an efficient and reusable catalyst for direct asymmetric α-aminoxylation of aldehydes and ketones[J].Green Chemistry,2006,8:682-684.
[3]Wu Luyong,Yan Zeyi,Xie Yongxin,et al.Ionic-liquidsupported organocatalyst for the enantioselective Michael addition of ketones to nitroolefins [J].Tetrahedron:Asymmetry,2007,18(17):2086-2090.
[4]Fache F,Piva O.Synthesis and applications of the first polyfluorousproline derivative [J]. Tetrahedron:Asymmetry,2003,14(1):139-143.
[5]Xu Zhou,Wu Nan,Ding Zhenhua,et al.L-Prolinederived tertiary amino alcohol as a new chiral ligand for enantioselective alkynylation of aldehydes [J].Tetrahedron Letters,2009,50(8):926-929.
[6]Radi M,Bernardo V,Bechi B,et al.Microwave-assisted organocatalytic multicomponent Knoevenagel/hetero Diels Alder reaction for the synthesis of 2,3-dihydropyran[2,3-c]prazoles[J].Tetrahedron Letters,2009,50(47):6572-6575.
[7]Rios R,Ibrahem I,Vesely J,et al.Organocatalytic asymmetric 5-hydroxypyrrolidine synthesis:a highly enantioselective route to 3-substituted proline derivatives[J].Tetrahedron Letters,2007,48(49):8695-8699.
[8]Cheng Chuanling,Sun Jian, Wang Chao,et al.Protonated N′-benzyl-N′-prolylprolinehydrazide as highly enantioselective catalyst for direct asymmetric aldol reaction[J].Chemical Communication,2006,2:215-217.
[9]Bellis E, Kokotos G.4-Substituted prolines as organocatalysts for aldolreactions[J].Tetrahedron,2005,61(36):8669-8676.
[10]韩玉峰,沈宗旋,蒋虹,等.手性催化剂(4R)-苄氧基-(S)-脯氨酸的合成及其对不对称羟醛反应的催化活性[J].应用化学,2004,21(6):641-643.
[11]Papaioannou D,Stavropoulos G,Karagiannis K,et al.Simple synthesis of cis-4-hydroxy--L-proline and derivatives suitable for use as intermediates in peptide synthesis[J].Acta Chemica Scandinavica,1990,44(3):243-251.
[12]Rawson D J.Proline derivatives having affinity for the calcium channelα-2-δsubunit:WO,2004039367[P].2004-05-13.
