黑毛茶中产单宁酶真菌的筛选及产酶条件研究
2014-12-28郑重谊王娇娇张冬雪
郑重谊,王娇娇,资 云,张冬雪,周 辉
(1.湖南农业大学研究生院,湖南长沙410128;2.湖南农业大学食品科技学院,湖南长沙410128)
湖南黑茶是以湖南黑毛茶(老青茶)为原料蒸压成形的紧压茶的总称,它的加工包括杀青、揉捻、渥堆、干燥等多道工序,其中渥堆是关键工序[1],通过霉菌、酵母、细菌等微生物的发酵[2],形成黑毛茶的独特风味[3]。温琼英等[4]研究发现,真菌数量随渥堆时间的延长递增。董坤等[5]研究发现,以曲霉为主的霉菌和以产酒精和酯等生香酵母为主的酵母菌是普洱茶渥堆过程中的优势菌种。黑曲霉能降解单宁,产生没食子酸[6-7],使普洱茶形成深红色的汤色[8]。黑茶中的另一种真菌冠突散囊菌能产生各种胞外酶,促进催化氧化、聚合、降解、转化等反应,改善茶的品质[9],并且该真菌能在单宁为唯一碳源的培养基中生长,具有降解单宁的能力,能降低茶叶苦涩味,使茶叶滋味醇和[10]。
单宁酶,又叫单宁酯酰水解酶,可以水解没食子酸丙酯而生成没食子酸,是目前唯一能将茶多酚中表没食子儿茶素没食子酸酯转化为表没食子儿茶素的酶[11-12],在茶多酚单体的制备上具有重要作用。虽然单宁酶在食品、饲料、医药等行业都有着广泛的应用,但生产成本较高,极大地限制了单宁酶的应用。微生物源单宁酶属于诱导酶,在制备过程中往往需要加入单宁酸或富含单宁酸的物质(如五倍子渣)。若利用五倍子渣作为基质直接进行固态发酵,不仅可以提高五倍子中单宁酸的提取效率,还可以拓宽单宁酶的来源渠道。
作者在此对湖南益阳安化黑茶产区黑毛茶渥堆过程中产单宁酶真菌进行筛选和初步鉴定,并对其产单宁酶条件进行优化。拟为开发利用黑毛茶渥堆过程中的微生物资源、深入了解渥堆过程中微生物的作用机制提供参考。
1 实验
1.1 材料与培养基
黑毛茶样品,取自湖南益阳安化县某黑茶厂渥堆阶段,装入采集袋中,4 ℃保存,备用。
马铃薯培养基(PDA):将马铃薯去皮切块,称取300g,加水1 000mL,煮沸10~20 min,双层纱布过滤,取滤液,用水补足至1 000mL,加葡萄糖20g、琼脂20g,自然pH 值,于121 ℃下高压灭菌20min。
筛选培养基:蔗糖1.0%,NaNO30.3%,K2HPO40.1%,KCl 0.05%,MgSO4·7H2O 0.05%,FeSO40.001%,单宁酸2%,自然pH 值。
发酵培养基:称取提取单宁酸后的五倍子渣及麸皮的混合物共5g,装入250 mL 三角瓶中,加无机盐溶液5 mL。无机盐溶液组分为:NH4NO30.5%、MgSO4·7H2O 0.1%、NaCl 0.1%。
1.2 方法
1.2.1 产单宁酶真菌的筛选
称取25g黑毛茶样品,置于225mL 无菌生理盐水中,10倍梯度稀释后,吸取100μL 稀释液,涂布在添加了单宁酸及指示剂溴酚兰(0.004%)的筛选培养基上,于28℃培养5d(产单宁酶真菌的生长会使培养基由蓝色变为黄色,从而形成变色圈),挑取菌落较大且变色圈直径较大的菌落至无菌的PDA 培养基中,培养一定时间,取孢子进行梯度稀释,从平板上挑取单菌落进行纯化,保存。对变色圈较大的真菌进行镜检,初步鉴定其归属。将产酶活性最高的菌株编号为WC-2。
1.2.2 孢子悬浮液的制备
首先将菌株WC-2在PDA 斜面上进行活化培养,接着取28 ℃培养5d的新鲜斜面若干支,每支加入5 mL无菌生理盐水,用无菌接种环将斜面上的孢子刮下来,将孢子悬浮液移入灭菌的空三角瓶中,振荡摇匀。以上操作均在无菌台中进行,孢子悬浮液中的孢子数量可利用PDA 平板计数。
1.2.3 固态发酵制备单宁酶
在发酵培养基中加入1 mL 孢子悬浮液,充分振荡使孢子与培养基混合均匀后,于28℃恒温培养箱中培养96h。
1.2.4 粗酶液的提取
从培养箱中取出发酵后的固态基质,加入50mL pH 值为5.0的柠檬酸缓冲溶液,于160r·min-1摇床振荡30min,过滤,即得粗酶液。
1.2.5 单宁酶活力的测定
根据单宁酶水解没食子酸丙酯可产生没食子酸,没食子酸与甲醇绕单宁溶液在碱性条件下形成的色团物质在520nm 处具有最大吸收的原理进行测定[13]。
酶活力单位定义为:在30 ℃下,每分钟分解产生1μmol没食子酸所需要的酶量定义为一个酶活力单位。
1.2.6 发酵温度对产单宁酶的影响
在发酵培养基中接种WC-2孢子悬浮液后,放入温度分别为25 ℃、28 ℃、32 ℃、37 ℃、42 ℃的培养箱中培养96h后提取单宁酶并测定酶活力,考察发酵温度对菌株WC-2产单宁酶的影响。
1.2.7 发酵时间对产单宁酶的影响
在发酵培养基中接种WC-2 孢子悬浮液后,于28 ℃培养箱中培养,每隔24h 测定单宁酶活力。以发酵时间为横坐标、单宁酶活力为纵坐标绘制菌株产酶曲线,研究酶活力变化情况。
1.2.8 发酵培养基成分对产单宁酶的影响
分别考察发酵培养基中五倍子渣含量(固形物含量,质量分数,20%、40%、60%、80%)、外加氮源(0.5%的蛋白胨、柠檬酸铵、酵母浸膏、硫酸铵、氯化铵、亚硝酸铵、硝酸铵)、外加碳源(1%的葡萄糖、甘露糖、D-果糖、蔗糖、甘油、α-乳糖)对WC-2菌株产单宁酶的影响:在发酵培养基中接种WC-2孢子悬浮液,于28 ℃培养96h,测定单宁酶活力。
2 结果与讨论
2.1 产单宁酶真菌的筛选
以单宁酸为唯一碳源,从渥堆的黑毛茶中筛选得到5株具有分泌单宁酶活性的真菌(图1),分别编号为WC-1~WC-5,其中菌株WC-2的产酶活性最高,经菌丝体染色镜检,初步鉴定为黑曲霉。
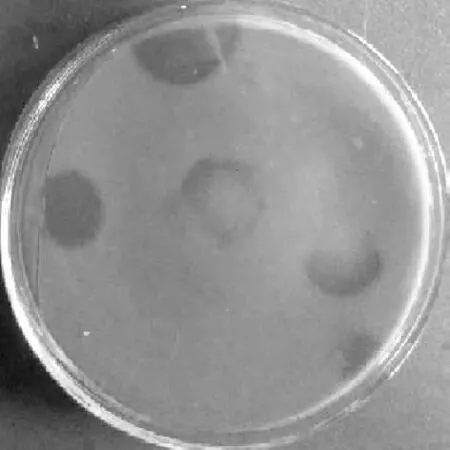
图1 产单宁酶真菌的筛选Fig.1 Screening of tannase-producing fungi
目前报道较多的产单宁酶真菌主要来自于黑曲霉,而黑毛茶在渥堆过程中的主要优势真菌就包括黑曲霉。所以,从黑毛茶中分离出产单宁酶的黑曲霉进一步验证了黑曲霉不仅参与黑毛茶的渥堆过程,还可能参与化学物质的转化和形成。
2.2 发酵条件及发酵培养基组成优化
2.2.1 发酵温度对产单宁酶的影响(图2)
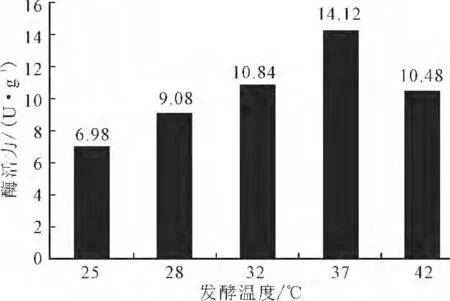
图2 发酵温度对产单宁酶的影响Fig.2 Effect of fermentation temperature on tannase-producing
由图2可看出,菌株WC-2在37 ℃固态发酵下产生的单宁酶活力最强。这与已报道过的黑曲霉产单宁酶最佳温度不一致,可能与该菌株的生长环境有关。因为,在黑毛茶渥堆过程中的温度往往会超过50 ℃,使得耐高温真菌得以存活和生长。因此,选择最佳发酵温度为37 ℃。
2.2.2 发酵时间对产单宁酶的影响(图3)

图3 发酵时间对产单宁酶的影响Fig.3 Effect of fermentation time on tannase-producing
由图3可看出,单宁酶的活力随发酵时间的延长先上升后下降,在72h时单宁酶的活力达到最高,为11.64U·g-1。这是因为,单宁酶的合成和分泌一般在黑曲霉生长最旺盛的阶段(即发酵72~120h),随后单宁酶合成会减弱,并被蛋白酶所降解。因此,选择最佳发酵时间为72h。
2.2.3 五倍子渣含量对产单宁酶的影响(图4)
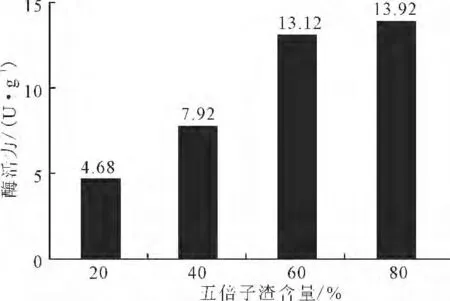
图4 五倍子渣含量对产单宁酶的影响Fig.4 Effect of dallnut dregs content on tannase-producing
由图4可看出,随着发酵培养基中五倍子渣含量的增加,单宁酶活力逐渐升高,在含量为80%时,酶活力最高达到13.92U·g-1。实验发现,在五倍子渣含量超过80%后,发酵培养基在高温灭菌后容易发生结块,不适于固态发酵。因此,选择发酵培养基中的五倍子渣最佳含量为80%。
2.2.4 外加氮源对产单宁酶的影响(图5)
由图5可看出,发酵培养基中添加无机氮源有利于单宁酶的产生,其中以硝酸铵为外加氮源时所产单宁酶活力达到19.65U·g-1。因此,选择最佳外加氮源为硝酸铵,添加量为0.5%。
2.2.5 外加碳源对产单宁酶的影响(图6)
由图6可看出,添加不同碳源时,单宁酶的活力大小依次为α-乳糖>甘露糖>蔗糖>D-果糖>甘油>葡萄糖,其中α-乳糖的效果最好,酶活力可达14.60U·g-1。因此,选择最佳外加碳源为α-乳糖,添加量为1%。
在上述优化的发酵条件和发酵培养基组成下,即五倍子渣含量为80%,外加碳源为α-乳糖、添加量1%,外加氮源为硝酸铵、添加量0.5%,发酵温度37 ℃,发酵时间72h,单宁酶活力达到27.06 U·g-1。

图5 不同外加氮源对产单宁酶的影响Fig.5 Effect of different additional nitrogen sources on tannase-producing

图6 不同外加碳源对产单宁酶的影响Fig.6 Effect of different additional carbon sources on tannase-producing
3 结论
采用富含单宁酸的平板培养基对黑毛茶中产单宁酶的真菌进行筛选,经纯化后初步鉴定该菌为黑曲霉,并对其中一株黑曲霉WC-2产单宁酶的发酵条件以及发酵培养基的组成进行了优化。优化后的条件为:五倍子渣含量80%,外加碳源为α-乳糖、添加量1%,外加氮源为硝酸铵、添加量0.5%,发酵温度37 ℃,发酵时间72h。在此条件下,单宁酶活力最高达到27.06 U·g-1。
[1]傅冬和,刘仲华,黄建安,等.茯砖茶加工过程中主要化学成分的变化[J].食品科学,2008,29(2):64-67.
[2]马静,罗龙新.黑茶加工中微生物鉴定研究进展[J].中国茶叶,2001,(2):12-13.
[3]张大春,王登良,郭勤.黑茶渥堆作用研究进展[J].中国茶叶,2002,24(5):6-8.
[4]温琼英,刘素纯.黑茶渥堆(堆积发酵)过程中微生物种群的变化[J].茶叶科学,1991,(S1):10-16.
[5]董坤,熊辛宇,蓝增全.普洱茶发酵过程中微生物类群分析[J].现代农业科技,2009,(1):164-165.
[6]MUKHERJEE G,BANERJEE R.Biosynthesis of tannase and gallic acid from tannin rich substrates byRhizopusoryzaeandAspergillusfoetidus[J].Journal of Basic Microbiology,2004,44(1):42-48.
[7]van DIEPENINGEN A D,DEBETS A J,VARGA J,et al.Efficient degradation of tannic acid by blackAspergillusspecies[J].Mycological Research,2004,108(8):919-925.
[8]朱宏涛,杨崇仁,李元,等.普洱茶后发酵过程中微生物的研究进展[J].云南植物研究,2008,30(6):718-724.
[9]王志刚,童哲,程苏云.茯砖茶中霉菌含量和散囊菌鉴定及利弊分析(续)[J].食品科学,1992,(6):1-4.
[10]温琼英.茯砖茶中主要微生物的研究[J].茶叶通讯,1986,(4):19-21.
[11]DU Q Z,LI M J,CHENG Q,et al.Purification of(-)-epigallocatechin from enzymatic hydrolyzate of its gallate using high-speed counter-current chromatography[J].Journal of Chromatography A,1995,687(1):174-177.
[12]CAO X L,ITO Y.Preparation and purification of epigallocatechin by high-speed counter-current chromatography(HSCCC)[J].Journal of Liquid Chromatogrphy Related Technologies,2004,27:145-152.
[13]SHARMA S,BHAT T K,DAWRA R K.A spectrophotometric method for assay of tannase using rhodanine[J].Analytical Biochemistry,2000,279(1):85-89.
