尾巨桉不同类型愈伤组织内源激素含量差异比较
2014-12-27欧阳乐军沙月娥黄真池李莉梅曾富华
欧阳乐军,沙月娥,黄真池,李莉梅,曾富华
(1.广东石油化工学院,广东 茂名 525000;2. 湛江师范学院,广东 湛江 524048)
尾巨桉不同类型愈伤组织内源激素含量差异比较
欧阳乐军1,沙月娥2,黄真池2,李莉梅1,曾富华2
(1.广东石油化工学院,广东 茂名 525000;2. 湛江师范学院,广东 湛江 524048)
本实验以尾巨桉无性系(DH32-29)无菌苗的茎段为外植体诱导得到的绿色、黄绿色、白色和褐色4种类型愈伤组织为材料。检测不同愈伤组织中内源激素的含量,结果显示,绿色和黄绿色胚性愈伤组织中的IAA、ABA、6-BA含量均比白色和褐色的非胚性愈伤组织高,其中ABA的差异最大,而GA3含量则在非胚性愈伤组织中含量较高。较高含量的GA3不利于胚性愈伤组织的形成,而往培养基中添加适量的ABA可提高尾巨桉胚性愈伤组织的形成率及胚状体的发生率。本研究为尾巨桉胚状体诱导及分化机理提供借鉴与参考。
尾巨桉 愈伤组织 内源激素
尾巨桉是我国种植面积最大的桉树人工林树种[1],其种苗培育一直通过组织培养扩繁的方式进行,但由于不定芽分化困难,再生效率不高[2]。利用体细胞胚胎发生途径再生能增加繁殖系数,提高种苗质量,降低种苗生产成本。加之,尾巨桉胚性细胞繁殖快,同步性好,具有很强的接受外源DNA的能力,是理想的外源基因转化感受态细胞。因此,胚状体诱导在高效遗传转化体系的建立、离体种子资源保存等许多方面都有广泛的应用,社会、经济及生态效益良好[3]。非胚性愈伤组织(Non-embryonic callus,NEC)细胞木质化程度高,活力不强,难以接受外源基因而转化成功,也难以再生成植株。建立尾巨桉胚性愈伤组织(Embryonic callus,EC)高频发生体系是诱导尾巨桉胚状体发生的前提。
近年来,在植物胚性细胞发育及胚状体发生过程的研究上,研究者已不仅仅局限于组织形态学上的描述,而是在此基础上,结合生理生化的研究,探讨体细胞胚性的启动及胚状体发生的生理及分子机制。胚状体发生是体细胞脱分化进而再分化的过程,这个过程中细胞内源激素含量的变化与胚性愈伤组织分化形成胚状体有紧密的相关性[4-7]。本实验室在前期研究工作中,通过多种植物生长调节剂的组合运用,成功诱导得到尾巨桉胚性愈伤组织。本研究以尾巨桉胚性与非胚性愈伤组织为材料,通过高效液相法测定胚性愈伤组织及非胚性愈伤组织内源激素含量的差异,可为胚状体诱导及分化机理提供借鉴与参考。
1 材料与试剂
1.1 材 料
采用本实验室前期实验诱导得到的4种不同颜色尾巨桉愈伤组织为材料,其中绿色和浅黄色的高活性的为胚性愈伤组织,白色和褐色为非胚性愈伤组织[8]。
1.2 主要试剂
IAA(生长素)、GA3(赤霉素)、ABA(脱落酸)、6-BA标准品、PVPP(交联聚乙烯吡咯烷酮)均购置上海生工,其他试剂为国产分析纯,购置广州化学试剂厂。
2 方法
2.1 IAA、GA3、ABA、6-BA标准样品的制备
分别称取IAA、GA3、ABA、6-BA标准样品0.01 g,分别配制成 0.006 25、0.012 5、0.025、0.05、0.1 mg·mL-1的标准待测液。
2.2 IAA、GA3、ABA的提取、分离及其含量检测
2.2.1 IAA、GA3、ABA的提取
分别称取绿色、浅黄色、白色和褐色尾巨桉愈伤组织材料各2 g,加20 mL 80%预冷的甲醇研磨,于0℃中浸提21 h(隔一段时间振荡一下),接着离心30 min(4℃,9 500 rpm),残渣用8 mL80%甲醇洗涤、搅匀,浸提3 h然后离心30 min(4℃,9 500 rpm),残渣再重复浸提及离心的步骤,最后合并3次离心滤液。
2.2.2 IAA、GA3、ABA的分离
上述得到的滤液放在旋转蒸发仪上于40℃减压浓缩至水相。将水相在-39℃冻12 h,于4℃下解冻,离心30 min(4℃,11 600 rpm),取上清液,用 0.2 mol·L-1Na2HPO4调 pH 至 8.0,然后用等体积的乙酸乙酯和石油醚萃取3次,合并酯相,同时合并水相,用2 mL pH8.0磷酸缓冲液将酯相洗涤三次,合并水相,弃去酯相。水相于40℃下浓缩除去残余酯相,再往水相加入1 g 交联聚乙烯吡咯烷酮(PVPP),于5℃低温摇床中摇30 min,过滤除去PVPP,滤液用1 mol·L-1柠檬酸调pH至2.8。接着滤液用等体积的乙酸乙酯萃取3次,合并酯相,除去水相,酯相于-39℃冰冻过滤除去水分,于40℃旋转蒸发仪中浓缩至干,最后用流动相定容至2 mL。
2.2.3 HPLC法检测前流动相、标样及样品的前处理
流动相中甲醇及0.01 mol·L-1磷酸分别经过有机相滤膜和水系滤膜进行抽滤,抽滤结束后超声30 min。
不同浓度的标准品及样品用0.45 μm孔径滤膜过滤,用1.5 mL收集瓶收集,用振荡器震荡50 s。
2.2.4 HPLC法检测IAA、GA3、ABA含量
样品的检测在中国热带农业科学院农产品加工研究所进行。色谱分离条件为:流动相︰甲醇︰ 0.01 mol·L-1H3PO4=42︰ 58(V ︰ V);流速:1 mL·min-1;检测波长:218 nm、265 nm、210 nm;进样量:15 μL。IAA、GA3、ABA各种浓度的标准液和各种愈伤组织样品溶液进样检测,记录数据。
2.3 6-BA的提取、分离及其含量检测
2.3.1 6-BA的提取
分别称取绿色、白色、黄色及褐色愈伤组织材料各2 g,提取方法同2.2.1。
2.3.2 6-BA的分离
将得到的滤液放在旋转蒸发仪上于40℃减压浓缩至水相。将水相在-39℃冻12 h,然后于4℃下解冻,离心30 min(4℃,11 600 rpm),取上清液。上清液用1 mol·L-1柠檬酸调pH至3.0,接着用等体积石油醚和乙酸乙酯萃取3次,弃去酯相,水相40℃浓缩除去残余酯相。往水相加入0.5 g PVPP,于5℃摇床中摇30 min,过滤,除去PVPP,再用 0.2 mol·L-1Na2HPO4调 pH 至 8.0,加入等体积乙酸乙酯萃取3次,黑暗条件下,酯相于蒸发皿中60℃水浴蒸干。用流动相将残质洗脱下来,定容到2 mL。
2.3.3 HPLC法检测前流动相、标样及样品的前处理
流动相中甲醇及1%冰醋酸分别经过有机相滤膜和水系滤膜进行抽滤,抽滤结束后于超声仪中超声30 min。
不同浓度的标准品及样品用0.45 μm孔径滤膜过滤后用收集瓶收集,震荡50 s用作待测液。
2.3.4 6-BA含量检测
样品的检测在中国热带农业科学院农产品加工研究所进行。色谱分离条件为:流动相︰甲醇︰1%冰醋酸=40︰60(V︰V);流速:1 mL·min-1;检测波长:210 nm;进样量:15 μL。6-BA各种浓度的标准液和各种愈伤组织样品溶液进样检测,记录数据。
3 结果与分析
3.1 IAA、GA3、AB及6-BA标准曲线制作
根据不同浓度标准品出峰规律,找出物质峰,确定该物质的保留时间,IAA、GA3、ABA的保留时间分别为:7.850 2±0.020 9、5.183 2±0.010 5、13.397 2±0.016 5(IAA、GA3、ABA标准品色谱图见图1A、B、C)。以标准品进样量为横坐标,峰面积为纵坐标,将所得数据绘制IAA、GA3、ABA标准曲线如图2所示,IAA线性方程为y =2E + 08x-95 391(R2=0.999 9),GA3线性方程为y =1E + 07x +1 993.9(R2=0.999 9),ABA线性方程为y= 8E + 07x-45 880(R2=0.999 8)。
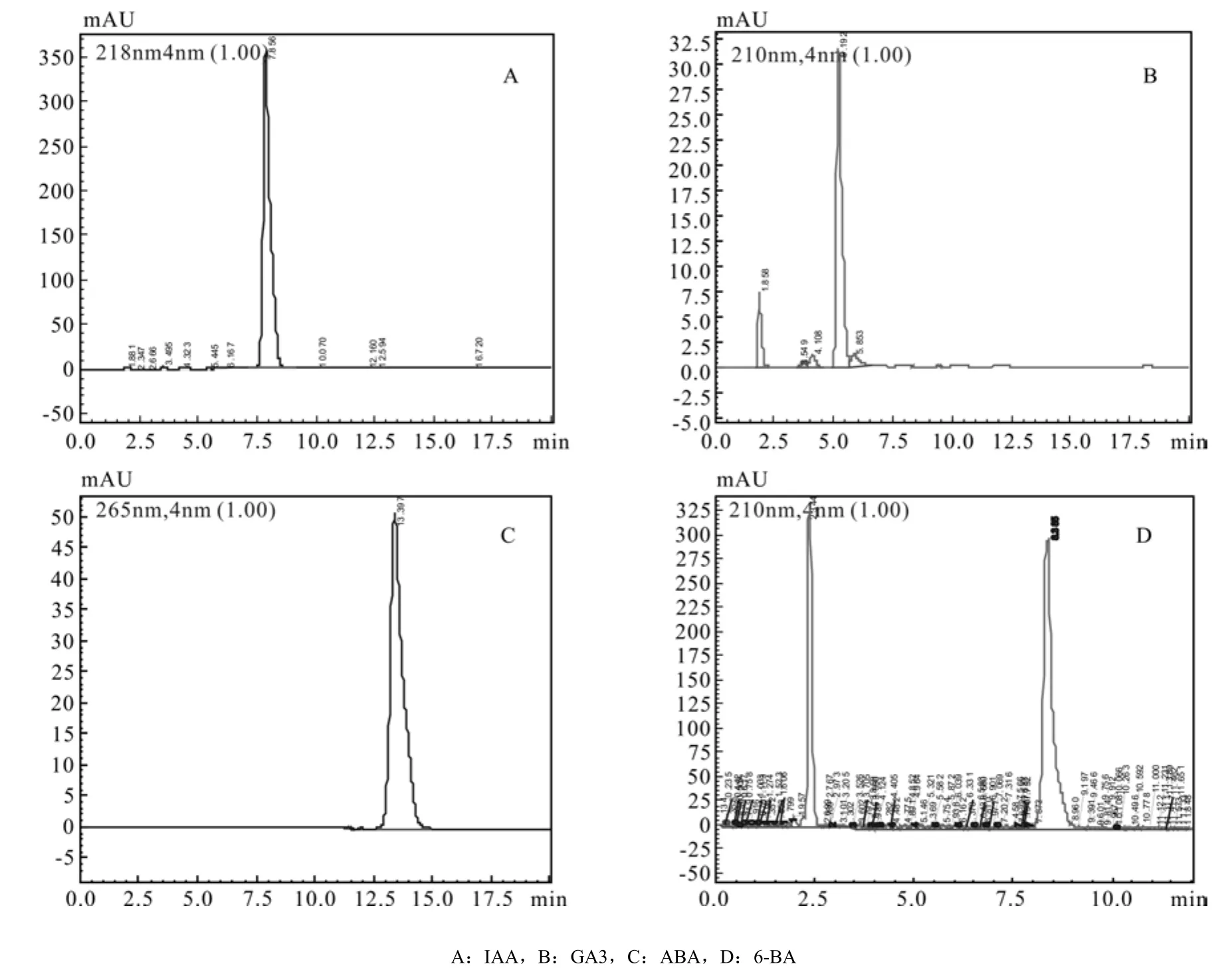
图1 0.05 mg·L-1标准品的色谱图Fig.1 Chromatogram of 0.05 mg·L-1 standard samples
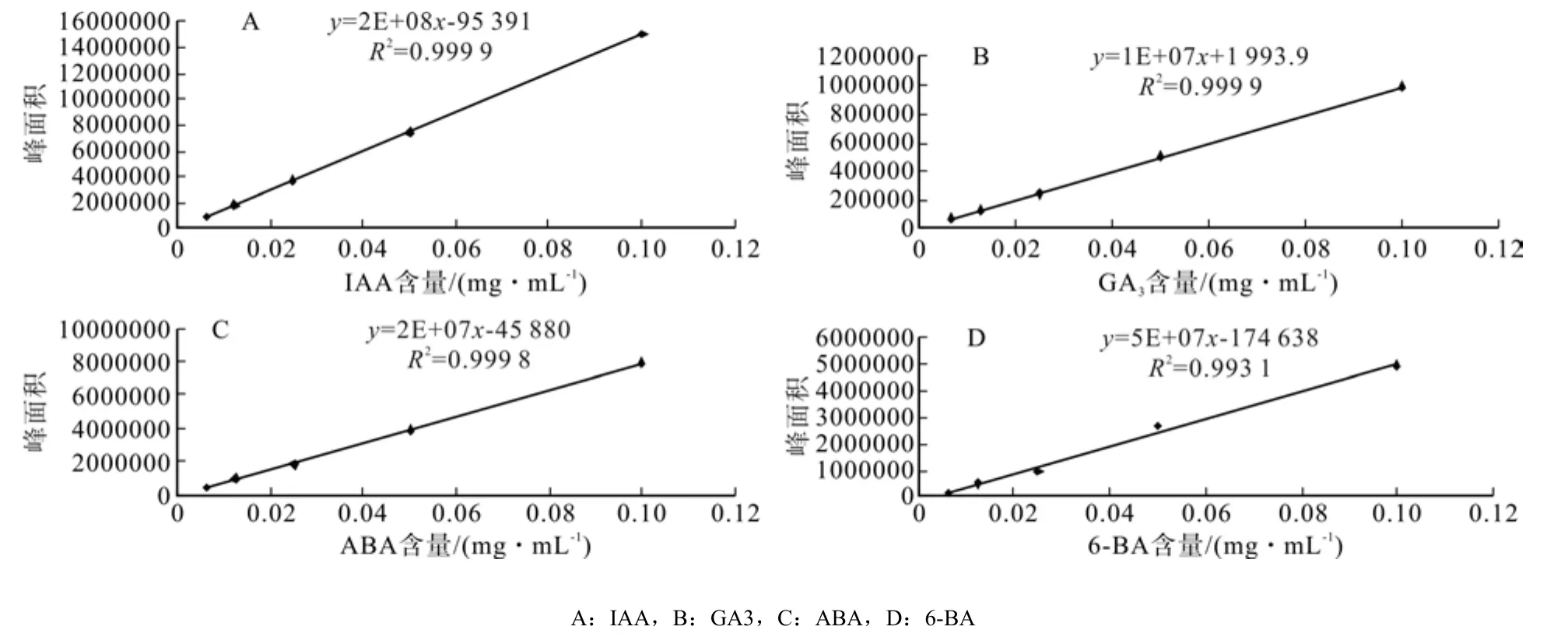
图2 标准品的标准曲线Fig.2 Standard curve of standard samples
表明 IAA、GA3、ABA 在 0.006 25 ~ 0.1 mg·mL-1浓度范围内均与吸收峰面积线性关系良好。
根据不同浓度6-BA标准品出峰规律,找出6-BA物质峰,确定6-BA的保留时间,6-BA的保留时间为:2.3458±0.0033(6-BA标准品色谱图见图1D)以标准品进样量为横坐标,峰面积为纵坐标,将所得数据绘制6-BA标准曲线如图2所示,6-BA线性方程为y = 5E+07x-174 638(R2=0.993 1),线性范围为 0.006 25 ~ 0.1 mg·mL-1。
3.2 样品中IAA、GA3、ABA含量检测
3.2.1 4种愈伤组织IAA含量的比较
4种愈伤组织的IAA色谱图见图3,通过色谱图中IAA物质峰面积计算4种愈伤组织中IAA含量,得到绿色愈伤组织IAA含量最高为714.73 ng·g-1,其次是浅黄色愈伤组织,其IAA含量为622.18 ng·g-1,白色及褐色愈伤组织IAA含量较低,分别为491.03、484.76 ng·g-1(图4)。由此可看出,胚性愈伤组织比非胚性愈伤组织中IAA含量高。
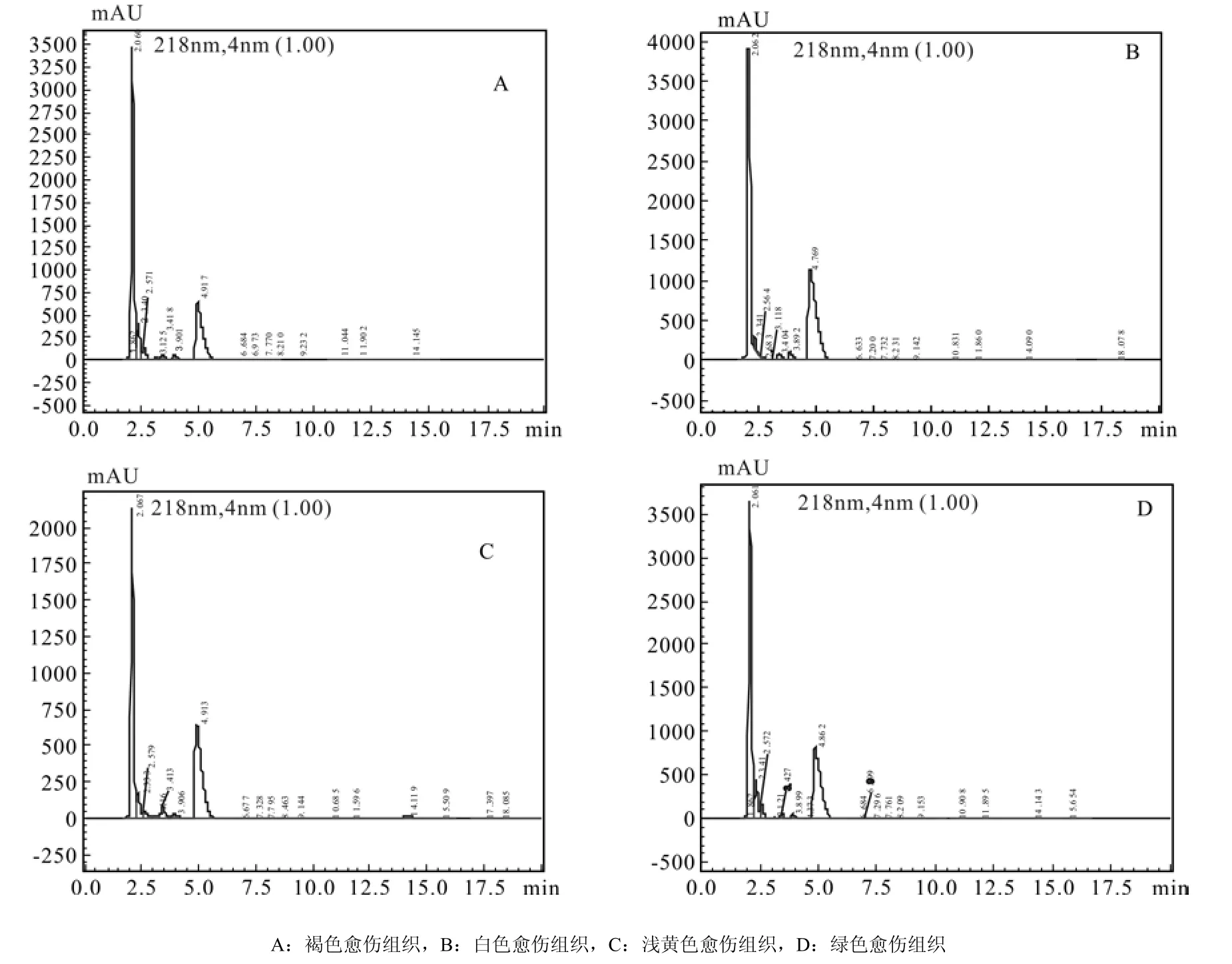
图3 IAA在218 nm通道下色图谱Fig.3 Chromatogram of IAA in 218 nm
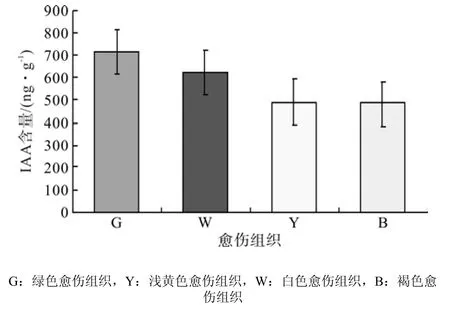
图 4 不同类型愈伤组织中IAA含量差异Fig.4 Difference of IAA content in different types of calli
3.2.2 4种愈伤组织GA3含量的比较
4种愈伤组织的GA3色谱图见图5,通过色谱图中GA3物质峰面积计算4种愈伤组织中GA3含量,发现4种愈伤组织中褐色愈伤组织GA3含量最高,达到3.99 mg·g-1,其次是白色愈伤组织,绿色愈伤组织中GA3含量最低,也就是非胚性愈伤组织中GA3含量比胚性愈伤组织中高(图6所示)。
3.2.3 4种愈伤组织ABA含量的比较
4种愈伤组织的ABA色谱图见图7,通过色谱图中ABA物质峰面积计算4种愈伤组织中ABA含量,发现4种愈伤组织中ABA水平比IAA水平高,但比GA3水平低得多。其中绿色愈伤组织ABA含量最高,浅黄色愈伤组织中ABA含量是绿色愈伤组织的0.5倍,而褐色愈伤组织中ABA含量最低,不到绿色愈伤组织的1/4,差异达到极显著水平。由此可知胚性愈伤组织中ABA含量比非胚性愈伤组织中高(图8所示)。

图5 GA3 在210 nm通道下色谱图Fig.5 Chromatogram of GA3 in 210 nm
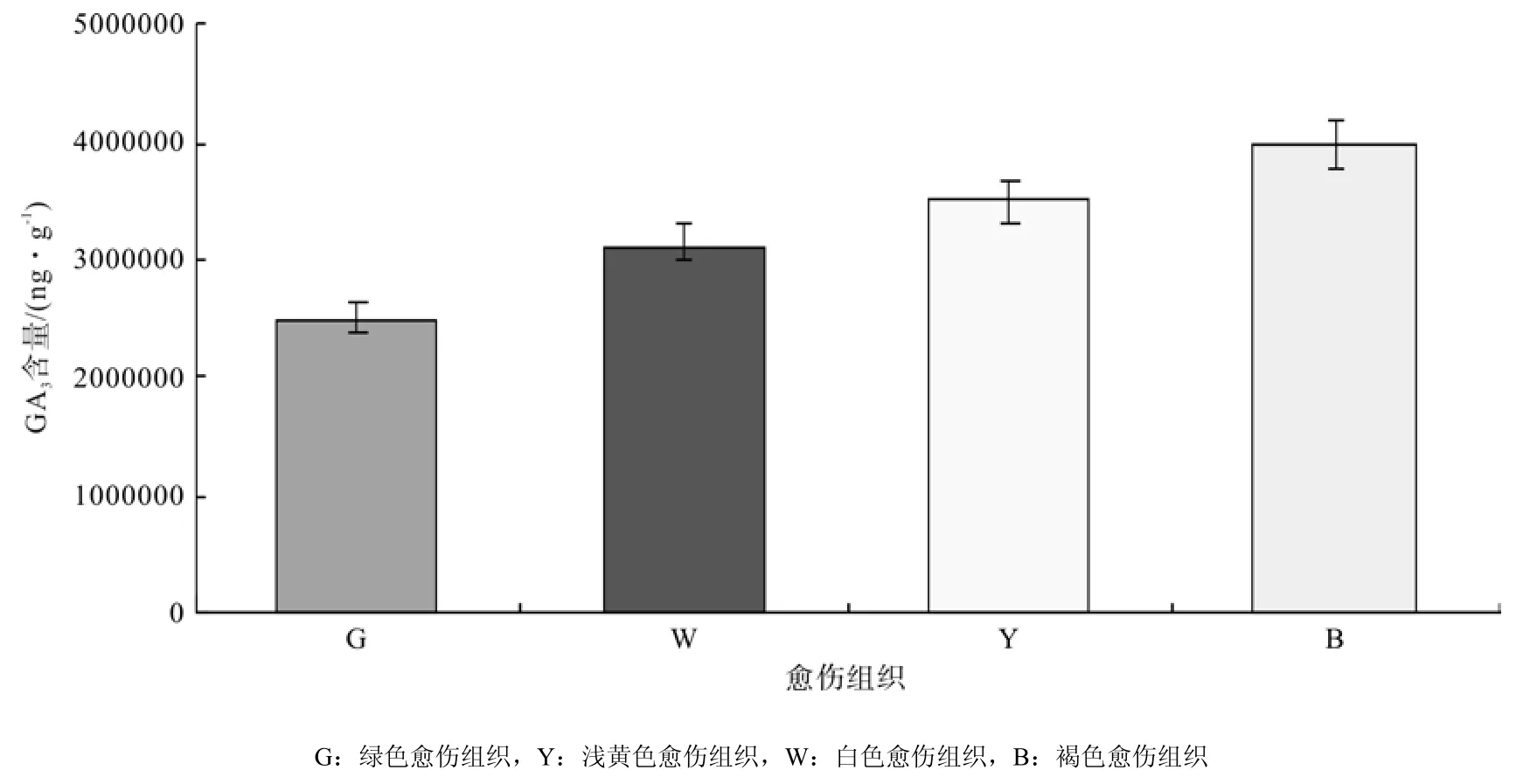
图6 不同类型愈伤组织中GA3含量差异Fig.6 Difference of GA3 content in different types of calli
3.2.4 样品中6-BA含量测定
4种愈伤组织的6-BA色谱图见图9,图中显示,210 nm下白色愈伤组织和褐色愈伤组织样品的杂峰比较多。通过色谱图中6-BA物质峰面积计算4种愈伤组织中6-BA含量,发现4种愈伤组织中6-BA水平比IAA、ABA水平高,但比GA3水平低。其中浅黄色愈伤组织含量最高,其他3种愈伤组织含量相近,但总体来说,胚性愈伤组织中6-BA含量比非胚性中的高(图10所示)。
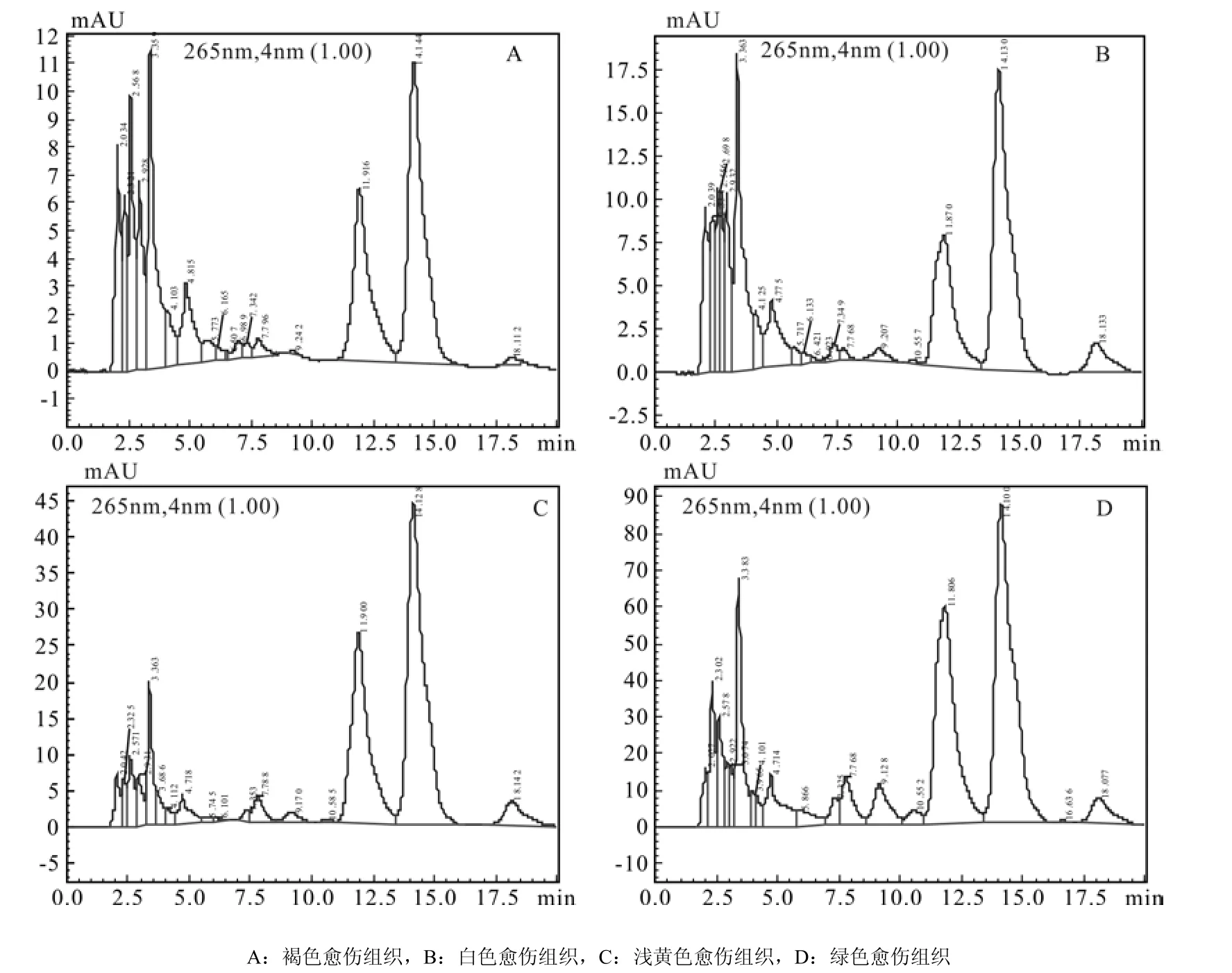
图7 ABA 在265 nm通道下色谱图Fig.7 Chromatogram of ABA in 265 nm
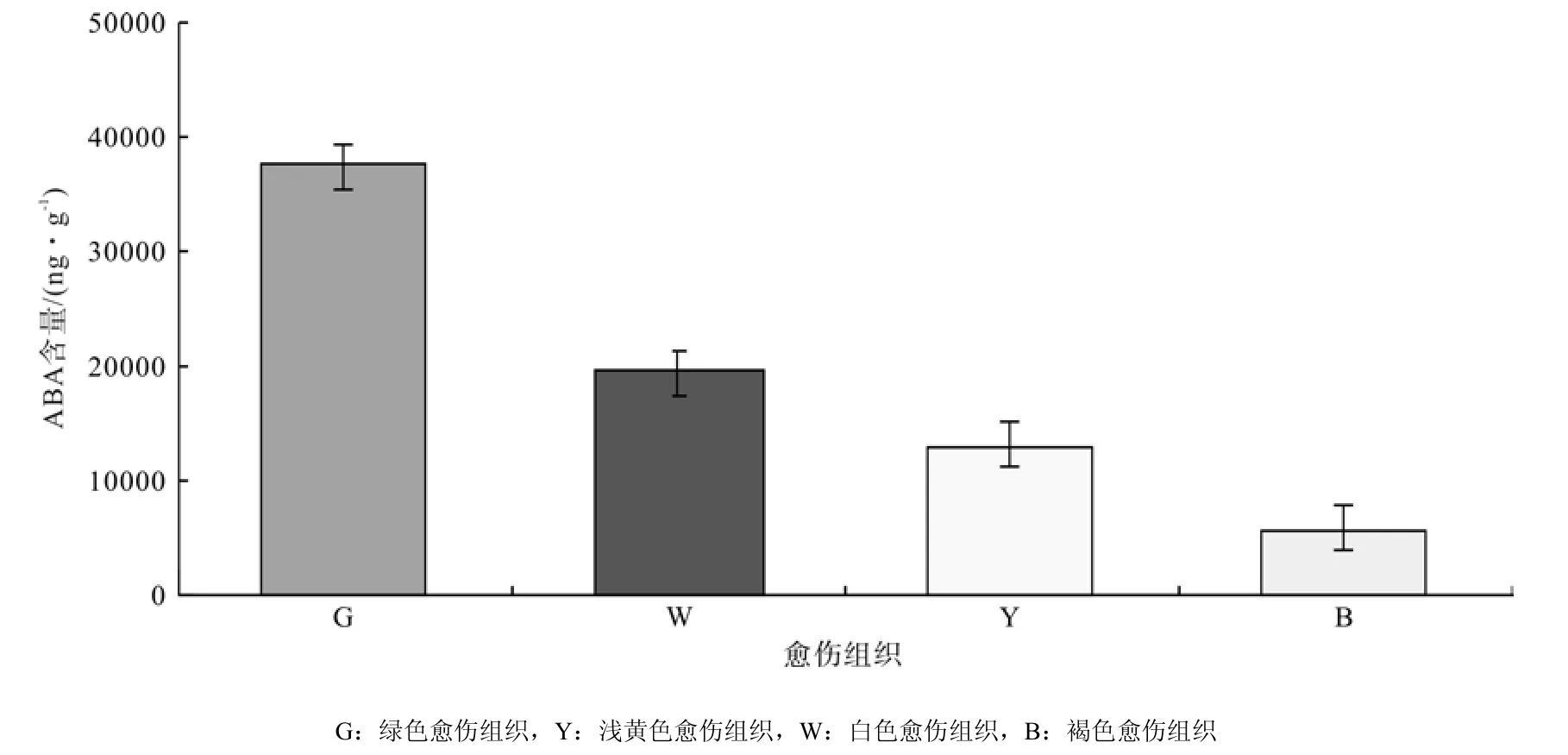
图8 不同类型愈伤组织中ABA含量差异Fig.8 Difference of ABA content in different types of calli
4 讨 论
胚状体形成及胚性愈伤组织分化是一个极为复杂的生理生化和形态发生过程,是植物体内各种因素共同作用、相互协调的结果,期间各类植物激素发挥不同作用,同时呈现一定的变化规律[9-12]。
本研究检测了胚性愈伤组织与非胚性愈伤组织中内源激素含量,通过比较发现,胚性愈伤组织中IAA、ABA含量比非胚性愈伤组织中的高,而GA3则相反。赖钟雄等[13]在龙眼胚状体内源激素变化的研究中发现胚性愈伤组织中内源IAA水平大大高于非胚性愈伤组织,因此其推测相对高水平的内源IAA含量是诱导和维持胚性细胞的基础。本研究结果与其相类似。
生长素用于启动细胞分裂及其胚性潜力的诱导,本实验发现胚性愈伤组织中IAA含量相对较高,细胞分裂素类物质一般被认为不是启动胚性必需的,但是在某些植物上,这类物质对其胚状体的发生也起着关键的作用,生长素与细胞分裂素的适当组合能有效诱导胚状体的发生。内源脱落酸与体细胞胚性能力的启动或者表达相关,本研究发现胚性与非胚性愈伤组织中ABA含量差异较明显。张媛媛[14]等人的研究表明,ABA在植物体细胞胚形成期逐渐上升,并且ABA∶IAA相对比值在此阶段仍然处于较高水平,高ABA∶IAA比值有利于体细胞胚的形成,这与本研究结论相一致。
愈伤组织中的色素会干扰激素的检测,不同颜色的愈伤组织中含有的色素也不一样,因此给内源激素的检测带来难度[15]。本实验中利用的脱色剂为石油醚,但是样品即使研磨得很细,脱色后仍然有微小的愈伤组织颗粒,结合在这些小颗粒上的色素难以清除干净。这可能就导致了在ABA、6-BA检测时出现很多杂峰。而且愈伤组织中内源激素含量与愈伤组织的选择等外界条件有很大的关系,同时也与测定时的流动相、流速和检测波长有关,而且合适的内源激素提取方法的选择和色谱条件也较为重要。对于尾巨桉愈伤组织诱导中,外源激素处理与内源激素含量变化间的相关性以及愈伤组织分化不同阶段中内源激素含量变化规律还有待进一步研究。
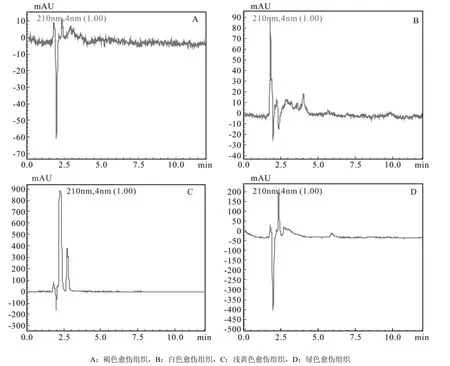
图9 6-BA 在210 nm通道下色谱图Fig.9 Chromatogram of 6-BA in 210 nm
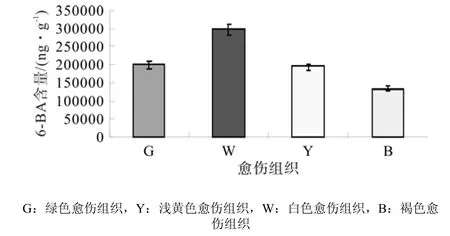
图10 不同类型愈伤组织中6-BA含量差异Fig.10 Difference of 6-BA content in different types of calli
[1] OUYANG L J, HUANG Z C, ZHAO L Y, et al. Regeneration of Eucalyptus urophylla ×Eucalyptus grandis from clonal material stem segments, Brazilian Archives of Biology and Technology[J],2012, 55(3): 329-334.
[2] 杨民胜, 谢耀坚, 刘杰锋. 中国桉树研究三十年[M]. 北京:中国林业出版社, 2011.
[3] 沙月娥, 欧阳乐军, 彭 舒, 等. 桉树胚状体再生与遗传转化的研究进展[J]. 植物生理学报, 2012, 48(4): 325-332.
[4] 马生健,曾富华,余炳生,等.高羊茅愈伤组织诱导与内源激素含量研究[J].湛江师范学院学报, 2002, 23(6):53-56.
[5] 陈春玲, 赖钟雄. 龙眼体细胞胚胎过程中内源多胺的变化[J].福建农林大学学报, 2006, 35(4): 381-383.
[6] 贾小霞,王汉宁,孔维萍,等.玉米幼胚和成熟胚愈伤组织诱导过程中内源激素的比较[J].核农学报, 2009,23(4):555-560.
[7] Pinto G, Silva S, Neves L, Araújo C, Santos C. Histocytological changes and reserve accumulation during somatic embryogenesis in Eucalyptus globulus [J]. Trees, 2010, 24: 763-769.
[8] 欧阳乐军, 黄真池, 沙月娥, 等. 新型分裂素PBU对尾巨桉胚性愈伤组织诱导及植株再生的影响[J]. 植物生理学报,2011, 47(8): 785-791.
[9] 邢登辉, 赵云云, 黄承芬. 皇冠草体细胞胚发生及其体胚发生过程中内源激素的变化[J].生物工程学报,1999,15(1):98-103.
[10] 陈春玲. 龙眼体细胞胚胎发生机理的初步研究[D], 福建农林大学硕士学位论文, 2001.
[11] 付凤玲, 冯质雷, 渠柏艳, 等.玉米未成熟胚胚性愈伤组织诱导率与内源激素含量的关系[J].核农学报, 2006,20(1):10-14.
[12] 潘瑞炽.植物生理学[M].北京: 高等教育出版社, 2001.
[13] 赖钟雄, 陈春玲. 龙眼体细胞胚胎发生过程中的内源激素变化[J]. 热带作物学报, 2002, 23(2): 41-47.
[14] 张媛媛,马晖玲,俞 玲,等. 草地早熟禾愈伤组织诱导和分化中内源激素水平分析[J]. 甘肃农业大学学报, 2013,48(2): 74-79.
[15] 郭敏敏,王清连,胡根海.利用高效液相色谱法分离和测定棉花组织培养过程中4种内源激素[J].生物技术通讯,2009,20(2): 213-216.
Study on Difference of Callus of Eucalyptus urophylla × Eucalyptus grandis
OUYANG Le-jun1, SHA Yue-e2, HUANG Zhen-chi2, LI Li-mei1, ZENG Fu-hua2
(1. Guangdong University of Petrochemical Technology, Maoming 525000, Guangdong, China; 2. Zhanjiang Normal University,Zhanjiang 524048, Guangdong, China)
Hypocotyls excised from Europhylla formed callus.Then later, the callus differentiated into 4 types, including brown callus,green callus, yellowish green and white callus.The levels of endogenous phytohormones were detected by HPLC. The result showed the contents of IAA、ABA and 6-BA in embryogenic calli were higher than those in non-embryogenic calli while the content of GA3was higher in non-embryogenic calli. GA3may deteriorate the capacity of calli to differentiate. The addition of ABA was benef i cial for embryogenic callus induction and somatic embryogenesis. With this work we lay the foundation for the eff i cient somatic embryogenesis in E. urophylla × E. grandis.
Eucalyptus urophylla×Eucalyptus grandis; Callus; endogenous phytohormones
S718.46
A
1673-923X(2014)12-0071-07
2013-12-13
国家自然科学基金项目(31470677);广东省自然科学基金项目(S2013040014690,S2012010008737);广东省科技计划项目(2012A020602108)
欧阳乐军,男,博士,研究方向为林木组织培养与生物技术研究;E-mail:ljouyang@zhjnc.edu.cn
[本文编校:吴 彬]
