超声波辅助提取牛蒡根多酚工艺参数优化*
2014-12-25范金波蔡茜彤冯叙桥侯宇
范金波,蔡茜彤,冯叙桥,侯宇
(渤海大学食品科学研究院,辽宁省食品安全重点实验室,辽宁锦州,121013)
牛蒡(Arctium lappa L.)俗称“狗宝”,属橘梗目,菊科2年生草本植物,牛蒡在温带广泛分布,我国东北、华北、西北地区,华东、华中、西南部分均有种植[1]。牛蒡根肉质肥大,是一种营养保健品,其胡萝卜素含量比胡萝卜高150倍,蛋白质和钙的含量为根茎类之首,新鲜牛蒡富含多种多酚化合物,包括绿原酸、异绿原酸、咖啡酸、槲皮素等[2]。Mikami-Konishide等[3]研究日本的71种果蔬多酚提取物清除氧自由基的能力,发现牛蒡多酚提取物清除氧自由基的能力仅次于长果种、紫苏和空心菜位于第4位。娄在祥[4]利用超声微波辅助提取牛蒡叶多酚,并鉴定了牛蒡叶的11种活性成分,包括槲皮素、槲皮苷、咖啡酸、绿原酸、芦丁、苯甲酸等,且研究发现牛蒡多酚提取物有着与合成抗氧化剂特丁基对苯二酚(tert-Butylhydroquinone,TBHQ)相近的抗氧化活性。Ku[5]和Liu[6]等报道牛蒡多酚提取物对于幽门螺杆菌引发的胃溃疡有辅助治疗作用。
超声波能够产生机械振动,并具有强烈的空化效应,能够造成细胞结构的破坏,从而加速目标成分的溶出,在缩短提取时间的同时避免了高温对有效成分的破坏[7]。本研究利用超声波辅助提取牛蒡多酚,优化了牛蒡根黄酮和总酚的提取条件,并探讨了牛蒡多酚抗氧化活性。
1 材料与方法
1.1 仪器和试剂
RRH-A500高速多功能粉碎机,上海缘沃工贸有限公司;UV-2700紫外-可见光分光光度计,日本SHIMADZU公司;JA5003电子天平,上海舜宇恒平科学仪器有限公司;Centrifuge5804-R冷冻离心机,德国eppendorf公司;KQ5200DE型数控超声波清洗器:昆山市超声仪器有限公司。
牛蒡,徐州大自然公司提供;芦丁和没食子酸,北京百灵威科技有限公司;Folin-Ciocalteu试剂,天津市光复精细化工研究所;NaNO2、无水乙醇、Al(NO3)3、NaOH等试剂均为分析纯。
1.2 实验方法
1.2.1 牛蒡预处理
将新鲜牛蒡根清洗切片,并于0.5%抗坏血酸溶液中浸泡30min[8],沥干切碎后,40℃热风烘干至恒重,粉碎,过60筛,制得牛蒡干粉,低温冻存备用。
1.2.2 单因素实验设计
1.2.2.1 提取温度对牛蒡多酚得率的影响
选取提取温度分别 30、40、50、60、70、80℃,在体积分数60%乙醇、提取时间为30 min、超声功率200 W,料液比为1∶20(g∶mL)条件下,研究提取温度对牛蒡多酚得率的影响。
1.2.2.2 乙醇体积分数对牛蒡多酚得率的影响
分别选用体积分数0%、20%、40%、60%、80%、100%的乙醇作为溶剂,在提取时间为30 min、料液比为1∶20(g∶mL)、超声功率 200 W、提取温度 40℃条件下,研究乙醇浓度对牛蒡多酚得率的影响。
1.2.2.3 料液比对牛蒡多酚得率的影响
选取料液比1∶8、1∶12、1∶16、1∶20、1∶24、1∶28(g∶mL),在乙醇体积分数60%、提取时间30 min、超声功率200 W条件下,研究料液比对牛蒡多酚得率的影响。
1.2.2.4 提取时间对牛蒡多酚得率的影响
选择提取时间为10、20、30、40、50、60 min,在乙醇体积分数为60%、料液比为1∶20(g∶mL)、超声功率200 W条件下,考察不同提取时间对牛蒡多酚得率的影响。
1.2.3 响应面实验设计
通过单因素实验结果,选取乙醇浓度、料液比和超声时间为3个考察因素,利用Box-Behnken设计方法,选3个中心点进行15个试验,并对试验数据进行多项式回归分析,建立二次响应回归模型,拟合得到二次回归方程。
1.3 总酚与黄酮含量测定
1.3.1 总酚含量的测定
总酚含量的测定采用Folin-Ciocalteu法测定[9]。以没食子酸为标品,制作标准曲线得到吸光度与总酚质量浓度的方程为:y=0.004 35x+0.000 9(R2=0.998 9)。
取1 mL牛蒡提取液加入25 mL比色管中,依次加入福林-酚试剂0.2 mL,质量分数15%Na2CO3溶液2 mL,80%乙醇定容,室温下静置60 min,于765 nm下测定吸光度,测得的吸光度代入标准曲线,求得比色管中牛蒡总酚质量浓度,并计算牛蒡总酚得率。
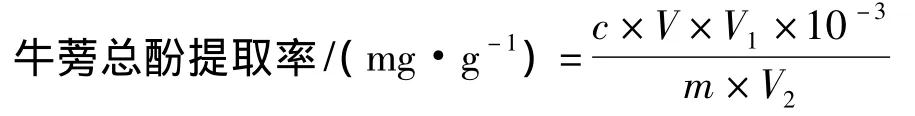
式中:c为比色管中牛蒡总酚浓度(μg/mL);V1为比色管量程(25 mL);V2为反应体系中牛蒡提取液体积(1 mL);V为总酚提取液总体积(mL);m为牛蒡粉质量(g)。
1.3.2 黄酮含量的测定
黄酮含量的测定采用 NaNO2-Al(NO3)3法测定[10]。以芦丁为标品,制作标准曲线得到吸光度与黄酮质量浓度的方程为:y=0.013 1x-0.000 1(R2=0.998 7)。
取1 mL牛蒡提取液加入25 mL比色管中,加入质量分数5%NaNO2溶液0.4 mL摇匀,静置6 min,再加入质量分数10%Al(NO3)3溶液0.4 mL摇匀,静置6 min,最后加入质量分数4%NaOH溶液4.0 mL,体积分数80%乙醇定容至刻度,室温静置15 min,测定509 nm处吸光值,并将其代入标准曲线,求得比色管中牛蒡黄酮质量浓度,计算牛蒡黄酮得率。
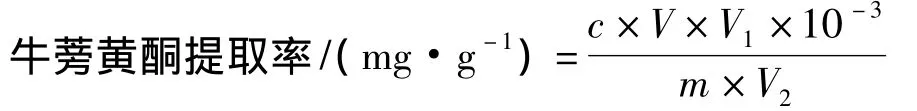
式中:c为比色管中牛蒡黄酮浓度(μg/mL);V1为比色管量程(25 mL);V2为反应体系中牛蒡提取液体积(1 mL);V为黄酮提取液总体积(mL);m为牛蒡粉质量(g)。
1.4 统计分析
所有试验重复测定3次,各项指标的数据均用Origin 8.5软件处理作图,利用Design-Expert 8.0.6软件中(ANOVA)进行方差分析,P<0.05认为有显著差异,P<0.01认为具有极显著差异。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度对牛蒡总酚及黄酮得率的影响
由图1可知,随着提取温度的增高,牛蒡总酚和黄酮得率均呈先增加后降低趋势,30~40℃内,总酚和黄酮得率均急速增加,当温度大于40℃时,总酚得率随温度的增加而降低,这是因为温度过高破坏了多酚成分所致[11];而黄酮得率在40~70℃内增加缓慢,当温度继续增高,黄酮得率降低。综上从成本和处理难易程度确定牛蒡多酚最适提取温度选40℃。
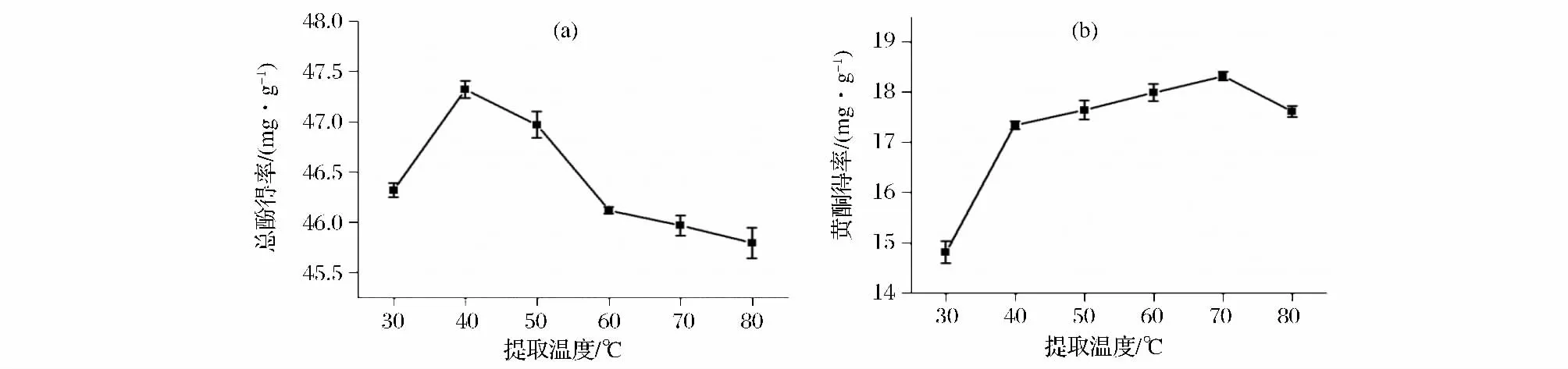
图1 提取温度对牛蒡总酚及黄酮得率的影响Fig.1 The effect of temperature on extraction rate of polyphenols in burdock
2.1.2 乙醇体积分数对牛蒡总酚及黄酮得率的影响
以不同体积分数的乙醇为提取溶剂,考察乙醇体积分数对牛蒡总酚及黄酮提取率的影响,结果如图2所示。随着乙醇体积分数的提高,牛蒡总酚和黄酮提取率均呈现先增加后急速降低趋势,乙醇体积分数60%时,总酚得率已趋于最高水平,而黄酮在80%时得率最高;相比之下,乙醇体积分数对黄酮得率影响更为显著。已有研究表明,植物体中的黄酮类化合物主要以苷类和苷元的形式存在,黄酮苷大多易溶于乙醇和水等溶剂,黄酮苷元一般难溶或不溶于水,易溶于乙醇,体积分数低的乙醇黄酮提取率也低的结果说明,牛蒡中黄酮苷元较黄酮苷类更为丰富[12],综合二者确定最适乙醇体积分数为70%。
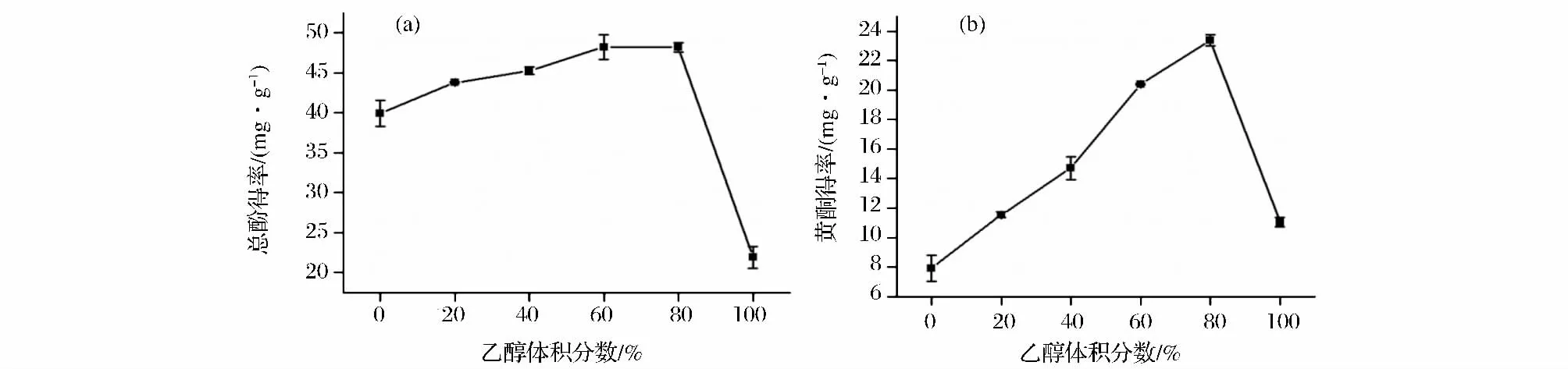
图2 乙醇体积分数对牛蒡总酚(a)及黄酮得率(b)的影响Fig.2 Effects of ethanol concentration on extraction rate of polyphenols in burdock
2.1.3 料液比对牛蒡总酚及黄酮得率的影响
如图3所示,总酚得率随着料液比的增加呈现先增加后降低的趋势,而黄酮得率先增加后趋于水平,这可能是因为溶剂与原料的比例越大,浓度差就越大,从而促进传质过程,但比例过大时,超声波产生的效应不再明显,导致多酚得率不再增加甚至降低[13]。二者在料液比1∶20(g∶mL)时均达到最大值,由此确定牛蒡多酚最适提取料液比应为1∶20(g∶mL)。
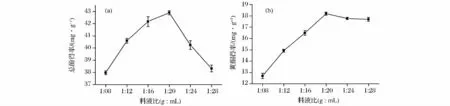
图3 料液比对牛蒡总酚(a)及黄酮得率(b)的影响Fig.3 Effects of liquid ratio on extraction rate of polyphenols in burdock
2.1.4 提取时间对牛蒡总酚及黄酮得率的影响
由图4可知,总酚和黄酮得率与提取时间的关系呈现先增大后减小趋势,且均在提取时间30 min时达到最大值,由此确定最适提取时间应为30 min。细胞破裂、多酚物质的溶出需要时间,随着提取时间的延长,多酚类物质能被充分提取,但时间过长,多酚物质可能被超声波巨大的机械能所破坏,从而使得得率下降[14]。
2.2 响应面法优化牛蒡多酚提取工艺结果分析
根据以上单因素实验结果,结合试验设备条件选取乙醇体积分数X1(%)、料液比X2(g∶mL)、超声温度X3(℃)为牛蒡多酚提取优化实验的3个因素,固定超声功率为200 W。实验因素与水平见表1。

表1 Box-Behnken设计实验因素水平表Table 1 Factors and levels of Box-Behnken design
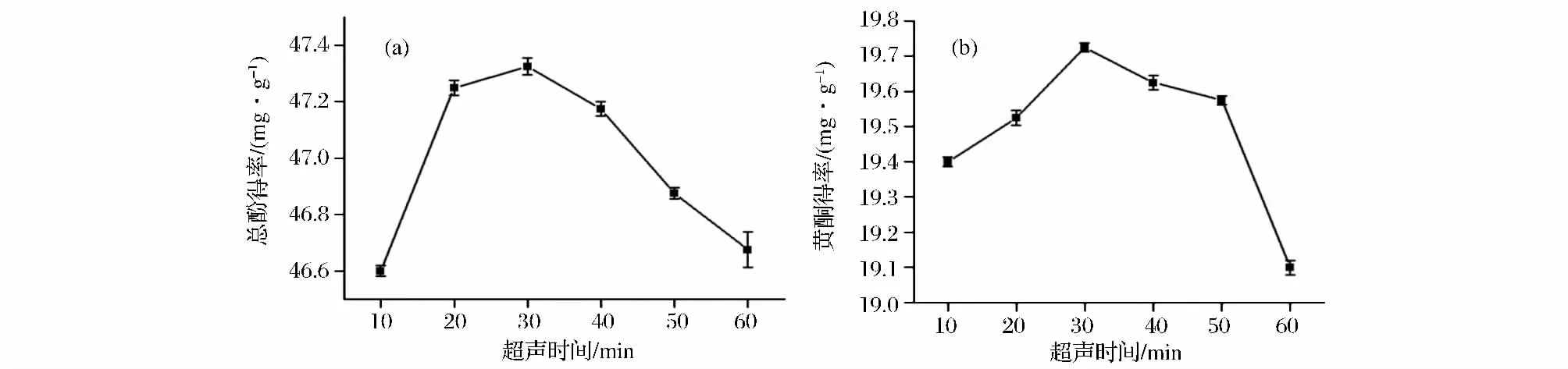
图4 超声时间对牛蒡总酚(a)及黄酮得率(b)的影响Fig.4 Effects of ultrasonic time on extraction rate of polyphenols in burdock
响应面分析方案与结果见表2。利用Design-Expert 8.0.6软件对表2实验数据进行线性拟合,获得超声波辅助提取牛蒡总酚得率(Y1)和黄酮得率(Y2)对乙醇体积分数(X1)、料液比(X2)、超声温度(X3)的二次回归模型方程分别为:
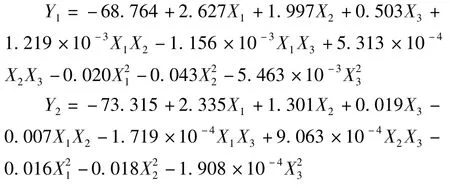
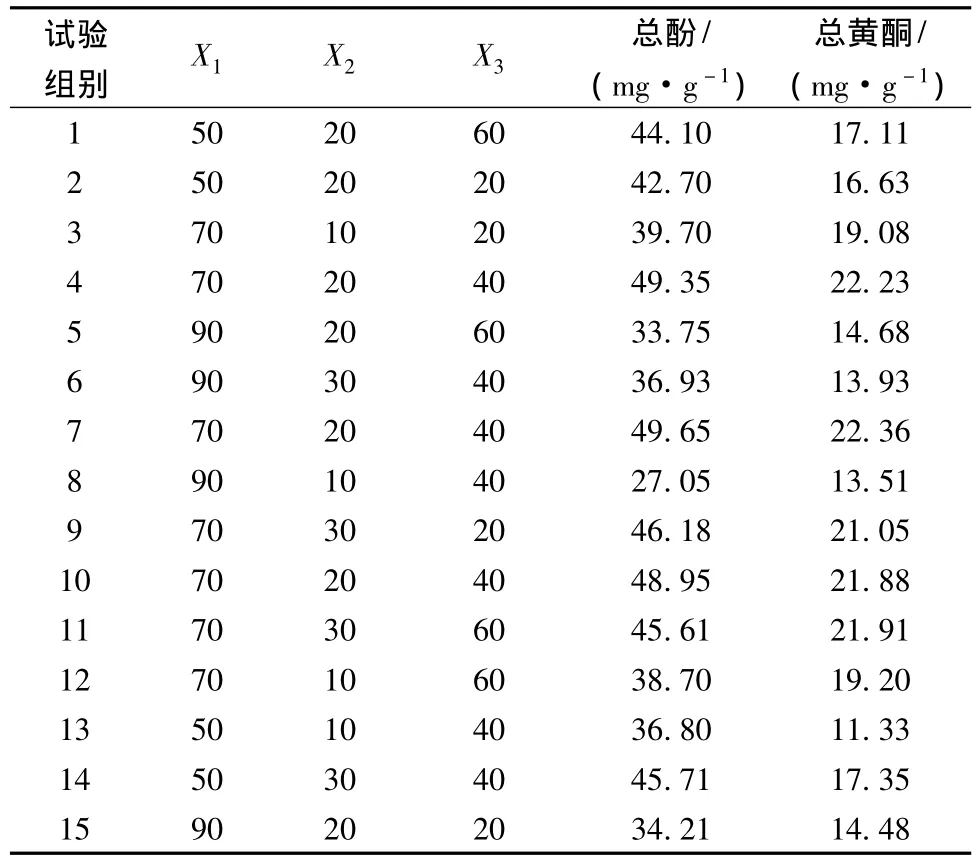
表2 Design-Expert实验设计方案及结果Table 2 Design-Expert design scheme and experimental results
对此模型进行回归分析,总酚和黄酮的分析结果如表3和表4所示。

表3 总酚方差分析Table 3 Analysis of variance(ANOVA)
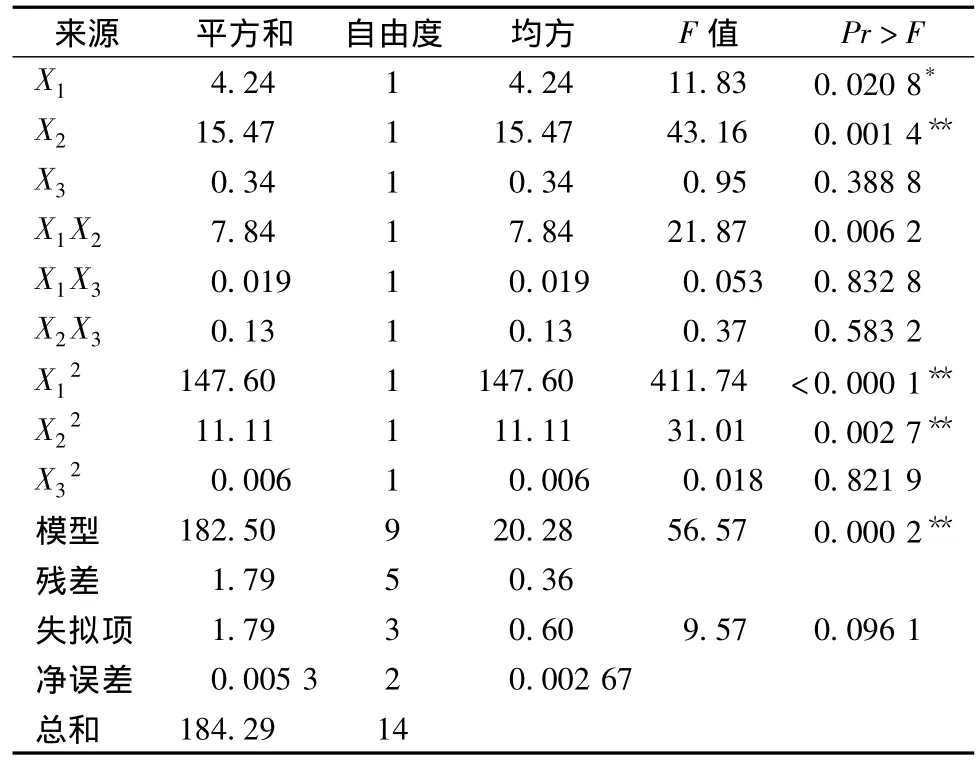
表4 黄酮方差分析Table 4 Analysis of variance(ANOVA)
由表3可得实验设计模型整体呈极显著水平(P<0.01),失拟不显著(P>0.05)。乙醇浓度、料液比和二次项对总酚得率的影响呈极显著水平,而超声温度对总酚得率影响不显著。回归方差分析结果表明,该模型相关系数为R2=0.992 3,模型校正相关系数,说明此模型可以解释97.83%响应值的变化。变异系数(CV%)为2.3%,较小,说明试验结果重复性较好。由于超声温度(X3)对总酚得率无显著影响,固定超声温度为40℃,可得到乙醇体积分数和料液比的变化对牛蒡总酚得率影响的响应面分析图(见图5)。等高线图同一曲线上总酚得率相同,图形中心多酚得率最高,等高线图沿某一因素轴方向曲线密度越大,说明总酚得率对该因素的变化越敏感,反映在响应面上则是曲面坡度越陡峭,等高线形状趋向椭圆且椭圆轴线与坐标轴的角度越大,则交互作用越明显[15]。如图5所示的响应面为开口向下的凸形曲面,有极高值,乙醇浓度和料液比方向的曲面坡度陡峭,说明总酚得率对这两个因素的变化敏感,与表3中参数估计相吻合。
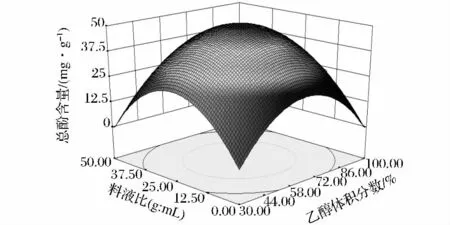
图5 乙醇体积分数(X1)料液比(X2)对总酚得率的影响Fig.5 The effect of ethanol concentration and solid liquid ratio on the extration rate of flavonoids
由表4可得实验设计模型整体呈极显著水平(P<0.01),失拟不显著(P>0.05)。乙醇浓度对黄酮得率影响显著,料液比对黄酮得率影响极显著,超声温度对黄酮得率影响不显著,乙醇体积分数与料液比的交互作用、乙醇体积分数的二次项及料液比的二次项均呈极显著水平。模型校正相关系数为,变异系数(CV%)为3.4%,实验结果重复性好。
乙醇体积分数与料液比的交互作用响应面和等高线分析图如图6所示。响应面为开口向下的凸形曲面,有极高值,在一定范围内,黄酮得率随乙醇体积分数与料液比的增加而增高,两者有显著交互作用。料液比较乙醇体积分数方向的曲面更陡峭,说明料液比对黄酮得率影响更显著,与方差分析表一致。

图6 乙醇浓度(X1)-料液比(X2)对黄酮得率的影响Fig.6 The effect of ethanol concentration-solid and liquid ratio on theflavonoid extration rate
2.3 验证实验
由软件分析得,最佳提取条件为乙醇体积分数60.86%、料液比1∶20.52、超声温度20℃,在此最优条件下总酚得率为47.29 mg/g,黄酮得率为20.94 mg/g。结合实际操作,确定提取条件为:超声功率200 W、乙醇体积分数61%、料液比1∶21、超声温度为室温,超声时间30 min,采取该工艺得到牛蒡总酚得率为47.12 mg/g,牛蒡黄酮得率为20.69 mg/g。与理论值相比相对误差分别为0.36%和1.19%,说明Design-Expert软件响应面实验设计对超声波辅助提取牛蒡多酚工艺参数进行的优化有效。
3 结论
在单因素试验结果的基础上,使用Design-Expert 8.0.6软件响应面实验设计优化超声波辅助提取牛蒡多酚的提取工艺,结合实际操作确定最佳试验条件为超声时间30 min、超声功率200 W、提取温度为室温、乙醇浓度为61%、料液比1∶21,总酚和黄酮预测得率分别为47.44 mg/g和20.92 mg/g,采用该工艺条件,牛蒡总酚得率为47.12 mg/g,牛蒡黄酮得率为20.69 mg/g。结果说明牛蒡根是总酚和黄酮提取的良好原料,具有较好的开发潜力。
[1] 曹泽虹,卢海燕,董玉玮,等.牛蒡菊糖酶法提取[J].食品科学,2010,31(24):37-45.
[2] WANG C H,CHUNG F Y,Tsai T R,et al.Development of great burdock essence compounds[J].Genomic Medicine,Biomarkers,and Health Sciences,2012,4(1):45-47.
[3] Mikami-Konishide I,Murakami S,Nakanishi K,et al.Antioxidant capacity and polyphenol content of extracts from crops cultivated in Japan,and the effect of cultivation environment[J].Food Science And Technology Research,2013,19(1):69-79.
[4] 娄在祥.牛蒡功能活性成分及其抗氧化、抗菌活性研究[D].无锡:江南大学,2010.
[5] KU M K,LIU H C,LIN S R.Efficacy analysis of preserved great burdock essence compounds[J].Genomic Medicine,Biomarkers,and Health Sciences,2013,5(2):67-70.
[6] LIU H C,KU M K,CHUNG F Y,et al.Effectiveness of great burdock essence compounds in the adjuvant treatment of gastric ulcer patients infected with Helicobacter pylori[J].Genomic Medicine,Biomarkers,and Health Sciences,2012,4(2):81-84.
[7] YANG B,ZHAO M,SHI J,et al.Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit percarp[J].Food Chemistry,2008,106(2):685-690.
[8] 马利华,秦卫东,陈学红,等.不同预处理对牛蒡多酚提取的影响及抗氧化性研究[J].农业机械,2011,3(8):119-122.
[9] 娄在祥,王洪新,吕文平,等.微波辅助提取牛蒡叶多酚及其抗氧化、抗菌活性研究[J].食品与发酵工业,2010,36(1):161-165.
[10] Gonzalez R,Ballester I,Lopez-Posadas R,et al.Effects of flavonoids and other polyphenols on inflammation[J].Critical Reviews In Food Science And Nutrition,2011,51(4):331-362.
[11] LIU S,Ogiwara Y,Fukuoka M,et al.Investigation and modeling of temperature changes in food heated in a flatbed microwave oven[J].Journal of Food Engineering,2014,131(1):142-153.
[12] 潘进权,周鲜娇,周培娴.响应面法优化牛蒡根总黄酮提取工艺[J].食品工业科技,2013,34(12):270-274.
[13] Eskilsson C S,Bjorklund E.Analytical-scale microwaveassisted extraction[J].Journal of Chromatography A,2000,902(1):227-250.
[14] 褚福红,陆宁,于新,等.响应面法优化微波提取野菊花抗氧化物质[J].食品科学,2010,31(24):90-94.
[15] Buckow R,Kastell A,Terefe N S,et al.Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J].Journal of Agriculture and Food Chemistry,2010,58(18):10 076-10 084.
