苦荞茶多糖的体外抗氧化活性及其分离纯化*
2014-12-25杨红燕严楠楠姜艳红杨兴斌
杨红燕,严楠楠,姜艳红,杨兴斌
(陕西师范大学食品工程与营养科学学院,陕西西安,710119)
苦荞(Fagopyrum tataricum(L.)Gaertn)是1种蓼科荞麦属双子叶植物,又名鞑靼荞麦(tartary buckwheat),为1年生或多年生宿根性植物[1]。因其喜高寒,多生长在高寒山区,在我国具有悠久的栽培历史,品种资源丰富,苦荞现分布在我国西南和华北等地山区。苦荞茶是将苦荞的种子苦荞米经过筛选、烘烤等工序加工而成的冲饮品。大量的研究资料表明,苦荞茶在抗氧化、抗衰老、抗癌、增强人体免疫力等方面都具有很好的生理功能[2-4],因此将其开发和推广具有很好的应用前景。目前,对于苦荞茶的研究大多集中在黄酮类物质和蛋白质上,对苦荞茶多糖的研究鲜见报道[1,5-7]。而天然的植物多糖具有重要的生物活性,能够增强机体的免疫机能,具有抗肿瘤、降血脂和血糖以及抗病毒等药理作用[8]。因此,苦荞茶多糖的研究有着重要的意义,它不仅能够阐明苦荞茶多糖的生理活性,而且为苦荞产品的进一步推广和应用提供重要的理论依据和指导。本研究采用四川凉山黑苦荞茶作为对象,利用水提醇沉方法获得TBTP,对其进行抗氧化研究,并对粗多糖进行分离纯化,用于进一步的生理活性研究。
1 试剂与仪器
1.1 实验试剂
黑苦荞茶,购至四川西昌市滋元食品有限公司;超纯水,实验室自制;HCl、NaOH、无水乙醇、乙醇体积分数(95%)、H2O2、抗坏血酸、FeSO4、Na2HPO4、NaH2PO4、FeCl3、[K3Fe(CN)6]、三氯乙酸(TCA)、水杨酸、三氯甲烷、氮蓝四唑(NBT)、还原型辅酶(NADH)和吩嗪甲硫酸盐(PMS)、1,1-二苯基-2-三硝基苯肼(DPPH)、NaCl,均购自天津市天力化学试剂有限公司,为分析纯。
1.2 实验仪器
200 g多功能粉碎机,西安金振机械设备有限公司;标准检验筛(60目),浙江上虞市道墟张兴纱筛厂;药物电子天平SL202N型,上海明桥精密科学仪器有限公司;HH-6B数显恒温水浴锅,杭州大卫科教仪器有限公司;LD4-2低速离心机,长沙湘仪离心机仪器有限公司;SHBⅢ循环水多用真空泵,上海比朗仪器有限公司;RE-2000A旋转蒸发器,杭州大卫科教仪器有限公司;透析袋,华美生物工程公司;超纯水仪,MILLI-Q MILLIPORE公司;冷冻干燥设备,EZDRY杭州大卫科教仪器有限公司;微量移液枪,大龙公司;3 cm×50 cm层析柱,上海华美实验仪器厂;BSZ-100自动部分收集器,上海泸西分析仪器厂有限公司;全波长酶标仪,美国热电公司;KQ-300DE型数控超声波清洗器,宁波新芝生物科技股份有限公司。
2 实验方法
2.1 TBTP的提取及测定
2.1.1 TBTP 提取工艺流程[9]
苦荞茶→粉碎→脱脂→热水提取→离心收集上清液→浓缩水提液→醇沉→除蛋白→透析→冷冻干燥→TBTP
2.1.2 TBTP多糖含量的测定
TBTP测定采用改进的苯酚-硫酸法[10]。精确称取干燥至质量恒定的葡糖糖标准品10 mg,用蒸馏水定容至100 mL容量瓶,摇匀,稀释配制质量浓度分别为0.01、0.02、0.03、0.04、0.05 mg/mL 的标准溶液,各取1 mL并加入5%苯酚溶液1 mL,再加5 mL浓H2SO4,混合均匀后,室温放置30 min,在490 nm波长处测定吸光度,以蒸馏水按照同样显色操作为空白,绘制标准曲线。
2.2 TBTP体外抗氧化活性的测定
2.2.1 对DPPH·清除能力测定
本实验参照何念武等[11]报道的方法稍作修改,评价TBTP对DPPH·的清除能力。将3 mL DPPH(1 mmol/L)甲醇溶液与1 mL不同浓度的样品溶液分别加入试管中,充分混合,黑暗处理30 min,在517 nm处测定吸光值。VC作阳性对照,用蒸馏水代替多糖溶液作阴性对照,用甲醇代替DPPH做本底组对照。清除率按以下方法计算:
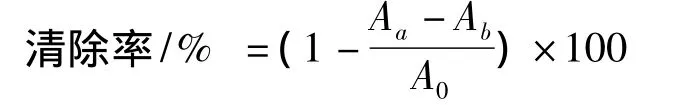
其中:Aa为样品吸光值,Ab为样品本底吸光值,A0为阴性对照值。
2.2.2 ·OH的清除能力测定
利用Fenton体系法测定多糖对·OH的清除能力[12-14]。Fenton 反应中 FeSO4与 H2O2反应产生·OH。·OH具有较高的反应活性,存活时间短。水杨酸能够有效捕捉·OH并产生有色物质,该物质在510 nm处有强吸收峰。在反应体系中加入具有能清除·OH的物质,可以减少有色物质的生成。故可以通过在510 nm处测定吸光值的变化来测定该物质的清除·OH的能力,从而判断其抗氧化能力。往10 mL离心管中依次加入1 mL多糖溶液,1 mL FeSO4(6 mmol/L)溶液,1 mL水杨酸-乙醇(6 mmol/L)溶液和1 mL H2O2(6 mmol/L)溶液,于37℃水浴1 h,然后在510 nm处测定吸光值。用蒸馏水代替多糖溶液作阴性对照,用蒸馏水代替H2O2溶液作本底对照。清除率的计算:
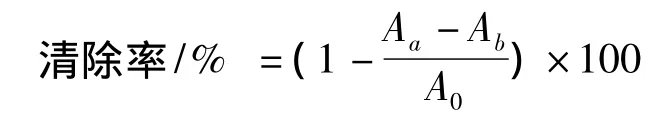
其中:Aa为样品吸光值,Ab为样品本底吸光值,A0为阴性对照值。
2.2.3 O2-·的清除能力测定
本实验参照 Tian 等[15]、吕喜茹等[16]报道的方法进行,测定苦荞多糖对O2-·的清除能力。在NADHPMS-NBT体系中,NADH与 NBT反应产生O2-·,O2-·与PMS结合生成的化合物显色并在560 nm处具有最大吸光值。抗氧化能力越强,对O2-·的清除能力就越强,吸光值就越小。往试管中依次加入1 mL NBT(0.078 mol/L)溶液,1 mL NADH(0.468 mol/L)溶液,1 mL不同浓度的多糖溶液,0.4 mL PMS(0.06 mol/L)溶液,充分混匀,静置5 min,在560nm处测其吸光值。用蒸馏水代替多糖溶液作阴性对照,蒸馏水代替PMS作本底组对照,VC作阳性对照。清除率计算:
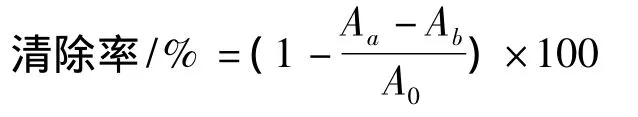
其中:Aa为样品吸光值,Ab为样品本底吸光值,A0为阴性对照值。
2.2.4 TBTP总还原能力的测定
参照Kirigaya Norimasa[17]提供的方法对TBTP的总还原能力做评价。取1 mL多糖溶液,加入2.5 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6),2.5 mL K3Fe(CN)6溶液(1%),充分混合,50℃水浴 20 min,然后加入2.5 mL的 TCA(0.1 mg/mL)混匀,3 000 r/min离心10 min,取上清液2 mL,放入另一支试管中,依次加入2 mL蒸馏水和0.5 mL FeCl3(0.1%),混匀,室温静置10 min,然后于700 nm处测定吸光值。VC作阳性对照,用蒸馏水代替0.1%FeCl3溶液作本底对照。
2.3 TBTP的分离纯化
2.3.1 DEAE-52纤维素预处理
DEAE-52纤维素为亲水弱碱性阴离子交换剂。称取DEAE-52纤维素树脂100 g预处理,在25℃蒸馏水中浸泡24 h,使其充分溶胀。再用双蒸水反复洗涤,去除纤维素单体或碎片的悬浮颗粒,抽干,用0.5 mol/L NaOH溶液500 mL浸泡30 min,适当搅拌后,用双蒸水洗至中性;再用0.5 mol/L HCl溶液500 mL浸泡30 min,适当搅拌后,用双蒸水洗至中性;最后用0.5 mol/L NaOH溶液500 mL浸泡30 min,适当搅拌后,用双蒸水洗至中性。抽干,备用。
装柱与平衡:将预处理好的DEAE-52纤维素树脂加适量双蒸水,搅拌,用超声脱气2 h后,沿玻璃棒小心缓慢1次灌到3 cm×50 cm层析柱,同时轻轻敲击柱壁,使填料沉降均匀、致密,柱高40 cm,静态沉降24 h,使层析柱达到平衡状态,用于粗多糖的分离纯化[18]。
2.3.2 TBTP DEAE-52纤维素层析柱纯化
称取TBTP 0.3 g,溶解于10 mL双蒸水,离心,上清液经0.45 μm微孔滤膜过滤后上样,用NaCl溶液进行梯度预洗脱,带刻度的试管收集,每管收集6 mL,收集液隔管用苯酚-硫酸法跟踪检测,在484 nm的波长下测定吸光度。以管号为横坐标,各管吸光值为纵坐标,绘制洗脱曲线,选择其中洗脱效果明显的NaCl浓度,在该浓度条件下重复洗脱,保留尖峰管,分别合并其他各洗脱浓度下的洗脱液,减压浓缩,透析72 h,冷冻干燥得到粗多糖的初级分离组分[19]。
2.3.3 TBTP G-150葡聚糖凝胶层析柱纯化
葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。称取G-150葡聚糖凝胶25 g,1 000 mL去离子水浸泡2d,使其充分溶胀,倾去上层液,并反复洗涤,除去悬浮物及其他杂质。用抽滤瓶抽气的方法排气1 h,以排空凝胶中的空气。将收集到的DEAE-52柱层析中的峰面积较大的组分用G-150葡聚糖凝胶柱层析进一步纯化。上样量为30 mg,上样体积为5 ml,流速为0.5 mL/min,以去离子水为洗脱剂洗脱,分布收集器进行分部收集,6 ml每管,苯酚-硫酸定糖法测定多糖含量。以试管号为横坐标,吸光值为纵坐标,绘制洗脱曲线。保留尖峰管,合并洗脱峰的洗脱液,减压蒸馏,冷冻干燥。
3 结果与分析
3.1 TBTP含量测定
以葡萄糖标准浓度为横坐标,其对应吸光值为纵坐标作葡萄糖标准曲线,建立回归方程。得到其标准曲线如图1所示。
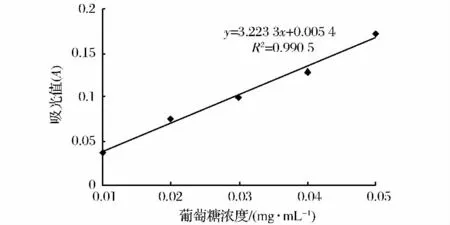
图1 多糖含量标准曲线图Fig.1 The standard curve of polysaccharide content
由图1和表1可知,当粗多糖浓度0.08 mg/mL时的吸光度为0.142,代入葡萄糖标准曲线中计算得多糖含量为58.75%。
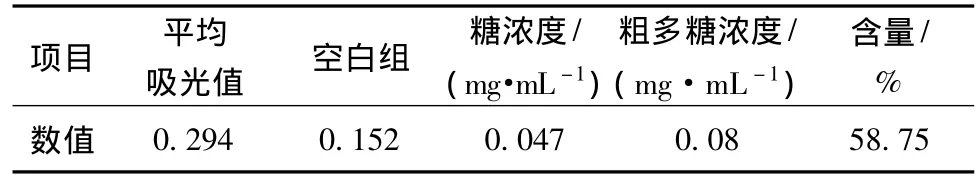
表1 样品多糖含量测定Table 1 Determination of samples polysaccharide content
3.2 对DPPH·清除能力
由图2可知,TBTP有明显的清除DPPH·的能力,且表现出良好的剂量效应关系,随着浓度的增加,清除率越高。在浓度为8 mg/mL时,TBTP对DPPH·的清除能力达到94.16%,与VC的清除能力相当,且无显著性差异。同时,当多糖的浓度为3 mg/mL时,板栗多糖的清除率不到40%[20],而TBTP的清除率已高达60%。由此可见,作为食源物质,TBTP具有明显的清除DPPH·的能力。
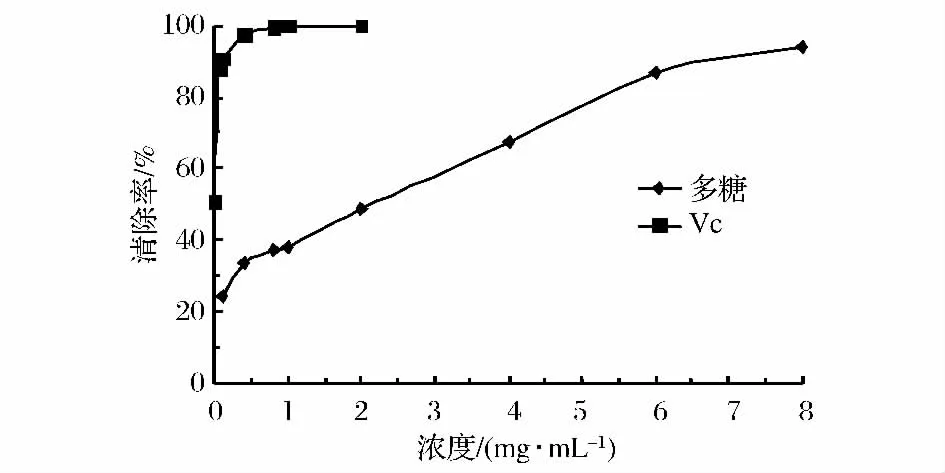
图2 TBTP对DPPH·的清除率Fig.2 DPPH radical-scavenging activity of TBTP
3.3 对·OH的清除能力

图3 TBTP对·OH的清除率Fig.3 Hydroxyl radical-scavenging activity of TBTP
由图3可知,TBTP清除·OH的能力随着浓度的增大而增强,表现出良好的剂量效应关系,在相同浓度下TBTP对·OH的清除率低于VC,但在10 mg/mL时,清除率为83.22%,而在此多糖浓度时,黄瓜多糖的清除率为 55%[11],比 TBTP的清除率低28.22%,表明苦荞茶与其他食源性物质相比,其多糖对·OH很好的清除能力。
3.4 对O2-·的清除能力
由图4可知,TBTP能高效的清除O2-·,清除能力随着浓度的增大而增强,尽管在相同浓度下TBTP对O2-·的清除率低于VC,但在高浓度时其清除能力接近于VC。在4 mg/mL时,TBTP对O2-·的清除率达到98.05%,是黄瓜多糖3倍[11],且与VC无显著性差异,表明TBTP对O2-·有很好的清除能力。
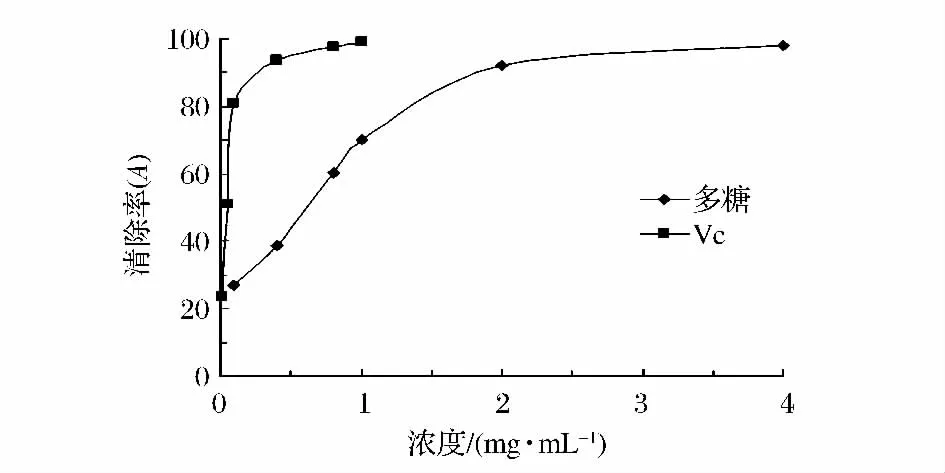
图4 TBTP对O2-·的清除率Fig.4 Superoxide radical-scavenging activity of TBTP
3.5 TBTP的总还原能力
由图5可知,在实验浓度范围内,TBTP还原力测试混合液的吸光值随着浓度的增大而增大,当浓度为20 mg/mL时,TBTP溶液的吸光值达到0.61,虽与VC具有一定的差距,但可以说明TBTP有一定的总还原能力。

图5 TBTP的总还原能力Fig.5 Iron(III)to iron(II)reducing power of TBTP
3.6 TBTP的DEAE-52纯化结果
综合考察以上TBTP体外抗氧化指标可知,作为食源性物质,TBTP的抗氧化活性相对偏高,具有广阔的潜在利用价值,故将对其进一步的分离纯化,明确其组成,为苦荞的进一步推广和应用提供重要的理论依据和指导。如图6所示为TBTP经DEAE-52柱层析的结果。洗脱液分别采用 0、0.05、0.1、0.15、0.2、0.3、0.5 mol/L NaCl溶液梯度洗脱,得到3个单一峰。0、0.1、0.2、0.5 mol/LNaCl溶液洗脱得到的组分极少,几乎没有洗脱峰。其中0.05、0.15、0.3 mol/LNaCl浓度溶液洗脱峰面积最大,为主要洗脱峰。所以仅对0.05、0.15和0.3 mol/LNaCl洗脱液洗脱所得组分进一步纯化,做深入研究。收集0.05、0.15、0.3 mol/LNaCl洗脱液洗脱部位,减压蒸馏,透析(分子截留量10 000 Da)3d,每天换水4次,冷冻干燥,得组分 TBTP-1、TBTP-2、TBTP-3。
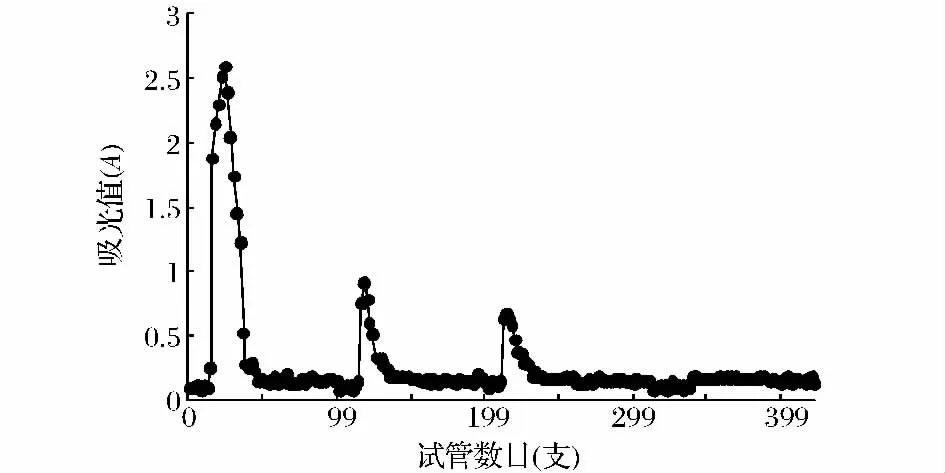
图6 TBTP的DEAE-52柱层析图Fig.6 Eluting curve of TBTP on DEAE-52 column
3.7 TBTP的G-150葡聚糖凝胶纯化结果
对TBTP DEAE-52柱层析纯化得到较多的组分(TBTP-1、TBTP-2、TBTP-3)进行 G-150葡聚糖凝胶层析柱纯化,结果如图7~图9所示。
由图7~图9可知,DEAE-52柱层析纯化后的G-150葡聚糖凝胶柱层析得到的都为均一的峰,说明0.05、0.15和0.3 mol/LNaCl洗脱 DEAE-52纤维素柱层析得到组分为均一多糖,并分别命名为TBTP-1、TBTP-2和 TBTP-3。
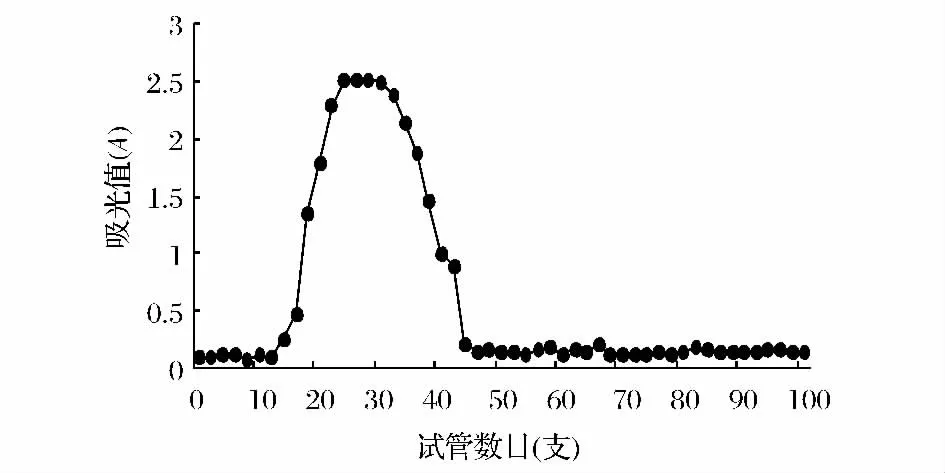
图7 0.05 mol/LNaCl洗脱组份G-150葡聚糖凝胶柱层析图Fig.7 Elution curve of 0.05 mol/L NaCl eluting component on Sephadex G-150 column
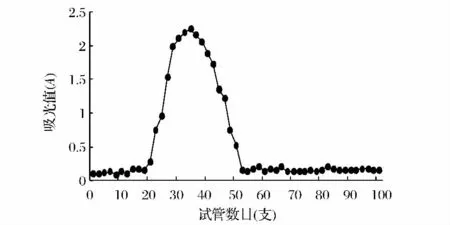
图8 0.15 mol/LNaCl洗脱组份G-150葡聚糖凝胶柱层析图Fig.8 Elution curve of 0.15 mol/L NaCl eluting component on Sephadex G-150 column

图9 0.3 mol/LNaCl洗脱组份G-150葡聚糖凝胶柱层析图Fig.9 Elution curve of 0.3 mol/L NaCl eluting component on Sephadex G-150 column
4 结论
(1)水提醇沉法获得TBTP,通过苯酚-硫酸法测定苦荞多糖含量,做标准曲线,得其多糖含量为58.75%。
(2)TBTP对 DPPH·、·OH、O2-·有较好的清除能力,TBTP总还原能力一般。但是随着多糖溶液浓度的增加,3种自由基的清除能力和还原能力都相应增加。在质量浓度为8.0 mg/mL时,对DPPH·的清除率为94.16%,对·OH的清除率为82.25%;在质量浓度为4.0 mg/mL时,对 O2-·的清除率为98.05%。
(3)用纤维素和葡聚糖凝胶分离纯化,得到3个均一多糖分离组分,分别为TBTP-1、TBTP-2、TBTP-3。
[1] 郭刚军,何美莹,邹建云,等.苦荞黄酮的提取分离及抗氧化活性研究[J].食品科学,2008,29(12):373-376.
[2] 李海萍,王敏,柴岩,等.凉山地区苦荞酚类物质的提取及抗氧化能力研究[J].安徽农业科学,2010,38(10):5097-5100.
[3] GUO Xiao-na,YAO Hui-yuan.Fractionation and characterization of tartary buckwheat flour proteins[J].Food Chemistry,2006,98(1):90-94.
[4] 郎桂常.苦荞麦的营养价值及其开发应用[J].中国粮油学报,1996,11(3):9-14.
[5] 李丹,丁霄霖.苦荞黄酮抗氧化作用的研究[J].食品科学,2001,22(4):22-24.
[6] 李谣,周海媚,黄丹丹,等.苦荞抗氧化活性研究[J].中国酿造,2013,32(6):24-27.
[7] 曹艳萍.苦荞叶提取物抗氧化性及其协同效应的研究[J].西北农林科技大学学报,2005,33(8):144-148.
[8] 汪志好.植物多糖的研究进展[J].安徽卫生职业技术学院学报,2007,6(2):86-87
[9] 刘航,国旭丹,马雨洁,等.超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J].食品科学,2013,34(14):45-50.
[10] 杨梅,王丽雅,庄跃飞,等.杏鲍菇多糖的提取及分离的研究[J].中国食用菌,2006,24(4):38-39.
[11] 何念武,杨兴斌,田灵敏,等.黄瓜多糖的体外抗氧化活性[J].食品科学,2011,32(19):70-74.
[12] TIAN Ling-min,ZHAO Yan,GUO Chao,et al.A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata [J].Carbohydrate Polymers,2011,83:537-544.
[13] 吕喜茹,郭亮,常明昌,等.姬松茸多糖抗氧化作用[J].食用菌学报,2010,17(1):69-71.
[14] SONG Hou-fang,ZHANG Quan-bin,ZHANG Zhongshan,et al.In vitro antioxidant activity of polysaccharides extracted from Bryopsis plumosa[J].Carbohydrate Polymers,2010,80(4):1 057-1 061.
[15] WANG C C,CHANG S C,StephenInbaraj,et al.Isolation of carotenoids,flavonoids and polysaccharides from Lycium barbarum L.and evaluation of antioxidant activity[J].Food Chemistry,2010,120(1):184-192.
[16] 陈留勇,盂宪军.黄桃水溶性多糖的抗肿瘤作用及清除自由基、提高免疫活性研究[J].食品科学,2004,25(1):167-170.
[17] Kirigaya N,Kato H,Fujimaki M.Studies on antioxidant activity of nonenzymic browning reaction products[J].Agricultural and Biological Chemistry,1968,32(3):287-290.
[18] WU Xian-yang,MAO Guang-hua,ZHAO Ting,et al.I-solation,purification and in vitro anti-tumor activity of polysaccharide from Ginkgo biloba sarcotesta[J].Carbohydrate Polymers 2011,86(2):1 073-1 076.
[19] Dubois,Michel,Gilles,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3),350-356.
[20] 李润丰,刁华娟,彭友舜,等.板栗多糖的提取及抗氧化活性研究[J].食品研究与开发,2011,32(8):21-25.
