核桃油微量组分对其氧化稳定性的影响*
2014-12-25朱振宝刘梦颖易建华
朱振宝,刘梦颖,易建华
1(陕西科技大学生命科学与工程学院,陕西西安710021)
2(陕西省食品加工工程技术研究中心,陕西西安710021)
植物油的氧化稳定性是衡量植物油质量的重要指标。植物油氧化酸败会产生大量自由基、氢过氧化物以及醛、酮等物质,从而破坏油脂营养价值,影响其感官品质及货架期。长期摄入劣变的油脂会导致身体机能衰退、影响肌肉活力、甚至具有潜在的致癌性[1]。研究表明,植物油的氧化稳定性不仅受温度、光照、氧气含量等多种贮存环境因素影响,而且油脂自身的脂肪酸组成、微量成分含量等也与其氧化稳定性密切相关。
植物油含有多种不同种类的微量组分,在植物油氧化初级阶段,会生成以共轭双烯和共轭三烯为主的共轭烯烃类物质,因此,共轭烯烃值可以用来表示油脂初级氧化程度,是初级氧化产物的指标[2]。氢过氧化物是油脂氧化过程的中间产物,且多数情况下不稳定,会继续分解为次级氧化产物,如醛、酮等羰基化合物,因此,羰基值可以表示油脂次级氧化程度,也是油脂氧化变化的良好指标[3]。除共轭烯烃和羰基化合物以外,植物油中还有许多其他微量组分,它们不但具有营养价值,还有一定的抗氧化作用。Jierong等人[4]的研究表明,棕榈油中的类胡萝卜素具有抗氧化作用,且和生育酚之间存在良好的抗氧化协同作用。多酚化合物及生育酚也已被证明是天然存在于油脂中的微量成分并具有良好的抗氧化效果[5-6]。Jiyeun等人[7]还发现,菜籽油中的磷脂可以抑制单线态氧引起的α-生育酚的降解,从而提高油脂本身的抗氧化性。此外,Jana等[8]的研究表明,油脂中黄酮类物质能抑制油脂与氧的反应从而也能起到抗氧化的作用。
由于核桃油脂不饱和脂肪酸含量很高,而且亚油酸、亚麻酸等多不饱和脂肪酸是核桃油中的主要成分,因此非常容易氧化,已成为影响其营养品质和货架期的重要问题。尽管现有研究发现生育酚、多酚、黄酮、胡萝卜素等物质具有良好的抗氧化活性,但在核桃油中这些抗氧化活性物质的含量以及它们对核桃油氧化稳定性的影响尚缺乏深入、系统地研究。此外,关于核桃油体外抗氧化能力与其氧化稳定性之间的相关性也未见报道。因此,本文以核桃油为试材,通过测定核桃油清除DPPH·和ABTS+·的能力,结合β-胡萝卜素脱色法评价核桃油体外抗氧化能力;并通过分析核桃油中微量组分含量与氧化稳定指数(OSI)的相关性来研究核桃油中微量组分含量对其氧化稳定性的影响。核桃油中的微量组分尽管含量很低,但在其氧化过程中具有重要作用,本研究不仅可以为揭示核桃油氧化稳定性的机理提供理论参考,同时能够为提高核桃油的营养品质和延长货架期提供技术指导。
1 材料与方法
1.1 原料与试剂
核桃仁,购于西安本地市场。
1,1-二苯基苦基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、β-胡萝卜素、亚油酸、芦丁、α-生育酚、Folin-Phenol等试剂均购于Sigma公司;其余试剂若无特别说明均为分析纯。
1.2 设备仪器
743型 Rancimat油脂氧化测定仪,瑞士万通Metrohm公司;759S型紫外分光光度计,上海荆和分析仪器有限公司;101-2型电热鼓风干燥箱,北京科伟永兴仪器有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂。
1.3 实验方法
1.3.1 油脂提取
核桃油脂的提取均采用溶剂浸提法,其工艺流程为:
核桃仁→去皮→烘干→粉碎→石油醚浸提→抽滤→蒸发脱溶→核桃毛油
1.3.2 DPPH·清除能力的测定[2]
准确称取20 mg DPPH·,用无水乙醇溶解并定容至250 mL容量瓶中,得浓度为2×10-4mol/L的DPPH·溶液。取不同稀释度油样与DPPH·溶液加入同一具塞试管中,摇匀,反应30 min后,用无水乙醇作参比,不加油样的溶液作对照,测定515 nm处溶液的吸光度,根据公式计算清除率。
清除率/%=[1-Ai/Ac]×100
式中:Ai,油样与DPPH·溶液混合后的吸光度;Ac,对照溶液的吸光度。
1.3.3 ABTS+·清除能力的测定
ABTS+·清除能力测定参照Re等[9]的方法,略作修改。
将ABTS加入到无水乙醇中,利用超声波辅助溶解,使ABTS浓度为7 mmol/L,加入过硫酸钾,使过硫酸钾的浓度为2.45 mmol/L,避光反应12 h。将生成的ABTS﹢·溶液用无水乙醇稀释,得到ABTS﹢·工作液[该工作液在734 nm波长下的吸光度为需为(0.70±0.02)]。取不同稀释度油样与ABTS﹢·工作液于具塞试管中混合均匀,反应60 min后,在405 nm下测其吸光值,以无水乙醇作参比,不加油样的溶液作对照,不加ABTS的溶液作空白。根据公式计算清除率。
清除率/% =[1-(As-Ac)/Amax]×100
式中:As,油样与ABTS工作液混合后的吸光度;Ac,空白溶液的吸光度;Amax,对照溶液的吸光度。
1.3.4 β-胡萝卜素脱色法测定抗氧化活性
依照黄海兰等[10]的方法,略作修改。
将5 mg β-胡萝卜素溶于10 mL三氯甲烷中,混合均匀后40℃旋转蒸发除去三氯甲烷,再加入120 mg亚油酸、1.2 g吐温40以及300 mL丙酮,混合均匀,得到工作液。于具塞试管中加入不同稀释度的油样以及4.4 mL工作液,以丙酮做参比,在470 nm下测定其吸光度。之后置于50℃水浴中反应3 h后,依旧于470 nm下测定其吸光度。以不加油样的溶液作对照,不加β-胡萝卜素的溶液作空白。根据公式计算抗氧化活性。
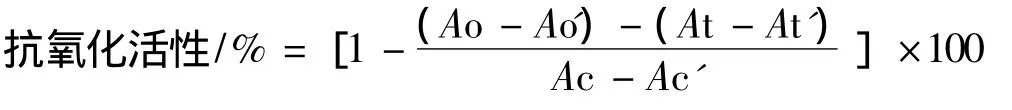
式中:Ao,起始时油样与工作液混合后的吸光度;Ao',3 h后油样与工作液混合后的吸光度;At,起始时空白溶液的吸光度;At,3 h后空白溶液的吸光度;Ac,起始时对照溶液的吸光度;Ac',3 h后对照溶液的吸光度。
1.3.5 OSI测定
取3 g油样,在温度120℃、空气流量15 L/h条件下,利用743型Rancimat油脂氧化测定仪自动评估核桃油脂的OSI。
1.3.6 共轭烯烃含量测定
依照GB/T 22500-2008进行。
1.3.7 羰基化合物含量测定
依照GB/T 5009.37-2003进行。
1.3.8 磷脂含量测定
依照GB/T 5537-2008进行。
1.3.9 生育酚含量测定
精确称取200 mg油样于10 mL容量瓶中,加入5 mL三氯甲烷,混合均匀后加入3.5 mL 2,2'-联吡啶(0.7 mg/mL,体积分数95%乙醇)及0.5 mL FeCl3(2 mg/mL,体积分数95%乙醇),用体积分数95%乙醇定容至10 mL,静置1 min后,以不加油样的试剂做空白,在520 nm处测定吸光值。分别取10 g/L的α-生育酚标准品溶液 10、15、20、25、30、35 μL,按上述方法测定,绘制标准曲线。
1.3.10 总酚含量测定
总酚提取:取一定量的核桃毛油,用甲醇等体积萃取3次,合并萃取液,40℃真空浓缩至近干,用相应溶剂5 mL分别多次洗出于10 mL离心管中,10 000 r/min离心10 min,冷冻脱脂后吸取上层醇相进行测定。
总酚含量测定:取一定体积待测液,加入0.5 mL福林酚试剂,静置3 min后加入10%Na2CO3溶液1 mL,蒸馏水定容至25 mL,35℃下反应120 min,于725 nm下测定吸光值。分别取1 mg/mL的没食子酸标准液2.5、5.0、7.5、10.0、15.0、20.0 mL,按上述方法测定,绘制标准曲线。
1.3.11 β-胡萝卜素含量测定
取油样0.5 g于25mL容量瓶中,用石油醚定容,于450 nm下测定吸光度。分别取10 μg/mL β-胡萝卜素标准液 1.0、2.0、3.0、4.0、5.0、6.0 于 25 mL 容量瓶中,按上述方法测定,绘制标准曲线。
1.3.12 黄酮含量测定
精确吸取7 mL核桃油于50 mL容量瓶中,用无水乙醇稀释定容,吸取该溶液1.0 mL于25 mL容量瓶中,加入5%NaNO2溶液1 mL,摇匀,静置6 mim;再加入10%Al(NO3)3溶液1 mL,摇匀,静置6 min;最后加入4%NaOH溶液10 mL,用无水乙醇稀释至刻度,摇匀,静置15 min后以不加油样的溶液做空白,于360 nm下测定吸光值。分别取0.2 mg/mL的芦丁标准液 0.5、1.0、1.5、2.0、2.5、3.0 mL,按上述方法测定,绘制标准曲线。
2 结果与分析
2.1 核桃油体外抗氧化活性
通过测定核桃油对DPPH·、ABTS+·的清除能力,并结合β-胡萝卜素脱色法评价核桃油的体外抗氧化能力,结果如表1所示。利用SPSS软件分析核桃油体外抗氧化能力与其OSI相关性,结果如表2所示。

表1 核桃油体外抗氧化能力Table 1Antioxidant activities of walnut oil
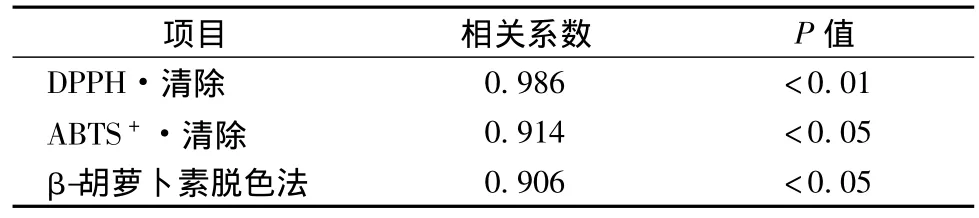
表2 核桃油体外抗氧化能力与OSI相关性Table 2 Relation between antioxidant activities and OSI of walnut oil
由表1可知,核桃油对DPPH·和ABTS+·具有不同程度的清除能力,半抑制浓度分别为为0.161 g/mL和0.841 g/mL,通过β-胡萝卜素脱色法得到核桃油体外抗氧化活性的IC50为1.292 g/mL。由表2可知,3种方法测得的核桃油抗氧化能力与其OSI均有良好的相关性,其中核桃油DPPH·清除能力与OSI呈极显著相关(P<0.01),ABTS+·清除能力以及利用β-胡萝卜素脱色法测得的抗氧化活性与OSI呈显著相关(P<0.05)。可见,核桃油本身具有一定程度的抗氧化能力,且这种抗氧化能力与其氧化稳定性相关。
2.2 核桃油微量组分与氧化稳定性关系
2.2.1 微量组分标准曲线
总酚、生育酚、黄酮及β-胡萝卜素含量标准曲线如图1~图4所示。
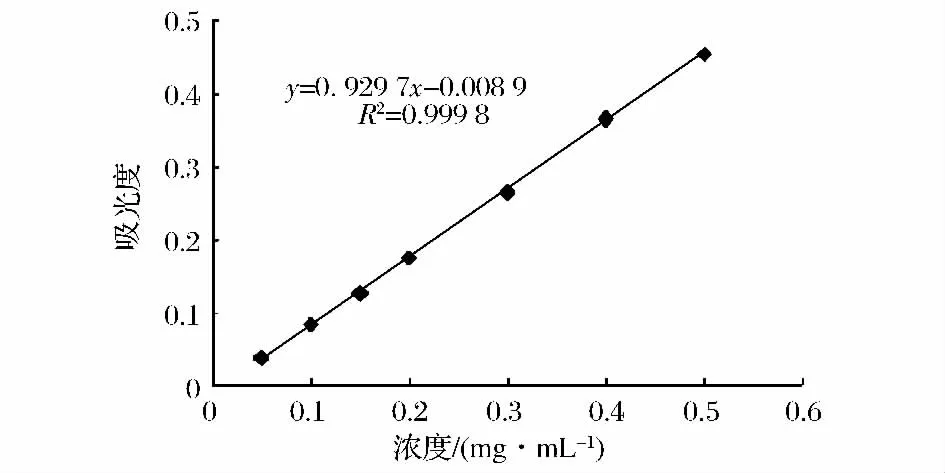
图1 总酚含量标准曲线Fig.1 The standard curve of total phenolics
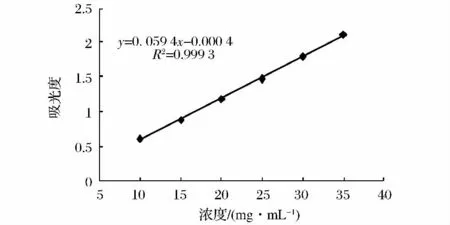
图2 生育酚含量标准曲线Fig.2 The standard curve of total tocopherols
2.2.2 微量组分含量与OSI相关性
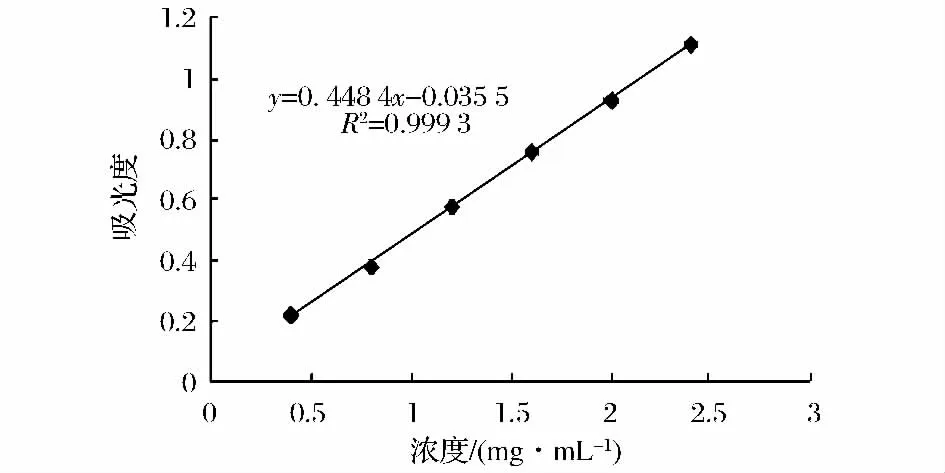
图3 黄酮含量标准曲线Fig.3 The standard curve of flavonoids
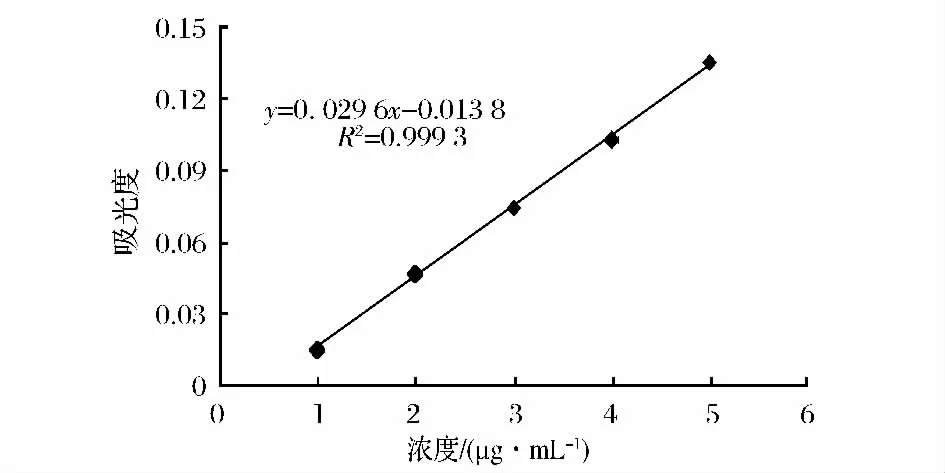
图4 β-胡萝卜素含量标准曲线Fig.4 The standard curve ofβ-carotene
测定核桃油中共轭烯烃、羰基化合物、总酚、生育酚、黄酮、β-胡萝卜素及磷脂含量,并利用SPSS软件分析7种微量组分含量与OSI相关性,结果如表3所示。
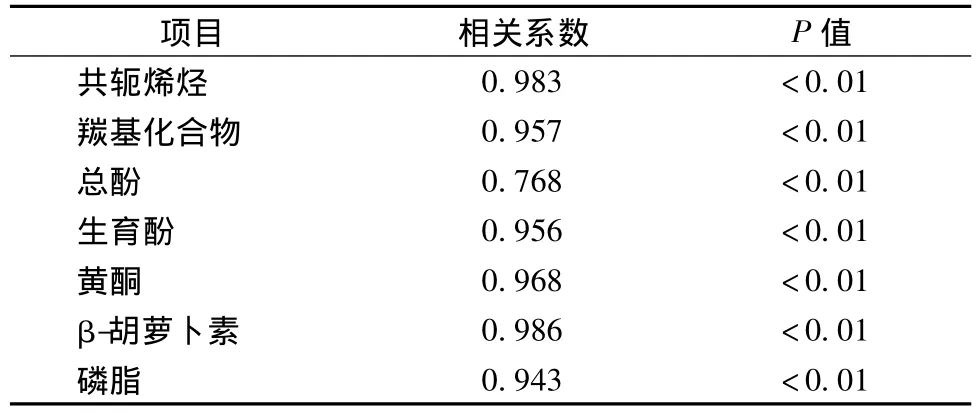
表3 核桃油微量组分与OSI相关性Table 3 Relation between micro component content and OSI of walnut oil
由表3可知,核桃油中7种微量组分含量与OSI均有良好的相关性(P<0.01),其中共轭烯烃和羰基化合物含量与OSI呈极显著负相关,这是由于共轭烯烃和羰基化合物是油脂氧化过程中的初级和次级氧化产物,即共轭烯烃和羰基化合物含量越高则油脂氧化程度越深。而总酚、生育酚、黄酮、β-胡萝卜素和磷脂含量与OSI呈极显著正相关,说明核桃油中的总酚、生育酚、黄酮、β-胡萝卜素和磷脂具有一定的抗氧化能力。国外也已有一些相关研究得出类似的结论,Jiyeun等发现,生育酚可以钝化单线态氧至基态,从而降低光照引起的油脂氧化,且生育酚与胡萝卜素、磷脂之间均有良好的抗氧化协同作用[7]。Luis等研究橄榄油中酚类物质的抗氧化作用,发现橄榄油的氧化稳定性与其总酚含量高度相关[11]。此外,Jana等人的研究结果表明[8],黄酮类物质能够抑制油脂氧化是因为它能够抑制油脂与氧的反应,从而起到抗氧化作用。同时,Jierong等人[4]的研究表明,类胡萝卜素可以有效抑制光照引起的鱼油氧化,且与生育酚之间有良好的协同作用。Mohamed等人[6]研究了几种植物油的自由基清除能力,结果表明磷脂具有一定的抗氧化作用,且可以通过乳化作用增加抗氧化剂与油脂的接触,提高抗氧化效果。由此可见,油脂中的微量成分的确会对油脂的氧化稳定性产生一定影响,但具体抗氧化机理还有待进一步深入研究。
利用回归分析进一步分析7种微量组分与核桃油OSI的相关程度,结果如表4所示。
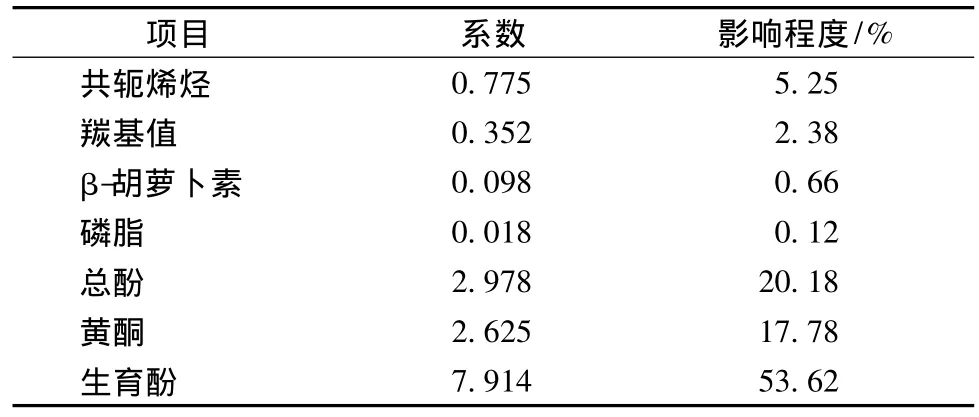
表4 核桃油微量组分对OSI影响程度Table 4 Relative contribution of each micro component contents to OSI of walnut oil
通过回归分析得到的回归模型P=0.032<0.05,模型有意义。由于回归方程各项系数大小表示该自变量对因变量影响程度的大小,因此由表4可知,7种微量成分对核桃油OSI的影响程度依次为:生育酚>总酚>黄酮>共轭烯烃>羰基化合物>β-胡萝卜素>磷脂。在具有抗氧化作用的微量组分中,生育酚对核桃油氧化稳定性的影响最大,为53.62%;其次为总酚,20.18%、黄酮,17.78%。而具有促氧化作用的共轭烯烃和羰基化合物对核桃油OSI的影响程度分别为5.25%和2.38%。
2.2.3 微量组分与核桃油初级、次级氧化相关性
共轭烯烃是油脂氧化过程中的初级产物指标,而羰基化合物是油脂氧化的主要次级产物,因此可以用共轭烯烃值和羰基价分别表示油脂初、次级氧化程度。由2.2.1结果可知,胡萝卜素、磷脂、总酚、黄酮及生育酚5种微量组分均具有一定的抗氧化能力,因而进一步利用回归分析研究5种抗氧化微量组分与核桃油初、次级氧化相关程度,结果如表5所示。
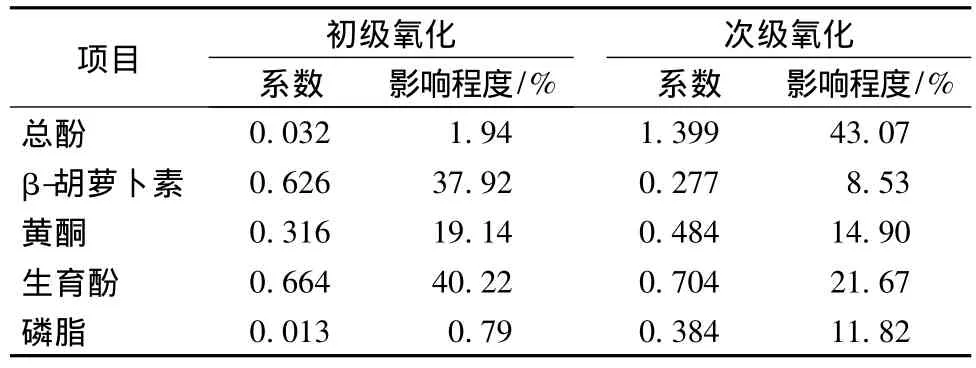
表5 抗氧化微量组分与核桃油初、次级氧化相关性Table 5 Relative contribution of each micro component contents to primary and secondary oxidation of walnut oil
由表5可看出,5种抗氧化微量组分对初级氧化和次级氧化的抑制程度不尽相同。其中,对核桃油OSI影响较大的3种微量组分——生育酚、总酚、黄酮对初级氧化的抑制作用分别为40.22%、1.94%、19.14%,而对次级氧化的抑制作用分别为21.67%、43.07%、14.90%,可见生育酚抑制核桃油初级氧化的作用大于次级氧化,总酚抑制核桃油次级氧化的作用大于初级氧化,而黄酮对核桃油初级氧化和次级氧化的抑制作用相差不大。β-胡萝卜素对核桃油初级氧化的抑制作用(37.92%)是对次级氧化的抑制作用(8.53%)的5倍左右;相反,磷脂对核桃油次级氧化的抑制作用(11.82%)是对初级氧化抑制作用(0.79%)的10倍以上。可见,5种微量组分对初级氧化的抑制作用生育酚>β-胡萝卜素>黄酮>总酚>磷脂;对次级氧化的抑制作用总酚>生育酚>黄酮>磷脂>β-胡萝卜素。
3 结论
通过以上研究发现,核桃油具有一定的体外抗氧化活性,能有效清除DPPH·和ABTS+·,且核桃油的体外抗氧化活性与其氧化稳定性(OSI)显著相关。此外,核桃油中的微量组分对核桃油氧化稳定性影响显著,其中共轭烯烃和羰基化合物具有促氧化作用,而多酚、生育酚、黄酮、β-胡萝卜素、磷脂具有抗氧化作用。同时发现,核桃油中不同抗氧化微量组分对其氧化稳定性影响能力不同,且同一微量组分对核桃油初级和次级氧化过程的抑制作用也存在差异,说明在油脂的氧化进程中,不同的抗氧化物质可能作用机理不同。因此,为了提高核桃油的氧化稳定性,改善其营养品质及延长货架期,在油脂加工过程中应尽量保留其抗氧化微量物质,或以此为基础开发适合的天然抗氧化剂,进一步提高核桃油的营养价值及货架寿命。
[1] 曹君,李红艳,邓泽元.植物油氧化稳定性的研究进展[J].食品工业科技,2013,34(7):378-386.
[2] Miraliakbari H,Shahidi F.Antioxidant activity of minor components of tree nut oils[J].Food Chemistry,2008,111(2):421-427.
[3] Reza F,Razieh N,Mitra R,et al.Kinetic parameter determination of vegetable oil oxidation under rancimat test conditions[J].European Journal of Lipid Science and Technology,2008,110(6):587-592.
[4] Jierong Y,Mogens L A,Leif H S.Interactions between tocopherols,tocotrienols and carotenoids during autoxidation of mixed palm olein and fish oil[J].Food Chemistry,2011,127(4):1 792-1 797.
[5] Antonella D L,Vincenzo M.Heat-oxidation stability of palm oil blended with extra virgin olive oil[J].Food Chemistry,2012,135(3):1 769-1 776.
[6] Mohamed F R,Joerg-Thomas M,Screening of the antiradical action of vegetable oils[J].Journal of Food Composition and Analysis,2006,19(8):838-842.
[7] Jiyeun L,Eunok C.Effects of phospholipids on the antioxidant activity of α-tocopherol in the siglet oxygen oxidation of canola oil[J].New Biotechnology,2011,28(6):691-697.
[8] Jana V,Martina D,Miroslay O,et al.Lipophilic rutin derivatives for antioxidant protection of oil-based foods[J].Food Chemistry,2010,123(1):45-50.
[9] Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolourisation assay [J].Free Redical Biology and Medicine,1999,26(1):1 231-1 237.
[10] 黄海兰,赵祖亮,王斌贵.磷钼络合物法与β-胡萝卜素-亚油酸法测定海藻脂类成分抗氧化活性的比较[J].中国油脂,2005,30(3):32-35.
[11] Luis C M,José A P,Paula B A,et al.Evaluation of a numerical method to predict the polyphenols content in monovarietal olive oils[J].Food Chemistry,2007,3(102):976-983.
