解脂耶罗维亚酵母菌利用地沟油联产柠檬酸和胞内油脂*
2014-12-25柯智健孙磊曹丽常欢欢刘晓燕
柯智健,孙磊,曹丽,常欢欢,刘晓燕
1(淮阴师范学院生命科学学院,江苏淮安,223300)
2(淮阴师范学院江苏省生物质能源与酶技术重点实验室,江苏淮安,223300)
柠檬酸是一种重要的有机酸,被广泛应用于食品业、农业和医药业等众多领域,其生产开发存在着广阔的拓展空间[1]。目前柠檬酸工业生产主要通过黑曲霉(Aspergillus niger)利用淀粉质粮食原料发酵获得。近年来,粮食发生世界性短缺而价格飞涨,我国的柠檬酸低成本生产优势在不断减小;同时,柠檬酸传统工业生产菌株黑曲霉也因其致病性而受到人们的质疑,因此,寻找低价的生产原料和安全的生产菌株成为柠檬酸发酵产业的当务之急[2]。
随着世界能源危机愈演愈烈,化石燃料的替代能源——可再生生物柴油的研究炙手可热。生物柴油的生产几乎可以采用所有的天然油脂为原料,包括微生物产生的油脂。产油微生物能在农副产品及食品工业产生的废弃物中生长并生产胞内油脂,可缓解动植物油脂作为生物柴油原料的紧缺局面,从而有效降低生物柴油的生产成本,因此微生物胞内油脂的开发利用已成为研究的热点[3]。
近年来,解脂耶罗维亚酵母菌(Yarrowia lipolytica)因较高的发酵柠檬酸产量而受到研究者的普遍关注。Y.lipolytica是一种常见的好氧菌,对人类健康无任何危害,该菌在氧气充足和碳源过剩的情况下,可产生大量的柠檬酸[4],是柠檬酸发酵工业中独具潜力的A.niger替代菌株。Y.lipolytica能够在油脂为唯一碳源的培养基中生长并生产相关产物[5-7],除了高产柠檬酸外,Y.lipolytica还是一种重要的微生物油脂生产菌株,该菌经过改造后以油脂为原料其胞内油脂累积量可达到61.7%[8]。
地沟油是从餐饮业废水中提取的不可再食用油脂,含多种有害成分,有很强的致癌性[9]。然而由于价格低廉,地沟油回流至餐饮业的不法现象屡禁不止,给社会带来巨大危害。地沟油属于混合油脂,可作为Y.lipolytica生产柠檬酸和胞内油脂的碳源,而地沟油中的有害成分可在柠檬酸和胞内油脂发酵及提纯过程中去除[2]。基于此,本研究以Y.lipolytica为发酵菌株,以廉价地沟油为生产原料,通过条件优化及发酵控制,实现柠檬酸及胞内油脂的同时发酵生产,为降低两种产物的发酵成本,实现地沟油的合理利用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株
本研究所用的菌株为解脂耶罗维亚酵母菌(Yarrowia lipolytica SWJ-1b),该菌分离自渤海鱼类肠道。
1.1.2 原料
实验所用地沟油收集自当地废弃油脂回收站。
1.1.3 培养基
YPD(yeast extract peptone dextrose medium)固体培养基(g/L):葡萄糖 20.0,蛋白胨 20.0,酵母粉10.0,琼脂粉 20.0。
YPD液体培养基(g/L):葡萄糖 20.0,蛋白胨20.0,酵母粉 10.0。
发酵培养基(g/L):地沟油或甘油,(NH4)2SO40.2,KH2PO42.0,Na2HPO410.0,MgSO4·7H2O 1.5,CaCl20.2,ZnSO4·7H2O 0.02,MnSO4·H2O 0.06,酵母提取物 0.3,硫胺素 0.006,用浓 HCl调pH至6.0,在115℃下灭菌30 min,冷却后加入过滤除菌的1.6%(w/v)溴甲酚紫指示剂[3]。
1.2 方法
1.2.1 种子液的培养
Y.lipolytica SWJ-1b菌株在YPD固体培养基上活化后,挑取单菌落接种于 YPD液体培养基中,28℃,180 r/min振荡培养至菌体浓度达到OD600=30.0。
1.2.2 发酵培养
上述菌液接种至发酵培养基中,28℃下振荡培养。根据培养基中指示剂颜色变化用2.0 mol/L KOH调节pH,使之保持在6.0左右,直至指示剂颜色不再变化,说明发酵结束[4]。
1.2.3 菌体显微形态观察
发酵结束时,直接取样在相差显微镜下观察拍照,放大倍数为40×10。
1.2.4 发酵液中柠檬酸含量测定
利用高效液相色谱分析法测定发酵液中的柠檬酸含量。色谱及检测条件为:色谱柱类型:Agilent Zorbax NH2column(5.0 μm,4.6 mm ×250.0 mm);流动相:10.0 mmol/L(NH4)2HPO4溶液(pH 2.7);流速:0.5 mL/min;进样量:20.0 μL;温度:25 ℃;紫外检测波长:210 nm。
1.2.5 菌体油脂含量测定及提取
发酵液在5 000 r/min下离心5 min,去除上清,所得菌体用正己烷离心洗涤2~3次去除细胞表面油脂,放入80℃烘箱烘至恒重,称量细胞干重。将烘至恒重的菌体在研钵中研磨后,利用索氏提取法提取胞内油脂,并计算菌体油脂含量[10]。
1.2.6 油脂成分分析[8]
上述步骤所得油脂利用Agilent 6890气相色谱仪分析其成分。色谱柱:JH-FFAP石英毛细管柱(50m ×0.32 mm ×0.25 μm);柱温:程序升温,80℃—150℃(5℃/min,停留5 min)—250℃(3℃/min);FID检测温度:280℃;进样口温度:260℃;载气:99.999%氮气;载气流速:1.2 mL/min;分流比:1∶50;进样量:1 μL。
1.2.7 培养基中地沟油含量测定
发酵过程中发酵培养基的油脂含量测定参照ZHAN 的方法[11]。
1.2.8 发酵条件对产物产量的影响
发酵培养基的地沟油初始浓度为40.0 g/L,分别以 104、105、106、107、108、109、1010个细胞/L 培养基的发酵液菌体浓度进行接种,考察接种量对产物产量的影响;发酵培养基的地沟油初始浓度分别为30.0,40.0,50.0,60.0,70.0,80.0,90.0 g/L,考察碳源初始浓度对产物产量的影响;在地沟油初始浓度为80.0 g/L,接种量为5×108个细胞/L培养基的情况下,分别以 100、120、140、160、180、200、220 r/min 的摇床转速进行发酵培养,考察培养转速对产物产量的影响。
2 结果与分析
2.1 Y.lipolytica SWJ-1b分别以甘油和地沟油为碳源的发酵情况比较
甘油是Y.lipolytica SWJ-1b发酵产柠檬酸较好的原料之一[2,4],我们将 Y.lipolytica SWJ-1b 分别在以甘油和地沟油为碳源(浓度40.0 g/L)的发酵情况进行了比较。图1a和图1b分别是Y.lipolytica SWJ-1b在甘油和地沟油发酵培养基中的细胞形态的显微照片,其中,图1b中的酵母细胞内存在明显的油滴,初步证明Y.lipolytica SWJ-1b以地沟油为原料时有大量胞内油脂的累积。图2数据显示,以地沟油为碳源时的柠檬酸产量(21.8 g/L)略低于以甘油为碳源的柠檬酸产量(23.1 g/L),但胞内油脂的含量(32.3 g/100 g细胞干重)却明显高于后者(15.6 g/100 g细胞干重),这说明地沟油可以作为Y.lipolytica SWJ-1b同时产柠檬酸和胞内油脂的原料。
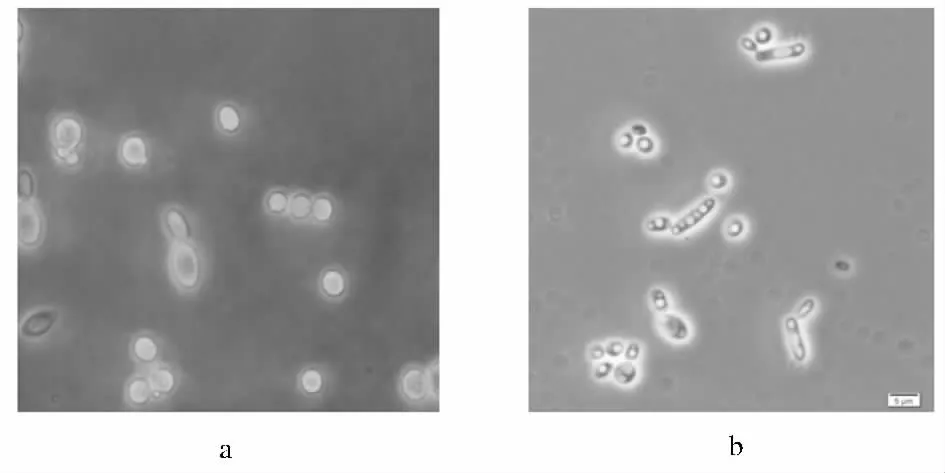
图1 Y.lipolytica SWJ-1b分别在甘油和地沟油发酵培养基中的细胞形态(放大倍数10×40)Fig.1 The cell morphology of Y.lipolytica SWJ-1b in the medium containing glycerol and illegal cooking oil respectively(Magnification 10×40)

图2 Y.lipolytica SWJ-1b分别以甘油和地沟油为碳源的产物产量Fig.2 Products yields of Y.lipolytica SWJ-1b from illegal cooking oil and glycerol respectively
2.2 菌株接种量对产物产量的影响
发酵过程是微生物细胞参与的生物化学反应过程,产物的生物合成受微生物细胞的数量及代谢情况的影响。一般情况下,菌体浓度越高,产物产量也高;但是菌体浓度过高,过量的菌体则会呼吸消耗碳源及营养物质,引起培养基溶氧不足,反而降低产物产量[12],因此需确定发酵的最佳接种量。由图3可知,随着接种量的增加,柠檬酸和油脂产量提高,当接种量分别为108及109个细胞/L培养基时,柠檬酸和油脂产量分别达到最高(22.1 g/L,33.6 g/100 g细胞干重),之后随着接种量进一步提高,柠檬酸及油脂产量下降。根据以上实验结果,我们采用的接种量为5×108个细胞/L培养基。
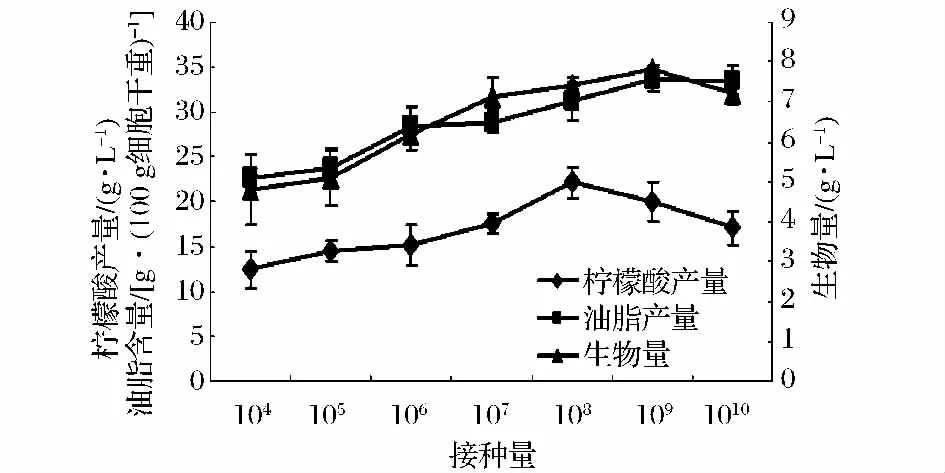
图3 接种量对产物产量的影响Fig.3 Effects of inoculation size on the yields of products
2.3 地沟油含量对产物产量的影响
Y.lipolytica产柠檬酸及胞内油脂的先决条件是培养基碳源过剩,因此碳源浓度对这2种产物的产量有重要影响。理论上产物产量应随碳源浓度提高而增高,而事实往往并非如此。在我们之前的研究中,Y.lipolytica 87利用菊粉产柠檬酸时,菊粉的最佳初始浓度为100.0 g/L,培养基菊粉初始浓度过高或过低所得的柠檬酸产量均不理想[13];而在Anita等的研究中,Y.lipolytica Wratislavia AWG7利用甘油发酵柠檬酸的最适浓度为50.0 g/L,碳源浓度进一步提高则柠檬酸产量有所下降[14],由此可见培养基碳源浓度对产物产量有直接影响。由图4可知,当培养基中碳源浓度较低时,柠檬酸及油脂产量均随碳源浓度提高而提高,碳源浓度增至80.0 g/L时,柠檬酸及油脂产量均达最高值(33.5 g/L,43.8 g/100 g细胞干重),之后随培养基中地沟油浓度进一步提高,二者产量均出现下降趋势,这说明80.0 g/L是Y.lipolytica利用地沟油同时生产柠檬酸及油脂的最佳初始碳源浓度。
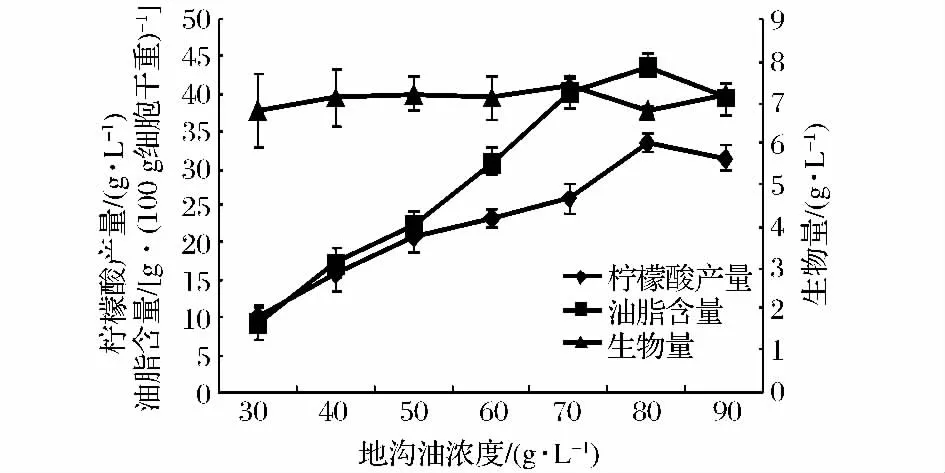
图4 地沟油含量对产物产量的影响Fig.4 Effects of the initial concentrations of illegal cooking oil on the yields of products
2.4 培养转速对产物产量的影响
微生物合成油脂及柠檬酸都是需氧的过程,因此供氧量对这2种产物的产量都有很大影响。其中,产油真菌在供氧缺乏条件下,甘油三酯合成会强烈受阻,并大量积累磷脂和游离脂肪酸;而产柠檬酸菌株在氧气不足时,碳源则主要通过糖酵解途径消耗,而很少进入TCA循环进而生成柠檬酸。本部分实验通过控制培养过程的摇床转速来控制发酵过程中的供氧量,在图5中,随摇床转速增加,产物产量增加,当转速为180 r/min时,柠檬酸及胞内油脂产量均达到最高,而菌体生物量则随转速的提高而降低。
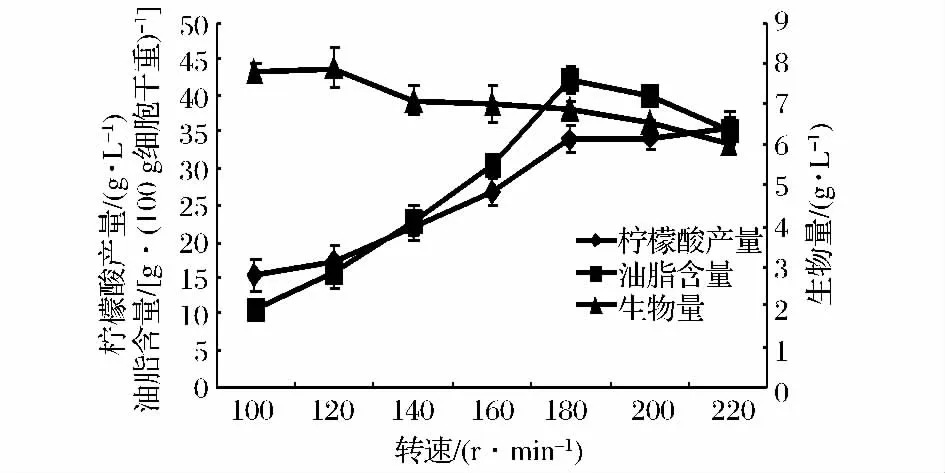
图5 摇床转速对产物产量的影响Fig.5 Effects of rotate speeds of shaker on the yields of products
2.5 发酵过程产物含量变化趋势
在培养基地沟油浓度为80.0 g/L,接种量为5×108个细胞/L培养基及培养转速为180转/分钟的培养条件下,柠檬酸及油脂产量变化趋势如图6所示。从图6可以看出,在发酵的前72 h主要为菌体生长阶段,此时柠檬酸及油脂的生成很少;发酵的72~120 h,主要为油脂合成阶段,此时菌体已基本停止生长,油脂含量迅速增至44.9 g/100g细胞干重;发酵的120 h以后,柠檬酸产量大幅提高,直至发酵结束,柠檬酸产量达到最高(33.6 g/L)。而此期间油脂含量基本保持恒定,只在发酵后期出现轻微下降,原因可能是有少量油脂被水解用于柠檬酸的合成。由此可见,Y.lipolytica利用地沟油发酵过程包括3个阶段:细胞生长阶段,油脂合成阶段和柠檬酸合成阶段,这与之前Makri等报道的结果基本吻合[15]。
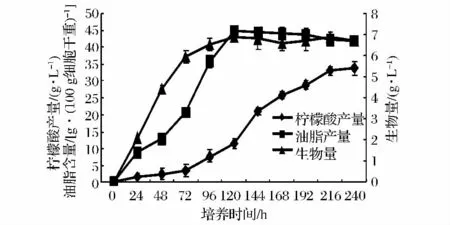
图6 发酵过程产物产量变化Fig 6 Time course of cell growth,citric acid production and the accumulation of intracellular lipid.
据Levinson等报道,Y.lipolytica YB-423以甘油为原料时能够产生21.6 g/L柠檬酸[4];Y.lipolytica ACA-DC 50109以橄榄处理厂废料为原料发酵柠檬酸的产量为28.9 g/L[16],而本研究中以地沟油为原料时发酵柠檬酸产量则达33.6 g/L,这说明与其他碳源相比,地沟油是Y.lipolytica发酵柠檬酸的良好原料。在生产胞内油脂方面,赵春海等报道Y.lipolytica ACA-DC50109分别以葡萄糖、果糖、蔗糖及菊粉等糖类物质为原料的胞内油脂产量均仅为30.0 g/100g细胞干重左右[17],而 Y.lipolytica SWJ-1b以地沟油为原料时的胞内油脂累积量则达到44.9 g/100g细胞干重,表明地沟油作为生产胞内油脂的原料同样具有明显优势。
2.6 地沟油和胞内油脂成分比较
利用气相色谱法分别分析地沟油及胞内油脂的主要脂肪酸成分,结果如表1所示。从表1可以看出,胞内油脂中,饱和脂肪酸油酸的含量远低于地沟油,而亚油酸及亚麻酸等不饱和脂肪酸的含量则高于地沟油,这说明地沟油经微生物利用并生成胞内油脂的过程中,油脂的饱和性降低。Papanikolaou等研究发现,胞内油脂的饱和性与底物浓度及发酵时间有密切关系,底物浓度越高,胞内油脂的不饱和度就越高[18],原因可能在于微生物胞内与脂肪酸合成有关的酶受着底物浓度及发酵时间的调控。

表1 地沟油及胞内油脂主要脂肪酸组成 %Table 1 Fatty acid composition of illegal cooking oil and the intracellular lipid of Y.lipolytica SWJ-1b
3 结论
本文以Y.lipolytica SWJ-1b为发酵菌株,利用地沟油进行柠檬酸和胞内油脂的同时发酵,并对该发酵过程中柠檬酸和胞内油脂同时保持较高产量的最佳条件进行探索,在最佳发酵条件下,柠檬酸和胞内油脂的产量分别达到33.6 g/L和44.9 g/100g细胞干重,该发酵过程包括3个阶段,即细胞生长阶段,油脂合成阶段和柠檬酸合成阶段。地沟油合成胞内油脂后,其脂肪酸饱和程度降低。由此可见,地沟油是Y.lipolytica SWJ-1b联产柠檬酸和胞内油脂的理想原料。
[1] Soccol C R,Vandenberghe L P S,Cristine R.New perspectives for citric acid production and application [J].Food Technology and Biotechnology,2006,44(2):141-149.
[2] 刘晓燕.海洋解脂耶罗维亚酵母菌产柠檬酸的研究[D].青岛:中国海洋大学,2012.
[3] TANG X,FENG H,TANG W.Metabolic engineering for enhanced fatty acids synthesis in Saccharomyces cerevisiae[J].Metabolic Engineering,2013,16(1):95-102.
[4] Levinson W E,Kurtzman C P,Kuo T M.Characterization of Yarrowia lipolytica and related species for citric acid production from glycerol[J].Enzyme and Microbial Technology,2007,41(3):292-295.
[5] Kamzolova S V,Morguno I G,Aurich A,et al.Lipase secretion and citric acid production in Yarrowia lipolytica yeast grown on animal and vegetable fat[J].Food Tech-nology and Biotechnology,2005,43(2):113-122.
[6] Darvishi F,Nahvi I,Zarkesh-Esfahani H,et al.Effect of plant oils upon lipase and citric acid production in Yarrowia lipolytica yeast[J].Journal of Biomedicine and Biotechnology,2009(1):1-7.
[7] Kamzolova S V,Lunina J N,Morgunov I G.Biochemistry of citric acid production from rapeseed oil by Yarrowia lipolytica yeast[J].Journal of the American Oil Chemists'Society,2011,88(12):1 965-1 976.
[8] Tai M,Stephanopoulos G.Engineering the push and pull of lipid biosynthesis in oleaginous yeast Yarrowia lipolyticafor biofuel production [J].Metabolic Engineering,2013,15(1):1-9.
[9] 黄韬睿,王鑫.通过气相色谱法分析脂肪酸组成鉴别地沟油的方法研究[J].生命科学仪器,2013(11):12-15.
[10] 何东平,陈涛.微生物油脂学[M].北京:化学化工出版社,2005:36-37.
[11] ZHAN H.Determination of oil content in wastewater by ultraviolet spectrophotometry[J].Chemical Journal on Internet,2009,11(9):41-45.
[12] 周建新,彭雪霁,姚明兰,等.黑曲霉液态发酵陈化稻米生产柠檬酸的研究[J].食品科学,2008,29(9):370-372.
[13] LIU X Y,CHI Z,LIU G L,et al.Inulin hydrolysis and citric acid production from inulin using the surface-engineered Yarrowia lipolytica displaying inulinase[J].Metabolic Engineering,2010,12(5):469-476.
[14] Anita R,Waldemar R.High-yield production of citric acid by Yarrowia lipolytica on glycerol in repeated-batch bioreactors[J].Journal of Industrial Microbiology & Biotechnology,2010,37(5):431-435.
[15] Makri A,Fakas S,Aggelis G.Metabolic activities of biotechnological interest in Yarrowia lipolytica grown on glycerol in repeated batch cultures[J].Bioresource Technology,2010,101(7):2 351-2 358.
[16] Papanikolaou S,Galiotou-Panayotou M,Fakas S,et al.Citric acid production by Yarrowia lipolytica cultivated on olive-mill waste water-based media[J].Bioresource Technology,2008,99(7):2 419-2 428.
[17] ZHAO C H,CUI W,LIU X Y,et al.Expression of inulinase gene in the oleaginous yeast Yarrowia lipolytica and single cell oil production from inulin-containing materials[J].Metabolic Engineering,2010,12(6):510-517.
[18] Papanikolaou S,Fakas S,Fick M,et al.Biotechnological valorisation of raw glycerol discharged after bio-diesel(fatty acid methyl esters)manufacturing process:Production of 1,3-propanediol,citric acid and single cell oil[J].Biomass and Bioenergy,2008,32(1):60-71.
