微生态制剂对仔猪生长性能及肠道菌群的影响
2014-12-25商志伟
王 娜 , 商志伟 , 赵 敏
(1.东北林业大学 生命科学学院,黑龙江 哈尔滨 150040;2.黑龙江民族职业学院 学生工作部,黑龙江 哈尔滨150066;3.黑龙江民族职业学院 食品工程系,黑龙江 哈尔滨 150066)
近年来,关于动物肠道微生态的研究日益受到人们重视。一方面,人们试图从肠道微生态角度寻求作为动物促生长剂——抗生素的替代品[1];另一方面,动物肠道被认为是人肠道研究的理想模型[2]。而能够调控动物肠道微生物平衡、增殖有益菌、抑制有害菌,从而提高动物健康水平的微生态制剂(probiotics)[3]正日益受到人们的关注。有研究报道,合理利用微生态制剂,可以有效地减少仔猪断奶应激的发生,仔猪饲喂微生态制剂后,其可有效定植在仔猪肠道内[4],能提高动物肠道中的蛋白酶、淀粉酶和脂肪酶活性[5],并能够调节肠道菌群,使在仔猪肠道中对宿主健康起有益作用的细菌数量大幅提高[6],还可以有效抑制致病菌的生长,维持肠道正常的生态平衡[7-8],预防和治疗仔猪腹泻[9]。此外,其无残留、无毒副作用等特点,可改善养殖生态环境,使养殖生产良性发展,取得更好的经济效益和生态效益[10]。动物肠道环境不断变化,并且受多种因素影响,在益生菌的配制方面,一般认为混合菌制剂有益于微生物间的互补,效果较好。Collado等[11]将几种不同乳酸菌进行了复配,并对其肠道抑菌效果进行了试验。结果表明,混合菌株的效果好于单独菌株。Sanders等[12]研究不同益生菌属、种和菌株对宿主的益生作用,也发现复合的菌株或菌种比单一菌株更有效。
在本研究中,作者首次将蜡样芽孢杆菌、戊糖乳杆菌和鼠李糖乳杆菌等进行混合,通过饲喂断奶仔猪,研究其对仔猪生长性能的影响,再进一步研究微生态制剂在仔猪肠道定植情况及其对肠道菌群的影响,旨在深入了解微生态制剂对断奶仔猪生长可能的调控机制,为菌种的合理搭配和复合微生物制剂的生产应用提供科学依据。
1 材料与方法
1.1 微生态制剂
蜡样芽孢杆菌,由作者所在试验室从健康断奶仔猪粪便中分离并鉴定,现存于东北林业大学微生物实验室;鼠李糖乳杆菌(CICC6159)、戊糖乳杆菌(CICC 21809),购置于中国工业微生物菌种保藏管理中心。
戊糖乳杆菌培养基配方为:1 g/dL乳糖+废糖蜜,0.5 g/dL棉粕粉,0.3 g/dL磷酸二氢钠+磷酸氢二钠;蜡样芽孢杆菌培养基为:0.5 g/dL蔗糖+0.5 g/dL废糖蜜,1 g/dL棉粕粉,0.3 g/dL氯化钠;鼠李糖乳杆菌培养基配方为:1 g/dL乳糖+废糖蜜,0.5 g/dL棉粕粉,0.3 g/dL磷酸二氢钠+磷酸氢二钠。
分别发酵戊糖乳杆菌、蜡样芽孢杆菌、鼠李糖乳杆菌,将发酵液以8 000 g离心10 min得菌泥,向菌泥中加入质量分数5%葡萄糖溶液作为保护剂,再拌入适量灭菌干燥的稻壳粉(3种益生菌活菌数≧1×1010cfu/g),低温干燥,得活菌制剂,检测 3种活菌制剂活菌数(活菌数≧1×109cfu/g)后备用,将制备好的3种菌制剂以1∶1∶1体积比例混合即得混合微生态制剂。
1.2 饲养管理及动物试验
试验于大庆市泰康县康泰公司种猪场进行,选用 28 日龄,初始平均体质量为(8.20±0.22)kg 的“杜长 大”三元杂交健康(无腹泻)断奶仔猪24头,仔猪随机分为两组(对照组和试验组),每组4个重复,每个重复3头仔猪。以玉米-豆粕型日粮,营养需要参照英瑞斯企业标准设计(表1),饲料为粉料。对照组饲喂正常粉料,试验组采用粉料拌食质量分数0.1%混合微生态菌制剂(饲料活菌数≧1×109cfu/kg)为日粮。试验期为63 d(试验组饲喂微生态制剂56 d+饲喂正常粉料 7 d),每日 8∶00、13∶00、19∶00 喂食,自由饮水;每次饲喂直至料槽剩余少许饲料为止,准确记录每日每个重复组仔猪日供料量、剩余料量和损失料量,每7 d对两组仔猪逐只空腹称质量。试验期间,每日8∶00定时观察仔猪粪便情况(是否存在粪质稀薄,水分增加,或含未消化食物或脓血、黏液)。记录腹泻头数及次数,计算腹泻率。腹泻率=(总腹泻次数/(总头数×试验天数))×100%。
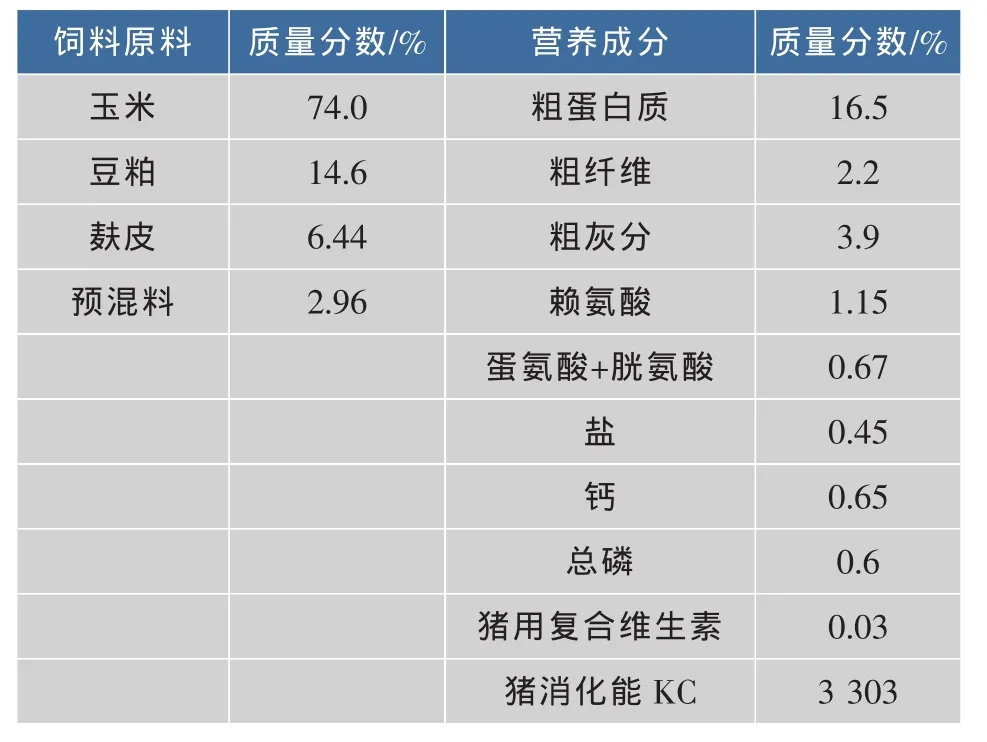
表1 基础日粮配方及营养水平Table 1 Basic diet formula and nutrition levels
1.3 粪便收集
试验期间,每7 d一次于晨8∶00对各重复组仔猪逐只直肠取便少许 (约10 g),立刻放入无菌管中,于-80℃冰箱保存,备用。
1.4 粪样中pH值测定
分别取不同时间点备用粪样2 g,加入l0 mL蒸馏水,混匀后静置5 min,用酸度计测定pH值。
1.5 PCR法检测仔猪粪便益生菌相对含量
1.5.1 细菌基因组提取及引物设计 分别取不同时间点备用粪样2 g,放入组织粉碎机中磨碎,加5 mL无菌磷酸缓冲液稀释,充分混匀,取2 mL匀浆,采用solarbio细菌基因组DNA提取试剂盒提取菌种基因组DNA。在GenBank上查找蜡样芽孢杆菌、鼠李糖乳杆菌、戊糖乳杆菌菌株的16S rDNA序列,然后利用 NCBI(http://www.ncbi.nlm.nih.gov/)设计属内特异性引物,上下游引物序列见表2。

表2 蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌特异性引物Table 2 Primer sequences for genes in Bacillus cereus,Lactobacillus rhamnosus and Lactobacillus pentosus
1.5.2 PCR法检测样品粪便蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌相对含量 PCR程序参考陈津津[13]等方法并加以改进:10×PCR Buffer,25 mmol/L Mg2+,200 μmol/L dNTPS, 上下游引物 0.2 (μmol/L)/0.2(μmol/L),DNA模板1μL,1.25UTaq酶(Promega);反应条件:94℃变性3 min;循环35次;94℃变性40 s,55℃退火20 s,72℃延伸 75 s;72℃延伸5 min。
1.6 DGGE分析微生态制剂对仔猪肠道菌群的影响
选取断奶当天,断奶后7、14、21、28 d和63 d收集的两组仔猪粪样供DNA提取,方法同上。
利用一对细菌通用的引物 F933-954:5’-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCAC GGGGGGGCACAAGCGGTGGAGCATGTGG -3’,R1369-1388:5’-GCCCGGGAACGTATTCACCG-3’对细菌的16S rDNA的V6—V8区片段进行PCR反应[14]。DGGE用质量分数8%聚丙烯酰胺凝胶,尿素质量分数梯度30%~50%,电泳缓冲液为0.5×TAE,先200 V恒压电压预电泳10 min,随后在85 V电压电泳10~12 h。电泳结束后,用银染法进行染色,显色定影后干燥过夜,观察染色效果并照相。
将DGGE凝胶图谱上的特殊条带进行回收,以8 f和1 510 r[15]作为PCR引物用于引导细菌16S rDNA全序列的扩增,然后将PCR产物进行胶回收,与PMD-18T质粒连接,转化至大肠杆菌感受态中,将转化成功的质粒进行测序,序列的同源性通过互联网与GenBank数据库进行比较。
1.7 数据统计与处理
所有数据应用SPSS 13.0统计软件进行方差显著性分析。
2 结果与分析
2.1 微生态制剂对仔猪生长性能的影响
仔猪断奶时由于环境、饲料、消化生理和免疫等因素的改变,易使断奶仔猪产生应激反应,出现消化吸收功能异常,消化道正常微生物区系紊乱,导致腹泻和生长发育受阻[16]。由表3可知,喂食微生态制剂可以促进仔猪的生长,降低料质量比和腹泻率。在喂食微生态制剂前两周时,与对照组相比,试验组仔猪头平均日增质量增加35%,平均料质量比降低9.04%,腹泻率下降37.04%;喂食3~4周时,仔猪头平均日增质量增加26.32%,平均料质量比降低7.7%,腹泻率下降26.32%;喂食5~8周时,头平均日增质量增加10.71%,平均料质量比降低7.7%,腹泻率下降12.03%。说明微生态制剂对仔猪生产性能的影响具有显著的时间效应,在仔猪断奶初期微生态制剂对仔猪的影响最显著。
本研究中,饲喂混合微生态菌制剂2周后头平均日增质量增加35%,平均料质量比降低9.04%,腹泻率下降37.04%,与黄丽彬[17]和王海东[18]等研究相比较,此混合微生态菌制剂效果更佳,这可能是由于本微生态制剂中的菌种间发生协调作用,相互促进各自在肠道内的有益作用,使其益生效果更加明显。
2.2 微生态制剂对仔猪粪样pH值的影响
通常认为,粪便的pH值可部分反映动物消化道中的酸碱程度。pH值偏酸,反映消化道环境有利于有益微生物的生长,而偏碱则反映对有害微生物有利,产生腹泻的概率较大[19]。
由图1可知,试验期间,由于断奶的影响,在对照组中,仔猪粪便pH呈现先上升后下降趋势,直到35 d后pH值才逐渐恢复到断奶当日水平。试验组仔猪粪样pH始终较对照组低,且基本保持在断奶水平。
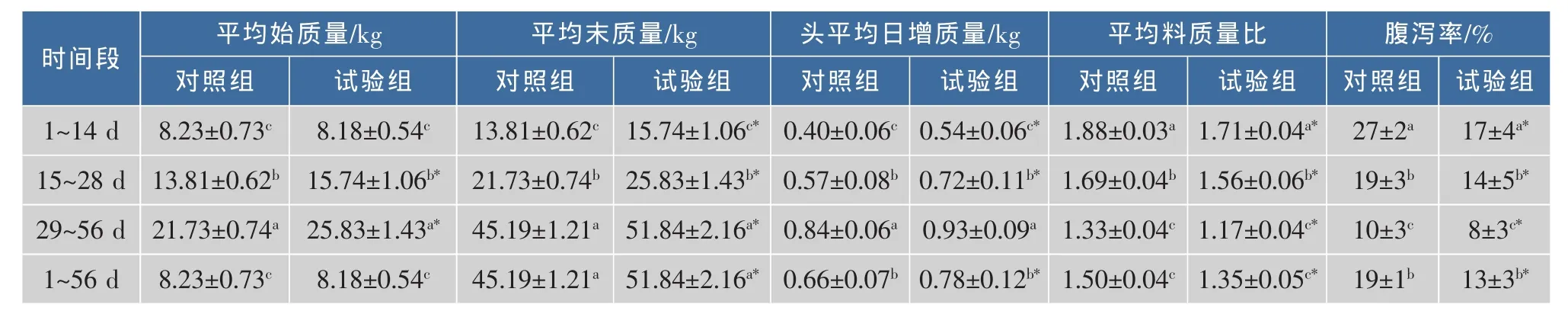
表3 微生态制剂对仔猪生长性能的影响Table 3 Effents of compound probiotic on growth performance of weaning piglet

图1 微生态制剂对仔猪粪便pH值的影响Fig.1 Effents of compound probiotic on pH of weaning pigle
图1说明,通过饲喂本微生态制剂使仔猪消化道保持偏酸性环境,可利于有益微生物的生长。有研究表明,肠道中的酸性环境有利于营养物质的消化吸收,可提高饲料利用率,这点恰好与微生态制剂促进仔猪生长性能相吻合。
2.3 粪便中3种目标益生菌相对含量变化分析
研究表明,对粪便微生物数量的动态监测可以反映目标益生菌在肠道内定植过程的演变规律[20]。图 2(a)(b)(c)各为饲喂微生态菌制剂后跟踪检测3种目标益生菌——蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌于仔猪体内相对于断奶当日变化情况。结果表明,由于断奶的影响,对照组中两种乳酸杆菌在仔猪断奶初期显著降低,而试验组中3目标菌数量均明显高于对照组,随喂食时间的延长试验组中3种目标菌在肠道内的含量有增加的趋势,并且在停喂一周后,粪样中仍存在此3种益生菌,且数量较饲喂时无明显变化。说明,在饲喂8周后微生态制剂中益生菌已成功定植到仔猪消化道中,可以帮助减缓断奶时仔猪消化道内乳酸菌的变化,维持其肠道的稳定性。

图2 仔猪粪便中3种益生菌随时间变化情况Fig.2 Changes of Bacillus cereus,Lactobacillus rhamnosus,and Lactobacillus pentosus on flora in weanling piglets over time
有研究表明,益生菌进入动物体内可通过定植繁殖来维持消化道有益菌的优势作用,并与肠道中的病原菌及潜在的致病菌竞争营养物质,从而抑制有害菌的生长[21-22],提高机体的抗应激能力[23],进一步促进仔猪的生长。
2.4 微生物制剂对断奶仔猪肠道菌群的影响
利用DGGE技术对断奶仔猪粪样菌群进行跟踪研究,结果见图3,并将特殊条带抠胶测序,见表4。
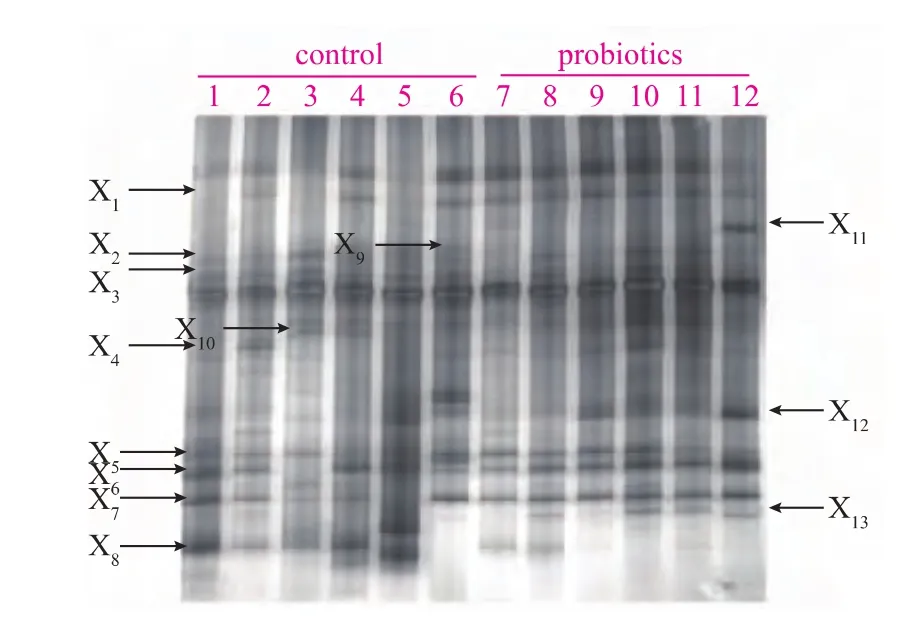
图3 仔猪粪样细菌16S rDNA的V6-V8区扩增产物的DGGE图谱Fig.3 Bacterial DGGE profiles generated from V6-V8 16S rDNA fragments of piglets fecal samples
结果表明,蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌均存在于饲喂益生菌的仔猪粪样中,且此3益生菌数量显著高于对照组,这与qPCR结果相一致,再次说明3种益生菌成功定植在仔猪肠道内。并且,本微生态制剂可以通过增加宿主肠道益生菌(X1、X5、X6、X7、X12和X13)的数量及减少有害菌(X9和X10)的方式来调节肠道功能。如蜡样芽孢杆菌X1,是一种兼性厌氧菌,可以在肠道内短时间定植,消耗大量的氧,维持肠道厌氧环境,有益于厌氧的乳酸菌的生长;X6、X7和X13均为乳酸菌,众所周知,乳酸菌是动物肠道中常见的益生菌,其在抑制动物肠道有害细菌的生长繁殖,抵抗病原茵的感染,代谢产生醋酸、丙酸、丁酸和乳酸等有机酸,刺激肠道蠕动,抑制肠道腐败,提高抗病能力等方面,都有着重要的作用。所以认为,添加本微生态制剂可创造出有利于乳酸菌生长繁殖的环境,通过增殖肠道益生菌的数量来调节仔猪肠道菌群的平衡,进而缓解仔猪断奶应激反应及促进仔猪生长。
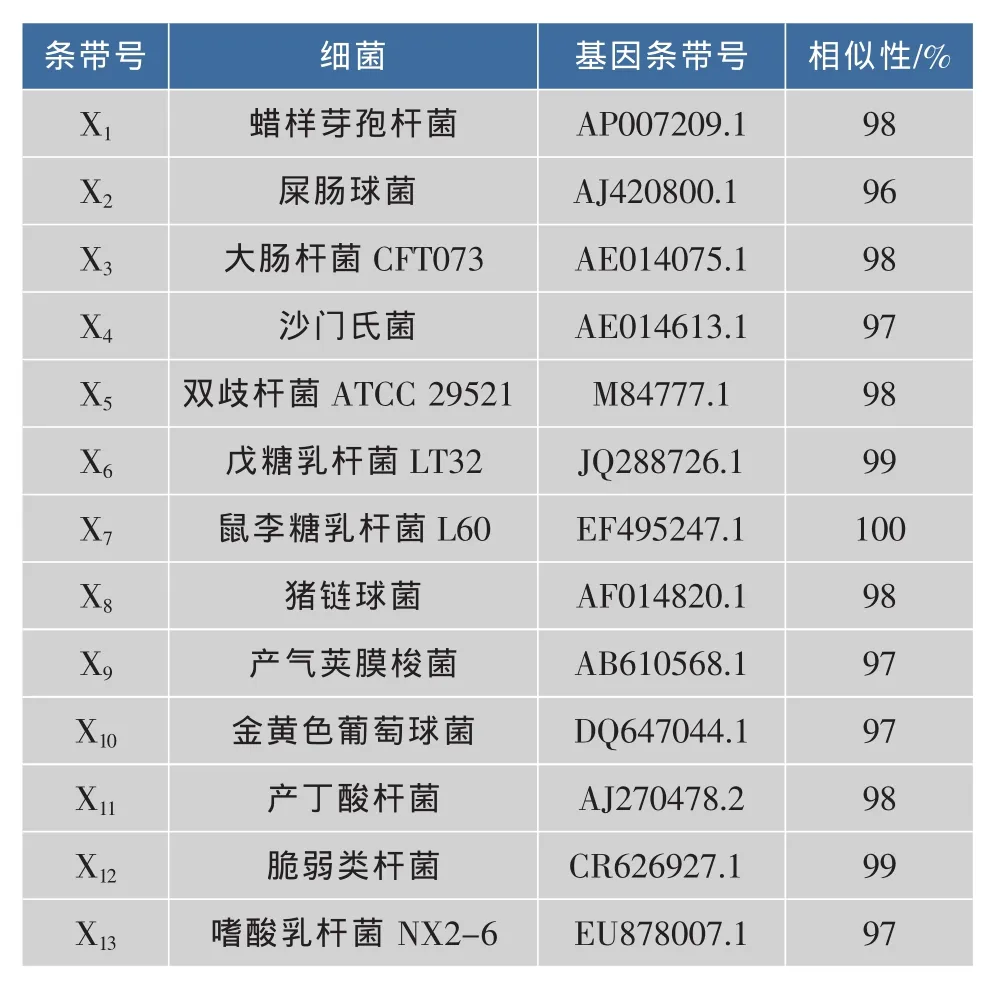
表4 图3中DGGE图谱中特异性条带的16S rDNA序列分析及物种鉴定Table4 16S rDNA sequenceanalysisand species identification ofselected dominant DGGE bands in Fig.3
3 结语
在本文所述试验条件下,饲喂微生态制剂可以通过在仔猪消化道内定植益生菌来增加断奶仔猪日增质量,降低料质量比和腹泻率,维持仔猪肠道中pH值的稳定,促进肠道益生菌的生长繁殖,抑制有害菌的生长;并且,此微生态制剂对仔猪生长性能的影响有时间效应,在仔猪断奶初期效果最佳。
[1]Konstantinov S R,Zhu W Y.Effect of fermentable carbohydrates on piglet faecal bacterial communities as revealed by denaturing gradient gel electrophoresis analysis of 16S ribosomal DNA[J].FEMS Microbiology Ecology,2003,43:225-235.
[2]Thumbleson M E,Shook L B.Advances in Swine in Biomedical Research Plenum[M].New York:[s.n.],1996.
[3]Newbold C J,Wallace J,Mclntosh F M.Mode of action of the yeast Saccharomyces cerevisiae as a feed additive for ruminants[J].British Journal of Nutrition,1996,76(2):249-261.
[4]张锦华.猪源乳酸杆菌的筛选及其对仔猪肠道黏膜免疫影响的研究[D].南京:南京农业大学,2011.
[5]沈锦玉,沈智华,尹文林,等.饲喂枯草芽孢杆菌对银鲫等水生动物肠道菌群及消化酶活性的影响[J].水产学报,2004,28(B12) :146-150.SHEN Jinyu,SHEN Zhihua,YIN Wenlin,et al.Effect of Bacillus Subtilis B115 on intestinal microflora and activity of digestive enzyme of Erythroculter ilishaeformis,Carassius auratus and Macrobrachium nipponens[J].Journal of Fisheries of China,2004,28(B12):146-150.(in Chinese)
[6]苏勇,姚文,朱伟云.益生菌Lactobacillus amylovorus S1对仔猪后肠菌群的影响[J].微生物学报,2006,46(6):961-966.SHU Yong,YAO Wen,ZHU Weiyun.Changes of bacterial flora from hindguts of piglets after oral administration of Lactobacillus amylovorus S1 as a probiotic strain[J].Acta Microbiologica Sinica,2006,46(6):961-966.(in Chinese)
[7]Mantynen V,Lindstrom K.A rapid PCR-Based DNA test for enterotoxic Bacillus cereus[J].Applied Environmental Microbiology,1998,64(5):1634-1639.
[8]Bach H J,Errampalli D,Leung K T,et al.Specific detection of the gene for the extra cellular neutral protease of Bacillus cereus by PCR and blot hybridization[J].Applied Environmental Microbiology,1999,65(7):3226-3228.
[9]张丽芳,王占武.戊糖乳杆菌制剂防治仔猪腹泻效果初探[J].中国微生态学杂志,2008,20(6):568-570.ZHANG Lifang,WANG Zhanwu.Study on effect of lactobacilIus product in preventing and curing piglets diarrhea[J].Chinese Joumal of Microecolog,2008,20(6):568-570.(in Chinese)
[10]Newbold C J,Wallace J,Mclntosh F M.Mode of action of the yeast Saccharomyces cerevisiae as a feed additive for ruminants[J].British Journal of Nutrition,1996,76(2):249-261.
[11]Collado M C,Jalonen L,Meriluoto J,et al.Protection mechanism of probiotic combination against human pathogens:in vitro adhesion to human intestinal mucus[J].Asia Pac J Clin Nutr,2006,15(4):570-575.
[12]Sanders M E,Intveld J H.Bringing a probiotic-containing functional foodnto the market:microbiological,product,regulatory and labeling issues[J].Antonie van Leeuwenhoek International Joural of General and Molecular Microbiology,1999,76(1):293-315.
[13]陈津津.乳酸菌群早期消化道定植的实验与临床研究[D].上海:上海交通大学,2007.
[14]Fernandez M F,Boris S,Barbes C.Probiotic properties of human lactobacilli strains to be used in the gastrointestinal tract[J].J Appl Microbiol,2003,94(3):449-455.
[15]Conway P L.Development of intestinal microbioa[M]//Mackie R I,White B A,Isaacson R E.Gastroin-testinal Microbiology:Gastrointestinal Microbes and Host Interactions.New York:Chapman & Hall,1996:3-38.
[16]谭碧娥,何兴国,孔祥峰,等.不同碳水化合物对断奶仔公猪肠道微生物的影响[J].动物营养学报,2007,19(4):316-320.TAN Bie,HE Xingguo,KONG Xiangfeng,et al.Effects of different carbohydrates on intestinal microbes in male weaned piglets[J].Chinese Journal of Animal Nutrition,2007,19(4):316-320.(in Chinese)
[17]黄立杉,陈有容,齐凤兰.蜡样芽孢杆菌在饲料中的应用[J].粮食与饲料工业,2001(9):32-35.HUANG Lisban,CHEN Yourong,QI Fenglan.Application of Bacillus cereus in feed[J].Cereal and Feed Industry,2001(9):32-35.(in Chinese)
[18]王海东,潘宝海,高玉鹏.鼠李糖乳酸杆菌对断奶仔猪生产性能的影响[J].中国畜牧杂志,2009(7):37-41.WANG Haidong,PAN Baohai,GAO Yupeng.Effect of Lactobacillus rhamnosus on production performance of weaned piglets[J].Chinese Journal of Animal Science,2009(7):37-41.(in Chinese)
[19]唐仁勇.饲料不同形态、状态对早期断奶仔猪生产性能及消化生理的影响[D].雅安:四川农业大学.
[20]康自.微生态学[M].大连:大连出版社,1988:202-204.
[21]Annuk H,Shchepetova J,Kullisaar E,et al.Characterization of intestinal lactobacilli as putative probiotic candidates[J].J Appl Microbiol,2003,94(3):403-412.
[22]Fooks L,Gibson G R.Probiotics as modulator of the gut flora[J].Br J Nutr,2002,88(S1):539-549.
[23]Fernandez M F,Boris S,Barbes C.Probiotic properties of human lactobacilli strains to be used in the gastrointestinal tract[J].J Appl Microbiol,2003,94(3):449-455.
