氨氮质量浓度对餐厨垃圾厌氧消化产沼气的影响
2014-12-25许之扬赵明星缪恒峰任红艳黄振兴高树梅阮文权
许之扬, 赵明星, 缪恒峰, 任红艳, 黄振兴, 王 涛, 高树梅, 阮文权
(江南大学 环境与土木工程学院,江苏 无锡 214122)
近年来,餐厨垃圾的厌氧消化处理受到广泛关注,其在废弃物减量化、生物安全和可再生洁净能源获得等方面具有优势[1-3]。影响厌氧消化过程的因素很多[4],而由于餐厨垃圾富含易降解有机氮[5],厌氧消化过程中容易产生大量的氨氮;且厌氧消化体系缺乏自养型无机氮代谢微生物,使反应体系氨氮的积累加剧[6-8],导致氨氮成为影响该反应过程的重要因素之一。过量的氨氮积累会影响反应过程顺利进行,严重时则会使整个反应停止。一般认为,氨氮质量浓度达到1 500~3 000 mg/L时,厌氧消化体系开始受到抑制[9-10],当氨氮质量浓度高达11 800 mg/L时,厌氧消化体系90%的产甲烷活性被抑制[11]。
有研究表明,厌氧消化体系氨氮质量浓度的升高不仅对产甲烷菌具有抑制,而且会导致体系中挥发性脂肪酸的积累[12]。而作为沼气的重要组成元素,碳元素的转化和利用效率在一定程度上可反映氨氮对厌氧消化过程的抑制程度。反应体系中有机碳浓度的变化能指示厌氧消化过程不同阶段的运行效率以及各阶段间的协作效果[13]。但是分析不同氨氮质量浓度对餐厨垃圾厌氧消化体系中有机酸和有机碳影响的研究较少。
本研究希望通过对不同氨氮质量浓度下反应体系产气、有机碳去除,以及挥发性脂肪酸的累积情况变化,分析氨氮对餐厨垃圾厌氧消化过程的抑制影响。
1 材料与方法
1.1 实验材料
餐厨垃圾取自江南大学二食堂,其主要成分参见表1;产甲烷菌种取自江苏洁净环境科技有限公司长期处理餐厨垃圾的厌氧消化罐,反应罐处理温度(θ)为 55 ℃,水力停留时间(HRT)为 30 d,污泥总固体质量分数(TS)为3.31%。
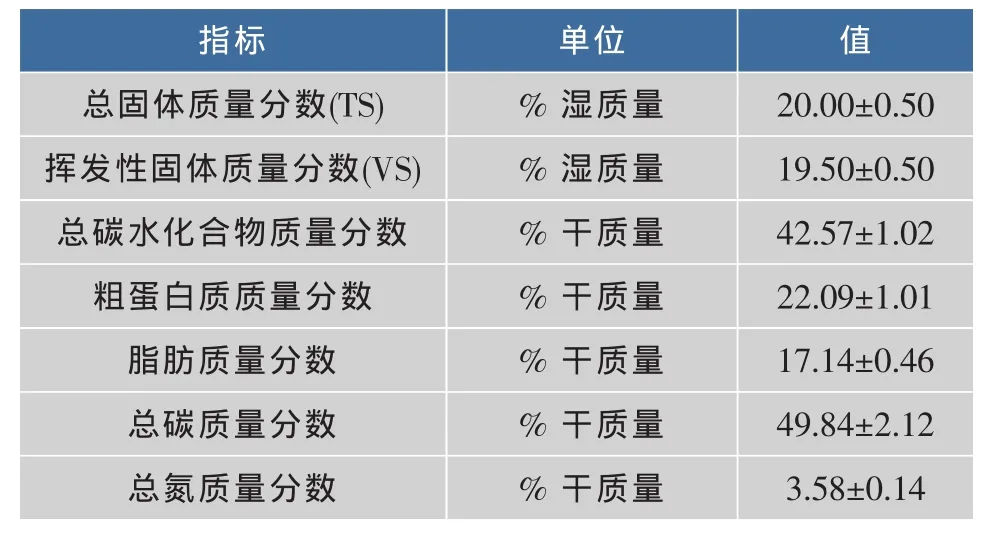
表1 餐厨垃圾成分Table 1 Characterization of food wastes
1.2 实验装置
本实验中使用瑞典碧普公司生产的甲烷自动潜力测试系统 (automatic methane potential test system)作为餐厨垃圾厌氧消化反应装置(图1)。每一个反应单元由一个500 mL的玻璃瓶、密封装置、搅拌装置和气体收集管组成。反应产生的沼气可通过该系统实现在线监测。反应温度为55℃。

图1 产甲烷潜力测试仪Fig.1 Automatic methane potential test system
1.3 实验方法
在前期研究的基础上,设定反应体系的物料质量比为 m(餐厨垃圾)∶m(污泥)=1∶4,以 NH4Cl为外源性无机氮源,设置反应体系的初始氨氮质量浓度为 0、1 500、3 000、4 500、6 000 mg/L, 以下分别用C、N1、N2、N3和N4表示这5种初始氨氮质量浓度的反应体系。反应过程中不调节pH值。根据产甲烷潜力测试系统实时记录产气数据。
1.4 测定方法
TS和VS的测定采用质量法[14],氨氮的测定采用水杨酸法[15],总氮和粗蛋白质质量分数测定采用凯氏氮法[16],碳水化合物测定采用苯酚硫酸法[17],脂肪含量测定采用索氏萃取法[18]。
有机酸的测定:有机酸测定采用液相色谱法,柱子为ZORBAX SB-Aq柱,柱尺寸150 mm×4.6 mm,5 μm;流动相:体积分数1%乙腈、体积分数99%0.02 mol/L NaH2PO4,调 pH 至 2.0(用磷酸调节);流动相体积流量0.5 mL/min;进样量10 μL;柱温30℃;紫外检测波长210 nm。
TOC的测定:采用日本岛津公司TOC-Vcsh测定仪。
取样品2 g放入坩埚中,放置于105℃烘箱中2 h。取出冷却后分别装入2个样品盅中,控制在0.1 g左右,分别放入TOC测定仪中测定TC(总碳质量浓度)和IC(无机碳质量浓度),最后得出结果。
产气速率拟合采用Gauss方程:
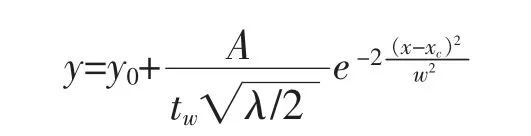
式中:y为实时产气速率,y0为产气速率本底值,tw为反应持续时间,A为反应时间内产气量,xC为产气速率峰值时刻。
2 结果与分析
2.1 不同氨氮质量浓度条件下沼气累积情况分析
不同氨氮质量浓度下,餐厨垃圾厌氧消化体系的产气情况如图2所示。整个反应过程呈现出两个产气高峰阶段,分别在反应的0~18 h和72~180 h。在第一个产气高峰,各组分产气情况变化不大,并未随氨氮质量浓度的不同而发生明显改变,当反应进行到第18小时,各组分(干质量)累积产沼气量分别达到 117.2、108.8、102.9、100.7、96.7 mL/g;而在第二个产气高峰时,各组分随着氨氮质量浓度的升高,累积产气量呈现下降趋势,当反应停止时,各组分 (干质量)的累积产气量分别为547.6、508.2、480.6、480.6、466.6 mL/g。
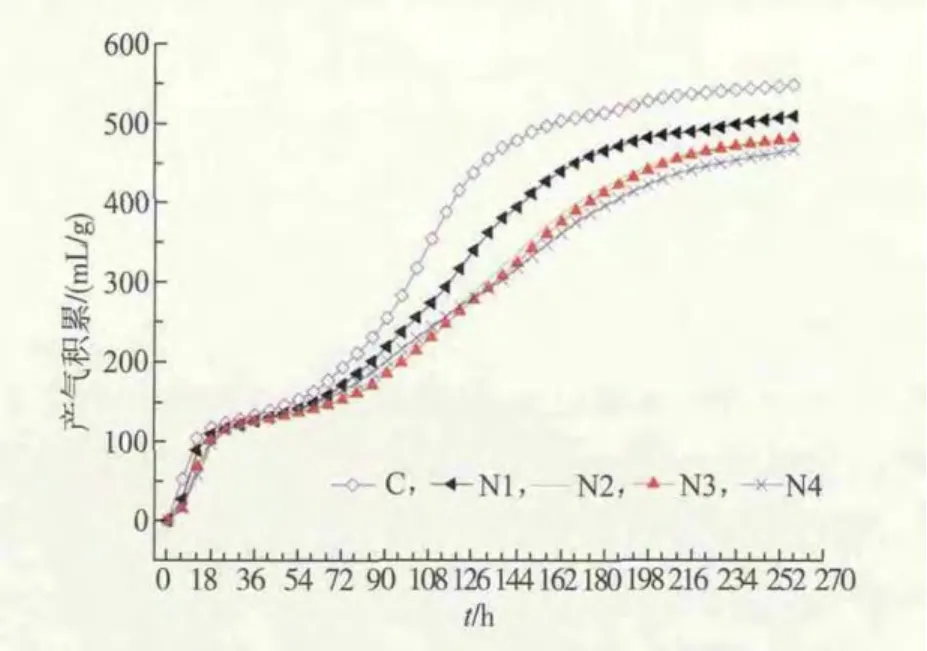
图2 不同氨氮质量浓度下累积产气量情况(干质量条件下)Fig.2 Biogas production under different concentration of ammonia
氨氮质量浓度的变化对餐厨垃圾厌氧消化产甲烷过程的产气速率影响较明显,如图3所示,在整个反应过程中也出现了两个产甲烷速率高峰。利用Gauss方程拟合两个阶段,第一个产气高峰时,反应体系产气速率激增,但是持续时间较短。随着反应体系氨氮质量浓度的不断提高,最大产气速率y值呈下降趋势,各组(干质量条件下)分别为26.3、19.4、15.1、13.4 mL/(h·g)和 11.8 mL/(h·g),且达到最大产气速率的时刻xc不断延迟,从组分C的第6小时延迟至组分N4的第12小时。
相对于第一个产气高峰,第二个产气高峰时反应体系产气速率变化较为缓慢,但整个产气过程延续时间较长。与第一个产气高峰相同,随着氨氮质量浓度的升高,最大产气速率y值不断降低,从组分 C 的 6.0 mL/(h·g)降低到组分 N4 的 2.7 mL/(h·g),且达到最大产气速率的时刻xc不断延迟,从组分C的第108小时延迟至组分N4的第150小时。

图3 不同氨氮质量浓度下产气速率变化情况(干质量条件下)Fig.3 Changes of biogas production rate under different concentrations of ammonia
上述结果表明,氨氮质量浓度对餐厨垃圾厌氧消化产甲烷体系存在显著抑制,随着质量浓度的不断提高,反应体系受抑制程度不断增强。
2.2 不同氨氮质量浓度条件下有机碳去除情况
对于固体有机废弃物,反应体系首先需要将其水解成可溶性小分子才能进一步消化利用[13]。因此,溶解性有机碳的变化趋势能反映厌氧消化过程中对底物的利用情况。由图4可知,反应初始阶段,各组分溶解性有机碳质量浓度均迅速上升,随着反应体系氨氮质量浓度的提高,其最高质量浓度的出现时间从C组的第5小时推迟到N4组的第50小时,相应质量浓度分别为4 900 mg/L和5 188 mg/L。这表明:餐厨垃圾厌氧消化水解阶段随着氨氮质量浓度升高而逐渐受到抑制,导致固相中有机物的水解速率逐渐降低。而随着厌氧消化反应的进行,溶解性有机碳质量浓度不断下降,这表明体系中产甲烷菌利用底物产甲烷的速率大于固体有机物水解的速率。同时,随着体系氨氮质量浓度的升高,产甲烷菌活性受抑制程度提高,溶解性有机碳消耗速率逐渐降低,当反应终止时,溶解性有机碳质量浓度从C组的1 962.4 mg/L上升到N4组的2 490.0 mg/L。实验结果显示,随着氨氮质量浓度的升高,反应体系产甲烷活性受抑制程度不断提高。
由图5可知,随着反应体系氨氮质量浓度的提高,总有机碳(TOC)的去除率呈逐渐降低的趋势,当氨氮质量浓度小于3 000 mg/L时,有机碳去除率虽有所降低,但并不明显,从C组的57.4%降低到N2组的53.8%,总有机碳利用率只降低6.3%。当反应体系氨氮质量浓度大于3 000 mg/L时,总有机碳利用率显著下降,相对于C组,N3和N4组总有机碳利用率分别下降了15.2%和29.3%。由总有机碳随氨氮质量浓度升高利用情况的变化趋势获得相应拟合曲线为:y=-0.495x2+0.291x+56.97,R2=0.991。由此计算出氨氮抑制餐厨垃圾厌氧消化过程的半抑制浓度为7 860 mg/L。
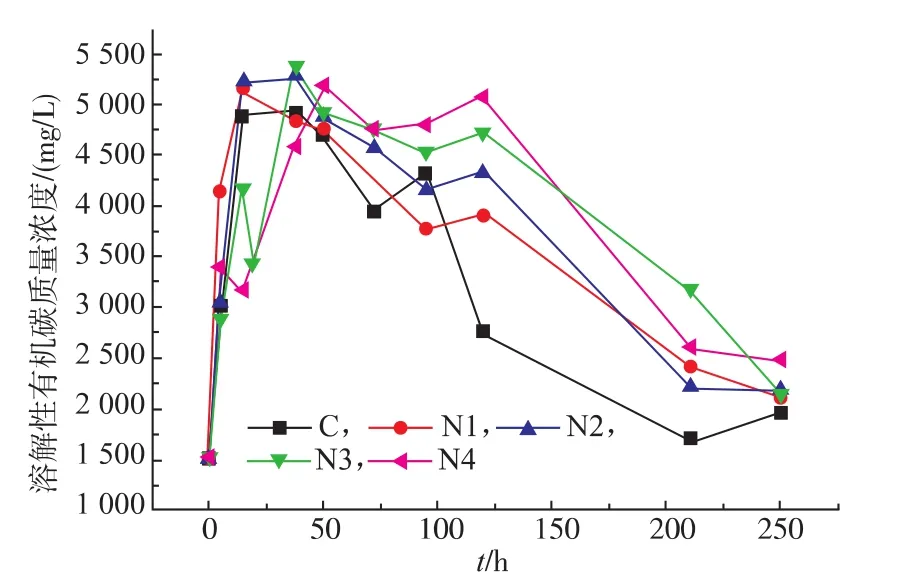
图4 不同氨氮质量浓度下各组分溶解性有机碳变化情况Fig.4 Trends ofdissolved TOC under different concentrations of ammonia
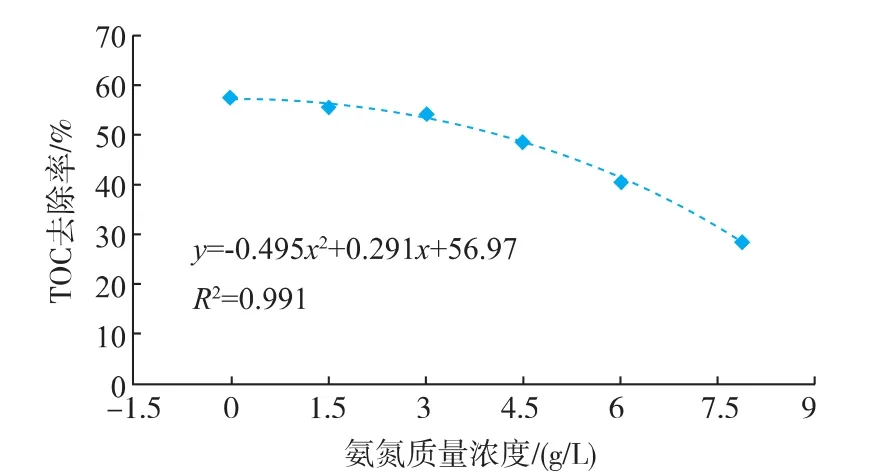
图5 不同氨氮质量浓度下总有机碳去除率Fig.5 Removal of TOC under different concentrations of ammonia
2.3 氨氮质量浓度变化对反应体系挥发性脂肪酸积累的影响
挥发性有机酸的累积会造成反应体系酸碱度变化,进而影响产甲烷活性[19]。从图6可知,反应体系中挥发性脂肪酸(VFA)质量浓度呈现先上升后下降的趋势。

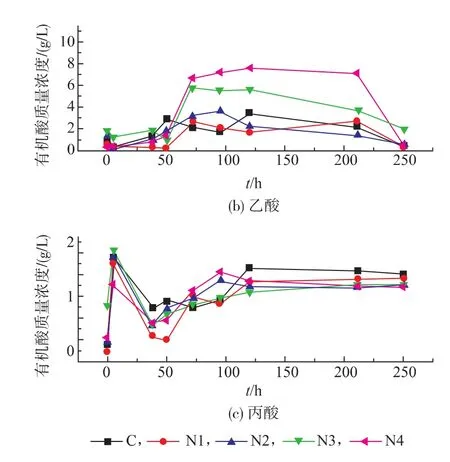
图6 不同氨氮质量浓度下挥发性脂肪酸变化情况Fig.6 Trends of VFAs under different concentrations of ammonia
其中乙酸作为最主要成分,在累积量达到最高时,占挥发性脂肪酸总量的72.4%,此时挥发性脂肪酸总质量浓度和乙酸质量浓度分别为10.5 g/L和7.6 g/L。由此看出:反应体系中乙酸型产甲烷微生物的活性随氨氮质量浓度提高受抑制程度明显。反应的初始阶段,由于外源性氨氮尚未进入微生物细胞,氨氮对产甲烷菌的活性抑制不明显,以乙酸为主的挥发性有机酸被及时利用,未出现大量累积,质量浓度维持在较低水平,反应第38小时前各组乙酸质量浓度均小于 2 g/L,分别为 1.2、0.3、1.0、1.7 g/L和0.7 g/L。
随着反应的进行,氨氮抑制效应逐渐显现,挥发性脂肪酸迅速积累。随着氨氮质量浓度的上升,挥发性脂肪酸累积速率逐渐提高,除对照组外,质量浓度分别从第 38 小时的 4.9、3.2、4.5、3.6、3.7 g/L升高到 7.8、7.2、8.2、8.5、10.5 g/L, 相应乙酸质量浓度则从 1.2、0.3、1.0、1.7、0.7 g/L 升高到 3.0、2.8、3.7、5.6、7.6 g/L。这表明:氨氮质量浓度越高,产甲烷活性受抑制程度越严重。在反应末期,厌氧消化系统有机酸最终被利用,则表明:一方面,虽然氨氮对产甲烷活性有明显抑制效应,但是在实验设定的氨氮质量浓度梯度范围内未完全抑制;另一方面,反应体系剩余有机碳主要体现在未被水解的餐厨垃圾里,氨氮对水解阶段抑制较为缓慢,反应进行相当长时间后水解阶段才被完全抑制。
研究表明:在反应体系中,丙酸出现了明显的积累,反应初始阶段,丙酸迅速积累至峰值,质量浓度达到1.9 g/L;随着反应的进行,丙酸质量浓度虽有下降,但迅速上升到较高水平,并保持在1 g/L以上。Hanaki[20]认为,抑制甲烷活性的丙酸质量浓度是1 g/L。而本实验中的丙酸质量浓度均高于1 g/L。结合溶解性有机碳积累情况分析,由于反应初始阶段产甲烷活性未受到外源性氨氮抑制,因此丙酸质量浓度的迅速升高主要是由于反应体系水解速率过快,产甲烷活性不能及时利用水解产物所致;但随着产甲烷活性的逐渐提高,起初积累的丙酸逐渐被转化利用,而之后丙酸的积累主要是由于氨氮抑制所引起的。外源性氨氮的加入对丙酸的积累有一定的作用,相应地消除了部分丙酸对产甲烷活性的抑制效应。
反应体系中丁酸随反应过程的进行其质量浓度始终保持较低且无明显变化。
3 结语
1)整个反应过程呈现出两个产气高峰阶段,外源氨氮对厌氧消化体系的抑制主要体现在产气速率峰值的降低以及使产气过程延迟。两个产气高峰,氨氮质量浓度达到6 000 mg/L时的最大产气速率均最低,分别为对照组的44.8%和45%,相应产气高峰时间比对照延迟6 h和42 h;累积产气量随氨氮质量浓度升高明显降低,氨氮质量浓度达到6 000 mg/L时累积产气量比对照组减少14.8%。
2)氨氮质量浓度的升高,溶解性有机碳初始积累速率降低,甲烷菌对其利用能力也逐渐降低。氨氮抑制餐厨垃圾厌氧消化过程的半抑制浓度为7 860 mg/L。
3)反应体系有机碳的积累主要是由于餐厨垃圾未被水解,氨氮对水解阶段抑制较为缓慢,氨氮质量浓度的升高造成丙酸积累逐渐下降,一定程度上缓解丙酸抑制产甲烷活性。
[1]Shi Y,Zhao X T,Cao P,et al.Hydrogen bio-Production through anaerobic microorganism fermentation using kitchen wastes as substrate[J].Biotechnol Lett,2009,31(9):1327-1333.
[2]Cao X Y,Zhao Y C.The influence of sodium on biohydrogen production from food waste by anaerobic fermentation[J].J Mater Cycles Waste Manag,2009(11):244-250.
[3]Shin H S,Youn J H,Kim S H.Hydrogen production from food waste in anaerobie mesophilic and thermophilic aeidogenesis[J].Int J Hydrogen Energy,2004,29:1355-1363.
[4]王寿权,严群,阮文权.蓝藻猪粪共发酵产沼气初步研究[J].食品与生物技术学报2008,27(5):108-112.WANG Shouquan,YAN Qun,RUAN Wenquan.Research of anaerobic digestion of blue-green algae and pig manure[J].Journal of Food Science and Biotechnology,2008,27(5):108-102.(in Chinese)
[5]Hansen K,Ahring H.Quantification of syntrophic fatty acid-β -oxidizing bacteria in a mesophilic biogas reactor by oligonucleotide probe hybridization[J].Applied and Environmental Microbiology,1999,65(11):4767-4774.
[6]Cheng J,Liu B.Swine wastewater treatment in anaerobic digesters with floating medium[J].Transactions of the American Society of Agriculture and Biological Engineers,2002,45(3):799-805.
[7]Noike T,Goo I S,Matsumoto H,et al.Development of a new type of anaerobic digestion equipped with the function of nitrogen removal[J].Water Science and Technology,2004,49(5-6):173-179.
[8]Ulundag-Demirer S,Demirer G N,Frear C,et al.Anaerobic digestion of dairy manure with enhanced ammonia removal[J].Journal of Environment Management,2008,86(1):193-200.
[9]Koster I W,Lettinga G.The influence of ammonium-nitrogen on the specific activity of palletized methanogenic sludge[J].Agric Wastes,1984,9(3):205-216.
[10]Van Velsen A F M.Adaptation of methanogenic sludge to high ammonia-nitrogen concentrations[J].Water Res,1979,13(10):995-999.
[11]Koster I W.Characteristics of the pH-influenced adaptation on methanogenic sludge to ammonia toxicity[J].J Chem Tech Biotechnol,1986,36:445-455.
[12]Dpbt B,Strik A M,Domnanovich P Holubar.A pH-based control of ammonia in biogas during anaerobic digestion of artificial pig manure and maize silage[J].Process Biochemistry,2006,41:1235-1238.
[13]Lee Y L,Miyahara T,Noike T.Effect of pH on microbial hydrogen fermentation[J].J Chem Technol Biotechnol,2002,77:694-698.
[14]Hector M,Poggi-Varaldo Jan,Oleszkiewicz A.Anaerobic co-composting of municipal solid waste and waste sludge at high total solid levels[J].Environ Technol,1992,13:409-421.
[15]国家环保局.水和废水监测分析方法[M].第4版.北京:中国环境科学出版社,2002.
[16]Hall N G,Schonfeldt H C.Total nitrogen vs.amino-acid profile as indicator of protein content of beef[J].Food Chemistry,2013,140(3):608-612.
[17]Dubois M,Gilles K A,Hamilton J K,et al.Colrimetric method for determination of sugars and related substances[J].Anal Chem,1956,28(3):350-356.
[18]Liu X L,Liu H,Chen J H,et al.Enhancement of solubilization and acidification of waste activated sludge by pretreatment[J].Waste Management,2008,28(12):2614-2622.
[19]Killilea J E,Colleran E,Scahill C.Establishing procedures for design,operation and maintenance of sewage sludge anaerobic treatment plants[J].Water Sci Technol,2000,41(3):305-312.
[20]Hanaki K,Hirunmasuwan S,Matsuo T.Protection of methanogenic bacteria from low pH and toxic materials by immobilization using polyvinyl alcohol[J].Water Res,1994,28(4):877-885.
